新型钙基吸收剂捕集CO2和脱除焦油的研究
2018-07-25钟英杰
张 媛, 韩 龙, 林 康, 张 浩, 钟英杰
(浙江工业大学 能源与动力工程研究所,杭州 310014)
基于CaO的生物质吸收体强化重整(AER)气化技术得到国内外研究者的广泛关注,该技术可以制备含有高纯H2的合成气,同时获得含高浓度CO2的烟气[1-2]。在该技术中CaO可在气化炉内捕集CO2并且发挥一次法脱除焦油的作用。总体上讲,通过CaO与CO2的碳酸化反应和CaCO3的煅烧分解,CaO得以在气化炉和煅烧炉之间循环利用。但是普通CaO吸收剂在利用时存在以下问题[3]:(1)在该技术中,CaO需经过多次“煅烧-碳酸化”循环反应,其反应活性至关重要。但几乎所有钙基吸收剂均存在活性衰减的问题[4-6]。(2)虽然CaO有利于生物质焦油的脱除,但是效果有限。同时,焦油重整的产物积碳会覆盖CaO分子活性位点[7],进一步降低CaO捕集CO2的性能。(3)CaO的磨损问题也不容忽视。CaO吸收剂进入高温流化床后,受热应力、化学应力的作用以及颗粒之间碰撞会导致磨损破碎,造成吸收剂损失[8]。
为解决上述问题,国内外众多研究者开展了针对性研究。Li等[9]制备出75%/25%(质量比)的CaO/Ca12Al14O33,并进行了50次循环煅烧/碳酸化(CCCR)反应,结果发现吸收剂仍能保持40%以上的吸收能力,原因是存在一种不与CO2反应的稳定物质——钙铝石(Ca12Al14O33),其均匀分布在CaO微晶之间,有效地防止了CaO颗粒的烧结。陈惠超等[10]发现CaSiO3和Ca12Al14O33可作为CaO或CaCO3颗粒间的物理拦截物,在改性吸收剂中起到“骨架”的作用,抑制吸收剂的烧结。Sedghkerdar等[11]也证实由于Ca12Al14O33的存在,可以减轻吸收剂烧结,使吸收剂经历31个循环后仍具有高CO2吸收能力。此外,少数研究者发现钙铝石也有利于提高吸收剂的机械强度。Manovic等[12]发现Al2O3与CaO合成的CaO/Ca12Al14O33具有优良的机械强度,吸收剂的磨损损失减小,提高了在流化床反应系统中使用的可能性。然而,大多数针对CaO的研究主要集中在燃烧后CO2捕集领域,很少关注到吸收剂强化焦油脱除的作用。在焦油脱除方面,CaO耦合金属催化成分也许是一个可行的选择。Zamboni等[13]发现以钙铝石为载体,将橄榄石与CaO结合形成一种新型吸收剂,可以提高焦油重整反应活性并且获得了相当好的CO2吸收稳定性,其原因是CaO负载橄榄石可以使铁氧化物在橄榄石表面更好地分散,橄榄石表面的氧化铁有利于促进焦油C—C键断裂,从而提高了橄榄石的焦油脱除活性。但是,针对吸收剂循环碳酸化反应性和吸收剂机械强度的研究较少。
笔者旨在开发一种新型CaO复合吸收剂,将钙铝石作为载体,同时耦合氧化铁和CaO,通过一系列的物理和化学表征实验,验证新型吸附剂脱除焦油、提高碳酸化反应稳定性和机械强度的效果。
1 实验
分别使用一水醋酸钙[Ca(CH3COO)2·H2O]、九水硝酸铁(Ⅲ)[Fe(NO3)3·9H2O]和九水硝酸铝[Al(NO3)3·9H2O]作为CaO、铁氧化物和钙铝石的前驱物。3种试剂均为试剂级,从上海西安化工有限公司购买。将一水醋酸钙在马弗炉中以5 K/min的升温速率从常温加热至900 ℃并恒温2 h,将制成的CaO粉末冷却、研磨至250~310 μm,将得到的粉末转移到密封的试剂瓶中保存备用。
1.1 吸收剂制备
1.1.1 新型吸收剂Ca-Al-Fe的制备方法
采用两步法合成Ca-Al-Fe吸收剂,如图1所示。

图1 新型Ca-Al-Fe吸收剂的制备过程Fig.1 Preparation of the newly developed Ca-Al-Fe sorbent
第一步是将铝盐与CaO相结合。1 g CaO和1.084 g Al(NO3)3·9H2O混合溶于10 mL 2-丙醇和50 mL蒸馏水中,使最终吸收剂中CaO∶Ca12Al14O33的质量比为75∶25。将混合后的溶液在75 ℃下加热搅拌1 h后,放入120 ℃的烘箱中干燥。然后将干燥好的固体放入马弗炉煅烧,以5 K/min加热至500 ℃并保持1 h,并以相同的升温速率进一步加热至1 000 ℃并保持1 h。将煅烧后的固体最终研磨成250~310 μm的粉末。
第二步通过溶胶-凝胶法将0.721 5 g Fe(NO3)3·9H2O与第一步获得的粉末混合,溶于225 mL蒸馏水中。搅拌溶液并加入适量的柠檬酸,溶液pH值调至3。将所得的溶液在80 ℃下加热搅拌获得溶胶,然后在120 ℃的烘箱中干燥成凝胶。之后,将干燥的凝胶研磨成粉末并加入适量的蒸馏水,手工成形为直径3~4 mm的球体。接着将球体以2 K/min的升温速率加热至900 ℃并保持4 h。最后,将球体转移至试剂瓶中保存。
1.1.2 普通CaO的制备方法
为了与新型Ca-Al-Fe吸收剂进行比较,制备普通CaO吸收剂。方法如下:向CaO粉末中添加适量的蒸馏水,手工成形为直径3~4 mm的球体。令球体在120 ℃下干燥,并在900 ℃下煅烧1 h。
1.2 化学性质表征
利用X射线衍射(X-ray diffraction,XRD)和拉曼光谱(Raman Spectra)来测定吸收剂的化学成分。XRD仪器型号为ThermoARLx'tra,主要用来测定吸收剂化合物晶体的形态,在10°~90°(2θ)的范围内收集XRD图谱。拉曼光谱仪型号为LabRam HR UV,用于验证吸收剂中是否含有游离氧O2-。光谱仪激光的波长为532 nm,扫描范围为100~4 000 cm-1。采用热重分析仪(TGA)检测吸收剂的循环碳酸化性能,设备型号为TherMax500。对于每个循环“碳酸化-煅烧”实验,首先将吸收剂从室温加热至720 ℃并保持30 min,然后进一步加热至850 ℃并保持10 min;850 ℃煅烧后,将样品冷却至720 ℃,继续下一个循环。TGA实验中的气体始终保持25%CO2和75%N2(25%和75%代表体积分数),体积流量为20 mL/min,加热和冷却速率保持在20 K/min。
为了验证合成吸收剂对催化生物质焦油和CO2捕集的影响,进行了生物质热解的热重傅里叶变换红外(TG-FTIR)测试,以检测小麦秸秆热解中焦油物质和气体的演变。小麦秸秆的粒径为0.15~0.21 mm,其工业分析和元素分析如表1所示。热重以及红外分析实验设备采用梅特勒-托利多TGA/DSC2热分析仪和Nicolet 6700型傅里叶红外光谱仪,红外光谱波数范围400~4 000 cm-1,分辨率为4 cm-1。每次运行时,麦秆的质量精确控制在5.4 mg。加入Ca、Ca-Al-Fe吸收剂的量分别为10.3 mg和16.1 mg,使得每种吸收剂中的钙与小麦秸秆中碳的物质的量比可以保持在1∶1。对于每个TG-FTIR测试,所有小麦秸秆样品总是先填充到坩埚中,随后加载吸收剂以在小麦秸秆上均匀分布。使用纯度大于99.99%(体积分数)的氮气作为热解载气,体积流量为30 mL/min。将实验样品(纯麦秆或不同吸收剂混合的麦秆)以20 K/min的升温速率从室温动态加热至900 ℃。在热解过程中释放的挥发物通过加热至260 ℃(避免焦油冷凝)的特氟龙管转移至FTIR气体池。
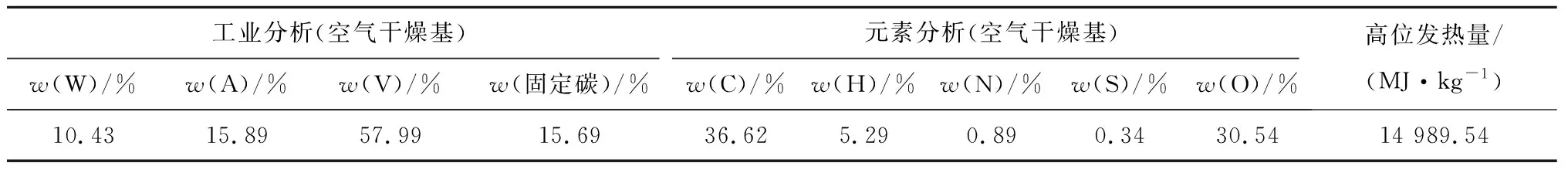
表1 麦秆的工业分析与元素分析Tab.1 Proximate and ultimate analysis of the wheat-straw
1.3 物理性质表征
对吸收剂的物理性质进行了表征和测试,包括吸收剂的表观形貌、孔隙特征和机械强度。通过扫描电子显微镜结合能谱仪(SEM-EDS,SIRON)检查吸收剂的形貌特征和金属元素的组成。在SEM测试前,需要将吸收剂样品涂覆含金-铂的薄层。通过BET法(Quantachrome,ASAP2010)测定吸收剂的表面积、孔体积和平均孔径。使用基于重力的方法来测试吸收剂的机械强度。对于每个机械强度测试,4个吸收剂球体分别位于4 cm×4 cm见方的4个角处。然后,将平坦的圆形木板放在4个球体的顶部,保持其几何中心与正方形的中心重合,接着将逐渐增加放在木板上重物的质量,直到4个吸收剂球体同时被压碎。对于每种类型的吸收剂,均进行3次机械强度测试,平均质量用于重力计算。吸收剂的机械强度最终通过重物的总重力除以正方形的面积(m2)获得。
2 结果与讨论
2.1 化学成分
图2给出了各吸收剂的XRD谱图。循环碳酸化-煅烧反应后废弃吸收剂的XRD谱图与新鲜吸收剂对应相同,因此不给出。2种钙基吸收剂均在32.1°、37.4°、53.8°、64.9°和67.4°处出现明显的CaO衍射峰。因此,通过煅烧Ca(CH3COO)2·H2O可以获得纯CaO。
Ca-Al-Fe吸收剂包含了CaO、Ca12Al14O33和Fe2O3晶相。Al(NO3)3·9H2O先通过方程式(1)分解生成Al2O3。当温度保持在900 ℃时,通过方程式(2)会生成Ca12Al14O33。Fe(NO3)3·9H2O,通过式(3)分解生成Fe2O3。
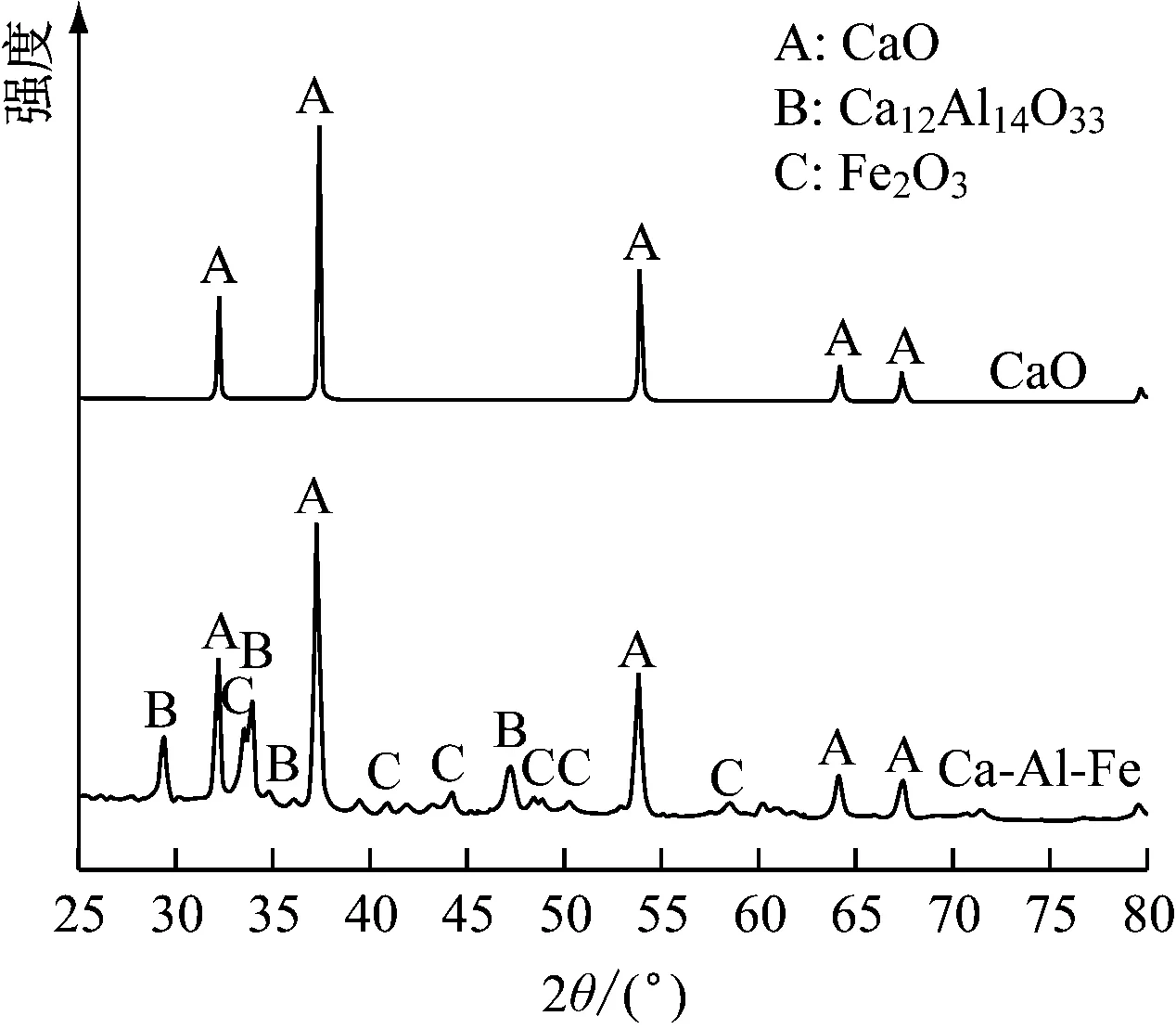
图2 各吸收剂的XRD谱图Fig.2 XRD results of different sorbents
4Al(NO3)3·9H2O=2Al2O3+12NO2+
3O2+36H2O
(1)
7Al2O3+12CaO=Ca12Al14O33
(2)
4Fe(NO3)3·9H2O=2Fe2O3+12NO2+
3O2+36H2O
(3)
图3给出了CaO和Ca-Al-Fe吸收剂的拉曼光谱图。在光谱1 080 cm-1处出现对应于游离氧O2-的特征峰。在Ca-Al-Fe吸收剂中发现了这一特征峰,而在Ca吸收剂中没有发现。该结果进一步证明Ca-Al-Fe吸收剂中钙铝石的存在。

图3 各吸收剂的拉曼光谱图Fig.3 Raman spectra of various sorbents
2.2 对生物质热解挥发分析出及焦油生成的影响
图4给出了麦秸以及其与不同吸收剂混合热解的TG(热重分析)和DTG(微分热重)曲线,定义v为反应温度下的失重速率。麦秆热解在60~120 ℃和250~345 ℃内显示出2个质量损失阶段。除了这2个阶段,与吸收剂混合的小麦秸秆的热解还存在350~450 ℃和620~730 ℃的另外2个独立阶段。

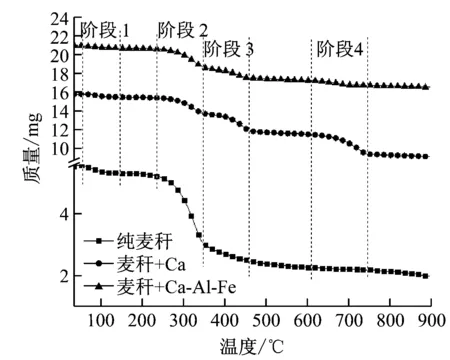
(a)

(b)图4 麦秆热解以及其与不同吸收剂混合的TG和DTG曲线
Fig.4 TG and DTG curves of wheat-straw pyrolysis with and without sorbents
表2麦秆热解实验的TG、DTG特征参数
Tab.2TGandDTGcharacteristicparametersofwheat-strawpyrolysis

参数实验样品1纯麦秆2麦秆+Ca3麦秆+Ca-Al-FeΔm1/mg0.230.310.27Δm2/mg2.251.601.88Δm3/mg0.701.901.21Δm4/mg0.072.110.51(dm/dT1)/(mg·K-1)4.955.253.30T1/℃838383(dm/dT2)/(mg·K-1)36.9128.9933.28T2/℃328327328(dm/dT3)/(mg·K-1)—27.0612.73T3/℃—442435(dm/dT4)/(mg·K-1)—29.626.31T4/℃—728682
CaO+CO2=CaCO3
(4)
通过比较纯麦秆和添加Ca-Al-Fe吸收剂的麦秆热解的第二阶段发现,添加Ca-Al-Fe吸收剂的麦秆热解过程中的失重量和失重速率均比纯麦秆的小,可见添加Ca-Al-Fe吸收剂有利于捕集CO2。通过比较两者在第四阶段的失重量也可验证这一结论。通过第二、第四阶段失重量的比较发现,添加Ca吸收剂比添加Ca-Fe-Al吸收剂的麦秆在第二阶段的总失重量小,而在第四阶段的失重量大。可以看出,CaO吸收剂的碳酸化活性高于Ca-Al-Fe吸收剂。在实际应用中,还应考虑多循环碳酸化性能。在本文中,Ca-Al-Fe吸收剂在多循环碳酸化反应中更稳定,在第2.3节将对2种吸收剂的多循环碳酸化性能进行讨论。
图5给出了纯麦秆与添加钙基吸收剂的麦秆在第一失重阶段DTG曲线峰值温度的红外光谱图。该阶段的主要产物是H2O(特征吸收峰为1 508 cm-1和3 743 cm-1),主要是麦秆的物理吸附水解析得到的。

图5 FTIR光谱图在第一失重阶段的DTG曲线峰值处的变化Fig.5 Comparison of FTIR spectra at DTG peaks in the first stage
图6给出了纯麦秆和添加2种吸收剂的麦秆在热解过程中质量损失主要阶段的挥发分红外光谱图。在该阶段,纯麦秆和添加吸收剂的麦秆热解时产生的挥发分基本相同,其主要挥发分为H2O(特征吸收峰为670 cm-1)、CO2(特征吸收峰为2 357 cm-1)、CO(特征吸收峰为2 181 cm-1)和少量的CH4(特征吸收峰为2 870 cm-1),还出现焦油类物质甲苯(特征吸收峰为2 933 cm-1),其他焦油类物质如苯酚(特征吸收峰为1 360 cm-1)和蚁酸(特征吸收峰为1 745 cm-1)。随着Ca-Al-Fe吸收剂的加入,CO2的析出量减小,说明热重分析中该阶段失重率降低的一个重要原因是CaO通过碳酸化反应(式(3))吸收了CO2。同时,可以观察到添加Ca-Al-Fe吸收剂后,麦秆热解的焦油类化合物如甲苯、苯酚以及蚁酸的析出量均减小。因此,焦油析出量的减少也是热解第二阶段失重率降低的原因,证明Ca-Al-Fe吸收剂能够对焦油类物质的分解转化起到促进作用。综上所述,在麦秆热解过程中添加Ca-Al-Fe吸收剂不但能够捕集CO2,而且还能促进焦油分解转化。然而在CO2特征峰2 357 cm-1处,纯麦秆的Δh(峰值与其基准线的吸光度差值)为0.055,添加Ca吸收剂的Δh为0.027,添加Ca-Al-Fe吸收剂的Δh为0.035。可见,纯CaO吸收CO2的量较多,Ca-Al-Fe吸收剂吸收CO2的量较小,在第一次循环中,纯CaO的碳酸化活性比Ca-Al-Fe吸收剂的好。
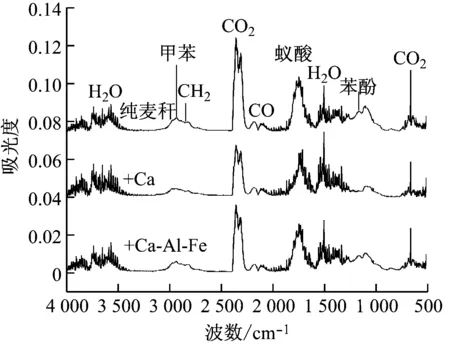
图6 FTIR光谱图在第二失重阶段的DTG曲线峰值处的变化
Fig.6 Comparison of FTIR spectra at DTG peaks in the second stage
图7给出了麦秆热解第三失重阶段DTG曲线峰值温度的红外光谱图。该阶段的纯麦秆热解主要析出的是CO2和H2O等小分子气体,而添加钙基吸收剂的麦秆热解析出的主要是H2O。添加Ca基吸收剂的麦秸热解析出的H2O的吸光度均大于纯麦秆热解析出的H2O的吸光度,原因有2个:(1)吸收剂成分中Ca(OH)2受热析出水(式(5));(2)Ca(OH)2吸收CO2释放出H2O(式(6))。由图7可以发现,添加钙基吸收剂的红外光谱图上明显没有CO2。因此,该阶段也体现了钙基吸收剂对CO2的吸收和捕集作用。
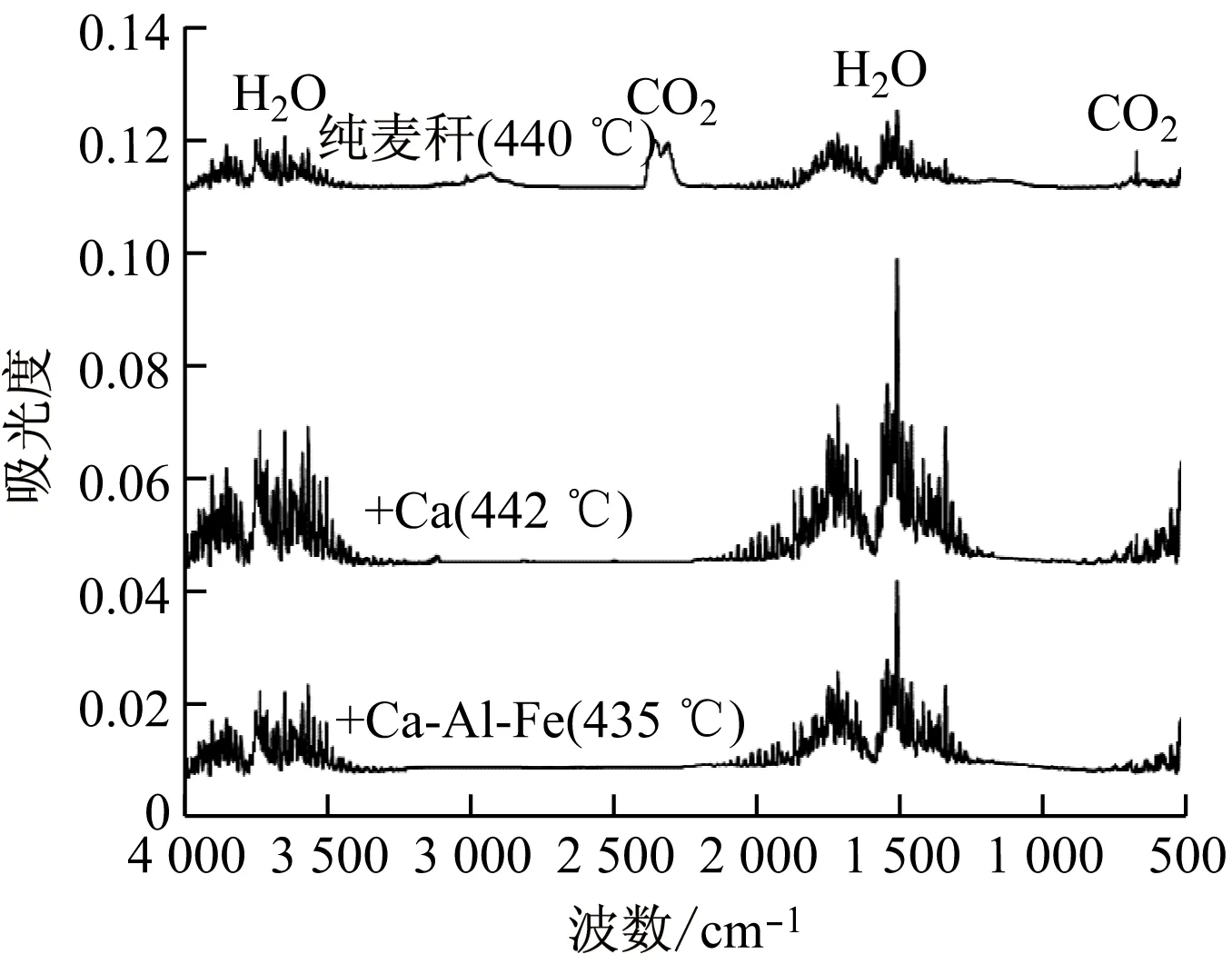
图7 FTIR光谱图在第三失重阶段的DTG曲线峰值处的变化Fig.7 Comparison of FTIR spectra at DTG peaks in the third stage
Ca(OH)2=CaO+H2O
(5)
Ca(OH)2+CO2=CaCO3+H2O
(6)
图8给出了麦秆热解第四失重阶段DTG曲线峰值温度的红外光谱图。纯麦秆热解采用了710 ℃时的红外光谱,该温度与添加钙基吸收剂实验的DTG峰值温度具有可比性。纯麦秆热解在第四失重阶段析出的CO2主要由羰基化合物的二次热裂解形成[15]。相比于纯麦秆热解,添加Ca-Al-Fe吸收剂后麦秆热解时CO2的析出量更多,原因在于大量的CO2在热解第二失重阶段被CaO吸收后,在第四失重阶段通过CaCO3的高温煅烧分解(式(7))重新析出。由于CO2的分压力提高,可能有利于通过Boudouard反应进行碳分解(式(8)),这导致部分CO的形成。结合表2可以看出,Ca吸收剂相比Ca-Al-Fe吸收剂而言,在第二失重阶段Δm2最小,但在第四失重阶段Δm4最大,也证明在第一次循环中,Ca吸收剂捕集CO2的性能较好。
CaCO3=CaO+CO2
(7)
C+CO2=2CO
(8)

图8 FTIR光谱图在第四失重阶段的DTG曲线峰值处的变化Fig.8 Comparison of FTIR spectra at DTG peaks in the fourth stage
2.3 循环碳酸化反应性能
图9给出了2种吸收剂循环捕集CO2的热重结果。每种吸收剂的质量均已被归一化为1 mg,以便进行比较。从图9可以看出,碳酸化-煅烧反应中,Ca-Al-Fe吸收剂在20个循环反应中表现出优越的循环碳酸化稳定性。Ca-Al-Fe吸收剂在第一个循环中CO2吸收量达0.42 mg/mg。在前5个循环中,Ca-Al-Fe吸收剂的CO2吸收量基本稳定。在第20个循环结束时,Ca-Al-Fe吸收剂的CO2吸收量仍保持0.34 mg/mg。经过20个循环,Ca-Al-Fe吸收剂的CO2吸收量仅降低19%。虽然CaO吸收剂在第一个循环中CO2吸收量高达0.63 mg/mg,但是其循环碳酸化活性急速降低,且从第4个循环开始小于Ca-Al-Fe吸收剂。经过10个循环,CaO吸收剂的CO2吸收量仅为0.11 mg/mg,与第一个循环相比降低了82%。Martavaltzi等[16]制备了含钙铝石的Ca-Al吸收剂,其中CaO与Ca12Al14O33的质量比为75∶25。由图9可见,笔者开发的新型Ca-Al-Fe吸收剂与文献[16]中Ca-Al吸收剂均表现出稳定的循环碳酸化性能。与文献[16]中结果相比,新型吸收剂在CO2吸收量上略有优势。

图9 Ca-Al-Fe吸收剂的CO2循环捕集量的TG结果
Fig.9 TG results for cyclic CO2capture capacity of Ca-Al-Fe sorbent
为了更直观地比较吸收剂中CaO成分的碳酸化反应活性,需要分析不同吸收剂的CaO转化率,图10给出了2种吸收剂以及根据经验式(9)[17]获得的CaO吸收剂的转化率。XN为第N个循环的CaO转化率;fm和fw是经验参数,分别为0.77和0.17。
(9)
计算不同吸收剂的CaO转化率之前,需要确定吸收剂中CaO的含量。表3给出了不同吸收剂的金属元素和化学成分。Ca-Al-Fe吸收剂的金属元素物质的量比由X射线能谱分析(EDS)测得,结合EDS和扫描电子显微镜(XRD)结果计算得到CaO和其他化学成分的质量比。通过式(10)计算每种吸收剂的CaO转化率,其中XCaO为CaO转化率;Δm为吸收剂在相应碳酸化反应中质量的增加量;m0为吸收剂的初始质量;wCaO为吸收剂中CaO的质量分数,见表3。
(10)
从图10可以看出,Ca-Al-Fe吸收剂的CaO转化率显著高于纯CaO吸收剂。随着循环次数的增加,Ca-Al-Fe吸收剂的CaO转化率初始保持稳定然后缓慢降低,这与图9的研究结果一致。Ca-Al-Fe吸收剂在初始循环时的CaO转化率为84.8%,在第

表3 不同吸收剂的金属元素和化学成分的含量Tab.3 Metal elements and chemical compositions of different sorbents

图10 不同吸收剂的CaO碳酸化活性
Fig.10 CaO conversion rates with different sorbents in carbonation-calcination cycles
20个循环结束后仍高达67.9%。相反,纯CaO吸收剂的CaO碳酸化转化率随着循环次数的增加由初始循环的81.1%急剧下降到第20次循环的14.1%,与根据经验式(9)计算得出的理论值吻合良好。很明显,本文新型吸收剂Ca-Al-Fe的CaO循环碳酸化活性相比普通吸收剂有了较大改进,其原因是钙铝石可以均匀分布在CaO微晶中,抑制高温煅烧引起的CaO烧结。由图10还可以看出,Ca-Al-Fe吸收剂的CaO转化率高于Ca-Al吸收剂。Ca-Al吸收剂在前3个循环中CaO转化率略有提高,在第3个循环达到最大值62.9%,在随后的循环中缓慢降低至第20个循环时的54.3%。通过对比不同吸收剂CaO循环碳酸化活性得出以下结论:(1)Ca-Al-Fe吸收剂的循环碳酸化活性优于文献[16]中Ca-Al吸收剂,两者循环碳酸化稳定性均显著优于普通CaO吸收剂;(2)与文献[16]中的Ca-Al吸收剂相似,Ca-Al-Fe吸收剂中的Ca12Al14O33组分仍有助于抑制CaO高温烧结,改善了循环稳定性。
图11比较了Ca-Al-Fe吸收剂在不同循环时CO2捕集百分比dw(每g吸收剂吸收的CO2质量,%)及捕集速率dw/dt(%/min)随时间的变化。从图11可以看出,Ca-Al-Fe吸收剂的碳酸化过程仍呈现出快速反应的动力学控制阶段和反应较慢的气体扩散控制阶段[17]。随着循环碳酸化反应次数的增加,碳酸化初始阶段动力学反应区的反应速率并没有出现逐渐降低的趋势,而是始终保持一致,有利于吸收剂在流化床反应器中气固两相的快速反应。

图11 循环碳酸化过程中Ca-Al-Fe吸收CO2的动力学特性
Fig.11 CO2adsorption kinetics of Ca-Al-Fe sorbent during cyclic reactions
2.4 物理性能
2.4.1 吸收剂形态和孔隙特性
图12给出了2种吸收剂在循环前后的SEM(扫描电子显微镜)图像。图12(a)是Ca-Al-Fe吸收剂循环前的SEM图像,可以看出Ca-Al-Fe吸收剂呈现珊瑚形状,表现出具有大表面积和高孔隙率的多孔结构。循环后的Ca-Al-Fe吸收剂的结构中一些小孔闭合,发生部分烧结(图12(c)),但仍然可以认为相对小的孔在促进CO2扩散和活性位点吸附中起重要作用。图12(b)给出了循环前新鲜CaO的结构。新鲜CaO吸收剂呈现平均直径约为200~300 nm的明显小孔结构,颗粒之间有明显的界限和孔隙。然而20个循环后,吸收剂的颗粒形态几乎消失,可以清楚观察到微小颗粒的融合,从而形成更密集的表面以及显著的孔隙扩大,呈现出来的可能是由于热应力引起的偶有裂缝的平坦表面(图12(d)),表明与Ca-Al-Fe吸收剂相比其具有更严重的烧结结构,吸收剂孔隙率由于烧结而大大降低。循环反应期间CaO碳酸化反应性的大幅下降主要是由于吸收剂烧结引起的吸收剂孔隙率降低引起的。因此,在额外添加铁氧化物的情况下,Ca12Al14O33相仍能够在Ca-Al-Fe吸收剂内的CaO颗粒之间均匀分布,防止了颗粒由于烧结造成的过度聚集和孔径增大,对循环碳酸化反应有积极的效果。

(a) 新鲜Ca-Al-Fe吸收剂(b) 新鲜CaO吸收剂(c) 循环后Ca-Al-Fe吸收剂(d) 循环后CaO吸收剂
图12 循环前后各吸收剂的SEM图
Fig.12 SEM images of different sorbents before and after cyclic reactions
图13给出了2种吸收剂的氮吸附等温线。从图13可以很明显地看出Ca-Al-Fe吸收剂的吸收量比CaO吸收剂的更大,与SEM图中Ca-Al-Fe吸收剂的小孔比CaO吸收剂的更多一致。因此,为Ca-Al-Fe吸收剂有良好的多周期碳酸化反应性提供了良好的解释。表4给出了2种吸收剂的结构特性,包括比表面积、比孔体积和平均孔径。与CaO吸收剂相比,Ca-Al-Fe吸收剂拥有较大的比表面积和比孔体积以及较小的平均孔径,而具有较大的比表面积和较小的平均孔径是提高吸收剂性能的2个积极因素。

图13 不同吸收剂的氮吸附等温线Fig.13 Nitrogen sorption isotherms of different sorbents表4 循环前各吸收剂的比表面积测试法结果
Tab.4BETresultsforvarioussorbentsbeforecycliccarbonationreactions

吸收剂比表面积/(m2·g-1)比孔体积/(cm3·g-1)平均孔径/nmCa12.50.05418.30Ca-Al-Fe39.90.0788.88
2.4.2 机械强度
对2种吸收剂进行了机械强度分析。结果显示新鲜CaO吸收剂的机械强度仅为24.6 kPa,而Ca-Al-Fe吸收剂的机械强度为41.14 kPa。可见,Ca-Al-Fe吸收剂的高机械强度更适合于工程应用。
3 结 论
(1) Ca-Al-Fe吸收剂有利于在生物质热解中降低焦油类物质析出并捕集CO2。
(2) 与普通CaO吸收剂相比,Ca-Al-Fe吸收剂的循环捕集CO2量和CaO转化率显著提高。在铁氧化物存在的条件下,钙铝石仍能够改善吸收剂的孔隙结构,有效抑制吸收剂高温烧结。
(3) 与普通CaO吸收剂相比,Ca-Al-Fe吸收剂的机械强度显著提高,有利于减少钙基吸收剂在实际应用中由于磨损造成的损失。
