苹果HYL1基因在干旱中的表达与功能分析
2018-07-25王丽平姜丽娟马锋旺管清美
王丽平,姜丽娟,马锋旺,管清美
(1 西北农林科技大学 园艺学院,陕西 杨凌712100;2旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
苹果(Malusdomestica)是我国温带地区最主要的栽培果树之一,其优势产区多分布于干旱半干旱的温带地区。因此,干旱成为制约苹果生产的主要因素。随着分子生物学、组织培养和转基因等生物技术的成熟与迅速发展,研究者克隆了大量的苹果抗旱相关基因,并对其进行了模式植物拟南芥、烟草等的异位表达及对苹果自身的遗传转化研究。
目前,通过基因工程和转基因等生物技术手段已经获得了一些抗旱性增强的转基因植株。如苹果CBL互作蛋白激酶MdCIPK6L基因,在转基因拟南芥中能够响应包括干旱在内的多种非生物逆境胁迫[1];苹果珠眉海棠MzASMT1基因转入拟南芥后,在干旱处理下表达量显著上调,其过量表达使拟南芥中褪黑素含量上调2~4倍,过表达拟南芥中内源活性氧(ROS)含量则显著减少,从而使其具有更强的耐旱性[2];同样,将苹果抗旱基因在烟草中异位表达也可以提高转基因烟草的抗旱性[3-4]。近年来,也获得了一些苹果抗旱转基因植株,如将苹果MYB转录因子基因MdSIMYB1转化苹果后,过量表达的转基因苹果株系在各种非生物逆境条件下的抗性均出现显著增强[3];从新疆野苹果中分离出DREBs转录家族中的一个基因MsDREB6.2,发现该基因在苹果中过量表达可影响气孔的开张密度和根系生长,从而能够增强苹果的耐旱性[5]。
HYL1(HYPONASTIC LEAVES 1)基因自首次被发现以来[6],对其功能研究就主要集中在miRNA的合成方面,对其在抗逆尤其是抗旱机制中的功能研究尚未见报道。目前,HYL1的相关研究主要集中在模式植物拟南芥中且已经非常成熟,但在苹果中的研究则刚起步,现有研究发现其在苹果中主要参与了miRNA的合成、苹果树形结构的形成[7]、对IAA表达的响应[8]及非生物逆境胁迫[9]等过程。本研究通过克隆MdHYL1基因并将其转化入苹果,分析MdHYL1在苹果抗旱过程中的功能,并通过转基因手段获得抗旱苹果种质,以期为HYL1基因在抗逆分子机制中的研究及为苹果抗旱遗传改良提供参考。
1 材料与方法
1.1 材 料
1.1.1 植物材料 用于基因克隆和表达分析的试验材料为金冠(M.domestica)和楸子(M.prunifolia),用于转基因的苹果来自沈阳农业大学张志宏教授实验室的无性系GL-3[10]。
1.1.2 菌株、质粒与试剂 大肠杆菌(E.coli)感受态TOP10、pGWB414过表达载体、pDONR 222载体和用于遗传转化的农杆菌EHA105菌株等,均保存于西北农林科技大学园艺学院果树逆境生物学团队实验室;用于构建Gateway载体的BP酶和LR酶,购于上海Invitrogen公司;DNA聚合酶购于北京全式金生物技术有限公司;反转录试剂盒购于Thermo Fisher Scientific公司,质粒小提试剂盒和DNA纯化回收试剂盒购于天根生化科技有限公司;Premix RTaq、DNA Marker等购于大连宝生物工程有限公司;IAA、6-BA、IBA等植物激素购于Sigma-AIdrich中国公司;引物合成和测序由生工生物工程(上海)有限公司完成。
1.2 苹果MdHYL1基因的克隆
从拟南芥信息资源网站(Tair,http://www.arabidopsis.org/)中查找并下载AtHYL1蛋白的氨基酸序列,登录号为AT1G09700。将这条序列放到美国国立生物技术信息中心(NCBI,https://www.ncbi.nlm.nih.gov/)中与苹果基因组进行blastp搜索,筛选出一致性最高的苹果基因序列,并据此设计MdHYL1基因克隆的特异引物(F:5′-ATGTCCA-CAAACGAAGGCTTTC-3′;R:5′-TTAGCACAT-ATGTTGCACCTGC-3′)。采用改良CTAB法提取金冠叶片总RNA[11],将反转录得到的cDNA用作克隆MdHYL1的模板。PCR扩增体系如下:cDNA 0.2 μL,正向和反向引物各1 μL,dNTP 2.5 μL,TRANS 10×Pfu Buffer with MgSO45 μL,TRANS Pfu DNA polymerase 0.5 μL,ddH2O补至25 μL。反应程序为:95 ℃预变性2 min;95 ℃变性20 s,56 ℃退火20 s,72 ℃延伸2 min,35个循环;72 ℃延伸5 min。PCR扩增产物用1%的琼脂糖凝胶电泳检测,用回收试剂盒回收纯化后连接到入门载体pDONR222上,再转化至大肠杆菌感受态TOP10中,挑取阳性克隆,PCR检测后测序。
1.3 苹果MdHYL1基因的蛋白序列分析
运用NCBI数据库(https://www.ncbi.nlm.nih.gov/)的blastp功能,对已鉴定出的MdHYL1基因的蛋白序列进行比对,参数均为默认参数。将用于进化分析的物种蛋白序列下载下来,用DNAMAN软件进行比对,输出比对结果。然后使用MEGA 5.05,对苹果(Malusdomestica)、桃(Prunuspersica)、梅(Prunusmume)、水稻(Oryzasativa)、黄瓜(Cucumissativus)、枣(Ziziphusjujube)、大豆(Glycinemax)、油菜(Brassicanapus)和模式植物拟南芥(Arabidopsisthaliana)等9个物种的HYL1蛋白进行进化分析。以邻近法(Neighbor-joining,NJ)构建进化树,参数设置为:校验参数Bootstrap method=500,其余参数为默认参数。
1.4 苹果MdHYL1基因的表达分析
用于干旱胁迫下MdHYL1基因表达分析试验的材料为3个月大嫁接于平邑甜茶上的金冠苹果苗,生长条件为25 ℃,光照时间10 h/d。当土壤相对含水量为土壤最大含水量的85%时开始进行短期干旱处理,处理0,2,4,6,8 d后复水,在各时间点分别采样,每7株1个重复,每个处理3个生物学重复。组织特异性表达试验使用楸子苹果苗,叶片RNA用改良CTAB法提取[11],根、茎、花和果实RNA用天根生化科技有限公司的RNAprep Pure多糖多酚植物总RNA提取试剂盒提取。
RNA完整性采用1.5%琼脂糖凝胶电泳进行检测,用RNA反转录试剂盒进行反转录。RT-qPCR使用美国Bio-Rad公司的CFX96TM荧光定量PCR仪进行,以MdMDH为内参基因(引物序列为:F.5′-CGTGATTGGGTACTTGGAAC-3′;R.5′-TGGCAAGTGACTGGGAATGA-3′)。
1.5 苹果MdHYL1基因植物表达载体的构建
本试验选用pGWB414载体作为MdHYL1过量表达载体。将去掉终止密码子的MdHYL1全长序列转化到中间载体pDonor222上,通过Gateway重组技术(Invitrogen)将该序列构建到带有HA标签和选择标记基因NptⅡ的pGWB414载体上(结构如图1所示),然后将重组质粒用电击法转化农杆菌EHA105。

图1 MdHYL1基因植物表达载体MdHYL1-pGWB414的结构Fig.1 Structure of MdHYL1 plant expression vector MdHYL1-pGWB414
1.6 苹果MdHYL1基因的转化与转基因株系的鉴定
采用农杆菌介导的遗传转化方法[12],对苹果无性系GL-3进行MdHYL1基因的转化。将转基因苹果苗置于组培间,生长条件为温度25 ℃,光照时间10 h/d,光照强度3 000~5 000 lx。
转基因株系的鉴定采用PCR和RT-qPCR 2种方法。从采用卡那霉素筛选的抗性植株叶片中分别提取DNA和RNA,以提取的DNA为模板,使用特异性检测引物(F:5′-CAAGTGGATTGATGT-GATATCTCCACTACG-3′;R:5′-AGAAGGCGC-ATGGGAAGG-3′)进行电泳检测,以未处理的GL-3植株DNA为阴性对照。以转基因株系RNA反转录的cDNA为模板,进行RT-qPCR检测,定量引物为:F.5′-AGAAACCCACAGGAGACAAGGC-3′;R.5′-CATCATTATCGCAGGGAATCAAA-3′。内参基因使用MdHYL1表达分析所用的MdMDH基因。RT-qPCR反应体系为:GoTaq 10 μL,正向和反向引物各1 μL,cDNA 5 μL,ddH2O补至20 μL。RT-qPCR程序为:95 ℃ 2 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 45 s,45个循环;60~95 ℃,30 s,37个循环,即从第2个循环开始由60 ℃每次升高0.5 ℃,并在该温度下保持30 s,37个循环后达到95 ℃。每个株系均包含3个生物学重复,RT-qPCR加样时使用3个技术重复。用2-ΔΔCt法[13]计算MdHYL1基因在不同株系中的相对表达量。
1.7 MdHYL1过量表达转基因苹果根系的生长观测
将MdHYL1过量表达转基因苹果株系和未转基因对照同时进行扩繁生根,生根45 d后观察转基因株系与未转基因株系(对照)的根系生长情况。同时,对根系数目进行统计,以6株为1个重复计算根系数目的平均值,每组3个生物学重复。
2 结果与分析
2.1 苹果MdHYL1基因的克隆与序列分析
2.1.1 苹果MdHYL1基因的克隆 将拟南芥HYL1蛋白序列与美国国立生物技术信息中心(NCBI,https://www.ncbi.nlm.nih.gov/)中的苹果基因组序列进行blastp比对,筛选出一致性最高的苹果基因序列,登录号为XP_008338962,根据其设计基因克隆的特异引物。以金冠苹果叶片cDNA为模板,通过RT-PCR扩增出一段1 479 bp的序列(图2),全长开放阅读框为1 479 bp,编码492个氨基酸,位于chr15染色体上,将其命名为MdHYL1,与登录号为XP_008338962的基因序列完全一致。
2.1.2 苹果与其他物种HYL1蛋白序列的比对 将苹果与桃、梅、水稻、黄瓜、枣、大豆、油菜、拟南芥等共9个物种的HYL1基因的蛋白序列进行比对,结果(图3)显示,9个物种的HYL1基因蛋白序列的N端较保守,均含有2个非常保守的双链RNA结合结构域DSRM。
2.1.3 苹果MdHYL1蛋白的系统进化分析 为了研究苹果HYL1蛋白的系统进化过程,对苹果、桃、梅等9个物种的HYL1蛋白进行了系统进化分析,用于构建进化树的HYL1蛋白如表1所示。
表1 用于构建进化树的其他8个物种的HYL1-like蛋白Table 1 HYL1-like proteins used to construct phylogenetic tree from other eight species
由构建的进化树(图4)发现,MdHYL1蛋白在进化上与蔷薇科的梅和桃亲缘关系最近,与拟南芥、水稻、欧洲油菜亲缘关系较远。

图4 苹果和其他物种HYL1蛋白的系统进化分析Fig.4 Phylogenetic analysis of HYL1 homologous proteins from apple and other species
2.2 苹果MdHYL1基因的表达分析
2.2.1 苹果MdHYL1基因的组织特异性表达 为了研究MdHYL1基因在苹果不同组织和器官中的表达情况,分别提取了楸子根、茎、叶、花和果实的RNA,利用RT-qPCR的方法分析了MdHYL1基因在各器官组织中的表达。如图5所示,MdHYL1在楸子各器官和组织中均有表达,其中在茎、叶和花中表达量较高。与根中表达量相比,MdHYL1在叶片中的表达量最高(3.85倍),其次是茎(3.49倍)和花(3.30倍),在果实中的表达量最少(0.10倍)。
2.2.2 苹果MdHYL1基因在干旱胁迫下的表达 对金冠苹果苗进行短期干旱处理,并利用RT-qPCR方法研究MdHYL1基因在干旱胁迫下叶片中的表达情况。如图6所示,干旱处理不同时间MdHYL1基因表达量均上调,且随着干旱处理时间的延长,MdHYL1基因的表达量出现先升后降的趋势,在干旱处理6 d时表达量达到峰值,为处理0 d时的8.82倍;而在处理8 d后,MdHYL1基因表达量则稍微下降,但较未进行干旱处理的金冠苹果仍呈现上调表达,达到4.17倍;复水后,MdHYL1基因的表达量则又重新恢复。上述结果表明,MdHYL1基因可以响应干旱胁迫。
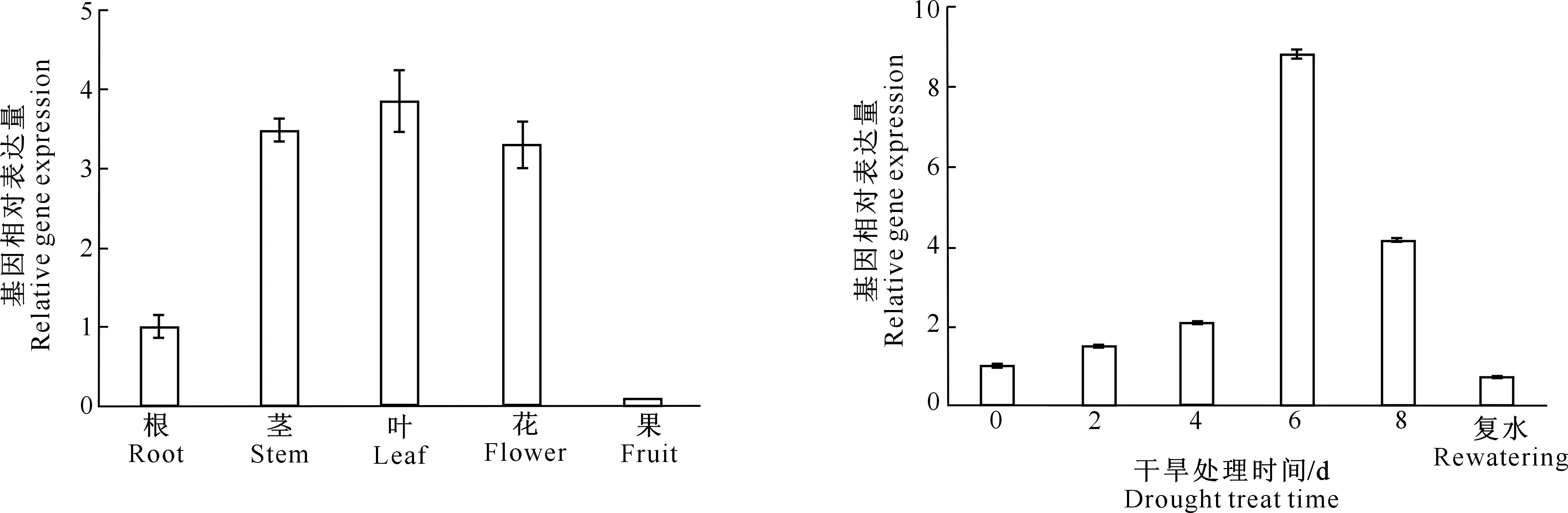
图5 MdHYL1在楸子中的组织特异性表达Fig.5 Tissue specific expression of MdHYL1 in Malus prunifolia
2.3 MdHYL1过量表达转基因苹果株系的鉴定
2.3.1 转基因株系的PCR检测 使用苹果无性系GL-3为材料,通过农杆菌介导法对苹果MdHYL1过量表达载体进行转基因,共获得3个对50 mg/L卡那霉素具有抗性的阳性株系,分别为OE#5、OE#10和OE#13。以这3个阳性株系的DNA为模板进行PCR检测,由于35S引物结合不特异,选取了pGWB414载体上35S上游的一段序列为正向引物,以MdHYL1全长开放阅读框上的一段序列作为反向引物进行PCR扩增。结果显示,3个阳性株系中均克隆出含有该片段的条带,而未进行转基因的GL-3株系则没有出现该条带(图7),表明这3个转基因株系中存在MdHYL1基因的插入,从DNA水平上可初步确认为转基因株系。

图7 MdHYL1过表达苹果株系的PCR检测Fig.7 PCR identification of MdHYL1 overexpression transgenic apple lines
2.3.2 转基因株系的RT-qPCR检测 从3个转基因阳性苹果株系的叶片中提取RNA,并进行了RT-qPCR检测分析,结果见图8。
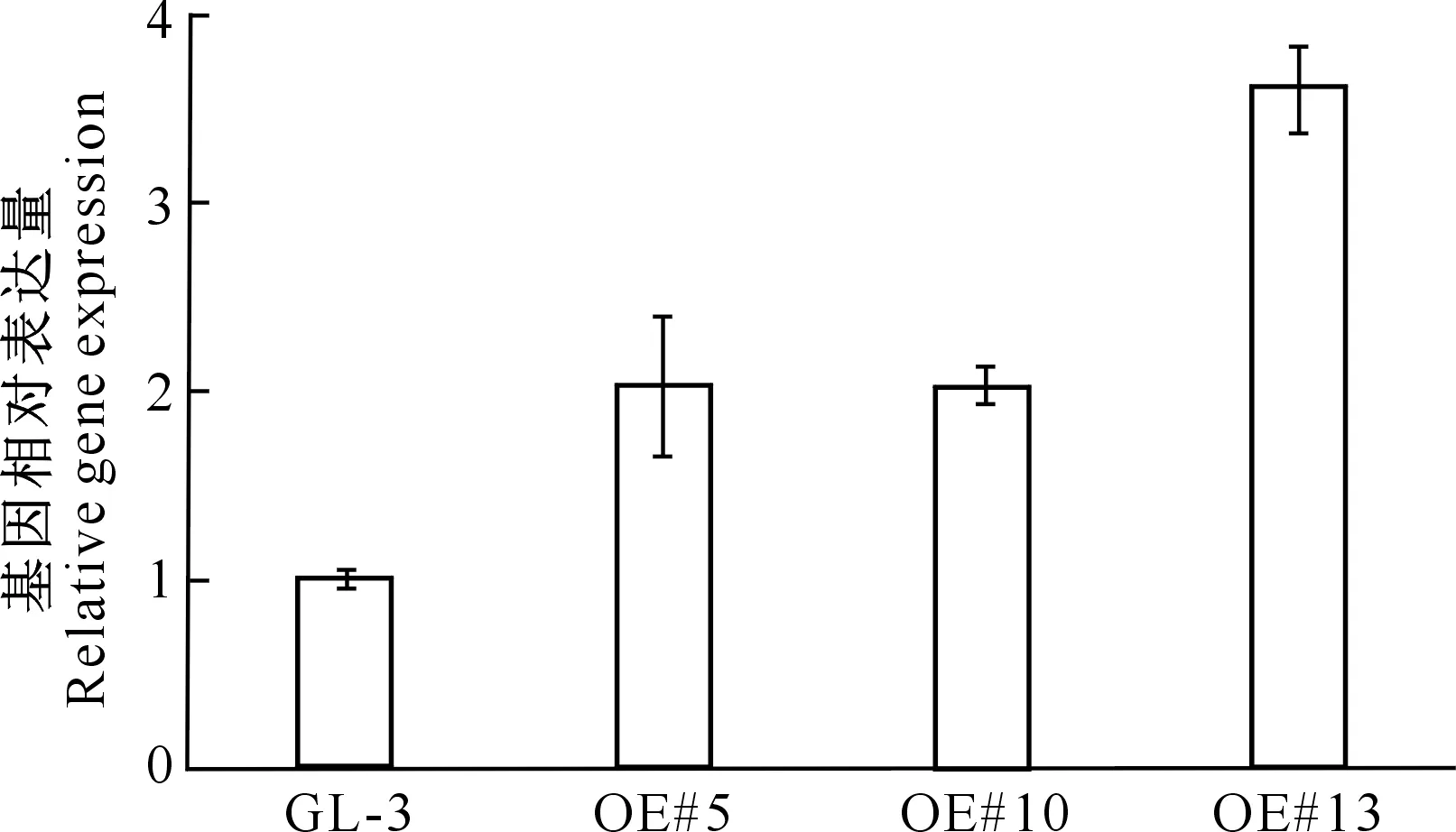
图8 MdHYL1在过表达转基因苹果株系中的mRNA相对表达量Fig.8 Relative mRNA expression of MdHYL1 in overexpression transgenic apple lines
图8表明,与阴性对照GL-3相比,3个转基因阳性株系中MdHYL1的表达量均出现上调,OE#5、OE#10和OE#13的相对表达量分别为GL-3的2.03倍、2.02倍和3.61倍,表明3个株系从转录水平上也可确定为MdHYL1过量表达株系。
2.4 MdHYL1过量表达转基因苹果株系根系的生长情况
将鉴定出来的3个MdHYL1过量表达转基因株系进行了扩繁生根,对根系数量进行统计(图9)后发现,3个转基因株系单株不定根的主根数目显著高于未转基因的对照GL-3,转基因株系单株不定根上的侧根以及整个不定根的数目极显著多于对照。
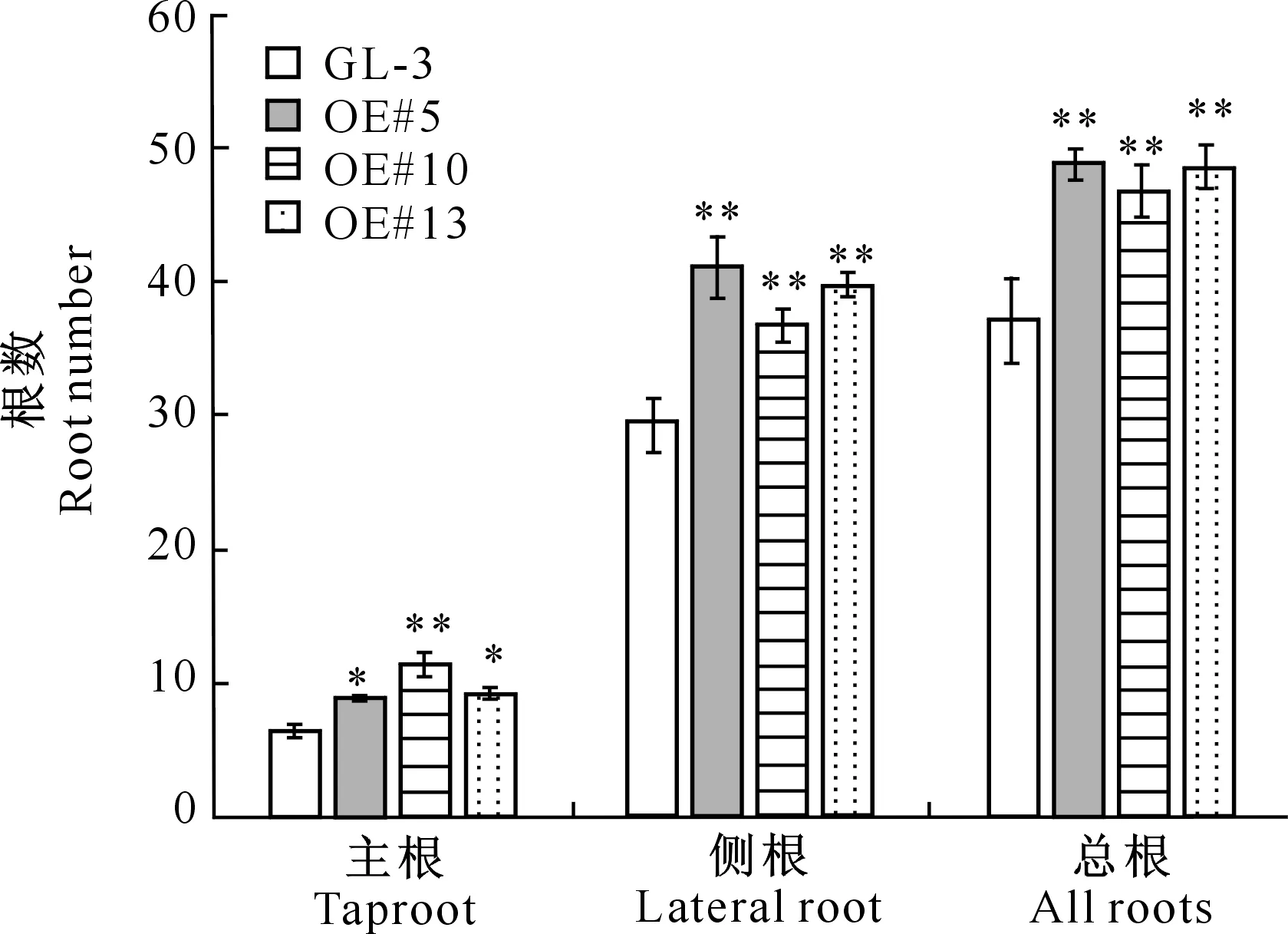
显著性分析选择双侧t分布检验:*.P<0.05;**.P<0.01Statistical significance was determined by a two-sided t-test: *.P<0.05;**.P<0.01图9 MdHYL1过量表达转基因苹果苗的根系数目Fig.9 Number of roots in MdHYL1 overexpression transgenic apple lines
对根系生长情况进行观察也发现,生根45 d后,转基因株系与对照相比根系发育明显发达,根系生长健壮且根系数目明显较多(图10)。

图10 MdHYL1过量表达转基因苹果苗的根系生长情况Fig.10 Root growth of MdHYL1 overexpression transgenic apple lines
MdHYL1基因在干旱下的表达量显著上调,且过量表达MdHYL1后转基因株系根系明显发达,而根系越发达则苹果抗旱能力越强,这些结果表明MdHYL1基因可能在苹果响应干旱的过程中发挥了重要作用。
3 结论与讨论
本研究以金冠苹果叶片cDNA为模板,通过PCR克隆得到MdHYL1基因,这也是该基因首次从金冠苹果中被克隆到。对MdHYL1蛋白进行系统进化分析,揭示出其在进化上的来源与蔷薇科的植物最为相近,与模式植物拟南芥和水稻则非常远。组织特异表达分析结果表明,该基因在苹果各个器官和组织中均有表达,表达量为叶>茎>花>根>果实。
通过构建MdHYL1基因的植物过量表达载体,成功转化苹果GL-3并获得3个转基因株系。测定MdHYL1基因在干旱胁迫下的表达情况发现,MdHYL1基因在干旱处理后表达量最大为未处理苹果株系的8.82倍,表明MdHYL1基因在干旱条件下被诱导表达,说明其在植物抗旱中具有重要作用。而在本实验室前期的研究中,通过对干旱处理下转基因苹果株系净光合速率、气孔导度、蒸腾速率和瞬时水分利用效率等生理参数的测定及存活率的统计,发现MdHYL1转基因苹果株系的抗旱能力显著增强(另文发表),再次证明了MdHYL1基因在干旱胁迫下起重要作用。进一步对转基因苹果表型进行观察,发现MdHYL1转基因苹果根系较未转基因的对照显著增多,而根系的发育与植物的抗旱能力具有明显的相关性,根系生长越茂盛则植株的抗旱能力越强,因此推测MdHYL1基因对于干旱的响应主要是通过促进根系的生长实现的。
由各个物种HYL1蛋白的序列比对结果发现,HYL1蛋白在各物种中N端都比较保守,尤其是两个双链RNA结合结构域DSRM,表明HYL1参与的miRNA合成过程中,结合双链RNA的特性在各个物种中都是比较稳定的。在拟南芥中,HYL1参与了miRNA介导的各生理过程,从最初发现与miRNA合成直接相关[14],到发现在miRNA合成过程中是通过与DCL1[15-17]、HEN1[18-19]、SE[20-21]、RCF3[22]等互作形成复合物来发挥作用,HYL1在miRNA合成过程中的功能研究已经非常成熟。除了直接参与miRNA的合成及响应IAA、CTK和ABA[6,23]等植物生长激素的调节过程外,HYL1还参与了miRNA介导的生理反应,如HYL1基因可以调控miR156的靶基因SPL基因的表达水平,从而调控miR156介导的拟南芥童期的营养生长过程[24];此外,它还参与了miRNA介导的内源小孢子囊和雌蕊结构的调控[25]、叶片近轴和远轴同一性的平衡[26]及气孔数目建成等生理过程[27]。以上研究表明,HYL1通过调控miRNA的合成来参与各个生理过程。因此,苹果MdHYL1基因在干旱中的功能可能也是由某种miRNA介导的生理过程,这为进一步研究干旱过程中相关miRNA的变化提供了依据。
