大曲曲药中脲酶功能菌的选育与应用
2018-07-25徐占成徐姿静唐清兰刘孟华
徐占成,徐姿静,唐清兰,刘孟华
(四川剑南春集团有限责任公司,四川绵竹618200)
脲酶(Urease,urea amidohydrolase,EC 3.5.),又称尿素氨基水解酶,存在于大多数细菌、曲霉和高等植物中。它是一种酰胺酶、能使有机物质分子中酶键水解。其作用专一性仅能水解尿素,水解的最终产物是氨和碳酸。有部分微生物产生的酸性脲酶(acid urease)不同于植物中提取的中性、偏碱性脲酶,酸性脲酶能耐受酸性环境,在pH4.0~5.5的体系中仍具有活性[1]。
在国外,乳酸杆菌已经被用于生产脲酶制剂,有效减少了葡萄酒中尿素含量[2-6]。在国内,脲酶已经被用于降低黄酒中尿素含量。但是,酒用脲酶在我国尚未形成生产能力,目前所用的酶制剂均从国外进口[7]。例如,某公司购买日本生产的酒用酸性脲酶去除黄酒中的尿素,该酸性脲酶在绍兴黄酒中作用时间48 h左右,可有效除去黄酒中约80%的尿素[8]。
由于酒用酸性脲酶被作为食品添加剂直接添加到葡萄酒或者黄酒中,而报道的产脲酶菌株都是细菌,普遍从动物粪便(鸟粪、鼠粪、牛羊粪便)、农田土壤、污泥等中分离获得[9],并且需要一系列复杂的酶纯化提取工艺才能获得高纯度的酶制剂,从而极大地增加了生产成本,也增加了大规模生产的难度。
随着国内对酸性酒用脲酶的需求量不断增加,迫切需要解决酒用脲酶在国内生产能力不足的现状,因此酒用脲酶的研究对我国酿酒业的发展,拓展国际市场等方面均有深远的意义。
1 材料与方法
1.1 材料、试剂及仪器
曲样:剑南春中温大曲曲药。
分离平板培养基(g/L):蛋白胨10,葡萄糖18,氯化钠5,磷酸二氢钾2,琼脂20,尿素20,0.4%酚酞溶液3 mL,调pH7.0后分装于三角瓶,121℃灭菌20 min备用。
发酵培养基:麦芽汁,取大麦芽粉碎,加入4倍于麦芽质量的55~60℃的水,在55~60℃下保温3~4 h,过滤,煮沸,再次过滤,将麦芽汁浓度调整到5~70°Bx,分装200 mL/500 mL,115 ℃灭菌20 min备用。
仪器设备:紫外可见分光光度计cary50,美国瓦里安公司;酸度计Biorad C1000 PCR仪,美国Biorad公司;Wide mini sub电泳仪,美国Biorad公司;Biorad凝胶成像系统,美国Biorad公司;Biolog全自动微生物鉴定仪,美国Biolog公司;Thermo fisher高速冷冻离心机;美国Thermo fisher scientific公司;Minfors INFORS HT-5L发酵罐,瑞士INFORS公司;Biospec Minnibeadbeater细胞破碎仪。
1.2 试验方法
1.2.1 脲酶酶活性测定
将干燥的菌丝磨成粉状,参照邱业先等[10-11]的方法测定脲酶活性,取0.1 g菌丝,置于100 mL容量瓶中,加2 mL甲苯处理15 min,分别加入10%尿素10 mL和20 mL pH6.7柠檬酸盐缓冲液,混合均匀。将容量瓶置于37℃下培养24 h,用38℃蒸馏水稀释至刻度,振荡并过滤。取滤液0.5 mL,加入4 mL苯酚钠(1.35 mol/L)溶液,并加入3 mL次氯酸钠(0.9%)溶液,仔细混匀显色20 min,最后用蒸馏水定容至50 mL。用Varian Cary 50 BiO型分光光度计,在578 nm处测光吸收值。根据标准曲线求出氨态氮含量。零空白不加入样品,其他操作与样品实验相同。对每一样品设置用水代替基质的对照。
酶活性定义:30℃,pH7.0条件下,1 g酶制剂1 min分解尿素产生氨的毫克数表示酶的活性U。
1.2.2 产脲酶菌株的分离、纯化
无菌条件下取10 g酒曲于装有90 mL无菌水并放有玻珠的250 mL三角瓶中,置揺床上室温振荡30 min。取菌液按10倍的梯度稀释到10-6,取各稀释度菌液1 mL放入无菌平皿中,倒入灭菌后冷却至50℃的培养基,混匀,待凝固后放入30℃培养箱中培养2~5 d,按菌落周围是否变红进行初筛。
1.2.3 高产脲酶菌种的筛选
保存菌株接种到ME培养基上活化,30℃光照培养10 d,待其产孢子后,用无菌水洗下孢子,配制成浓度约为106个/mL的孢子悬液。然后将孢子悬液按照每瓶2 mL的接种量接种到脲酶发酵培养基中(200 mL/500 mL三角瓶)。在35℃条件下,180 r/min,发酵培养6 d。收集菌丝及液体,测定其脲酶活性。按其脲酶活力大小及菌株性能,筛选出高产脲酶的菌株。
1.2.4 菌种形态及生理生化鉴定
菌落形态观察,显微结构观察及生理生化指标的测定。
1.2.5 18S rDNA分子生物学法鉴定菌种
(1)DNA提取
收集菌体,溶于5 mL提取缓冲液(100 mM Tris·Cl,100 mM EDTA-2Na,200 mM NaCl,2%CTAB,pH8.0)中,37 ℃振荡45 min。加入0.75 mL 20%SDS,65 ℃水浴1 h。12000 r/min,离心10 min,收集上清液。上清液用等体积的酚∶氯仿∶异戊醇(25∶4∶1)抽提 2次,加入终浓度 0.3 M 的 NaAC(pH5.2)及2倍体积的无水乙醇,室温沉淀1 h。4 ℃,12000 r/min,离心20 min,收集沉淀,用70%乙醇漂洗2次,晾干后溶于50 μL TE(10 mm Tris-HCl,1 mm EDTA-2Na,)中,即得总DNA。
(2)扩增18S rDNA
以总DNA为模板,真菌通用引物18SF(SEQ ID No.2:CCAACCTGGTTGA TCCTGCCAGTA)和18SR(SEQ ID No.3:CCTTGTTACGACTTCACCTT CCTCT)分别为正向引物和反向引物扩增18S rDNA。扩增反应体系为 50 μL:10×Buffer 5 μL,dNTP 1 μL,Taq 酶 0.5 μL(2 U),正反向引物各1 μL,模板DNA 1 μL,ddH2O 40.5 μL。扩增反应条件:94 ℃、4 min预变性;94℃、0.5 min,55 ℃、1 min,72℃、0.5 min,30个循环;72℃延伸7 min。
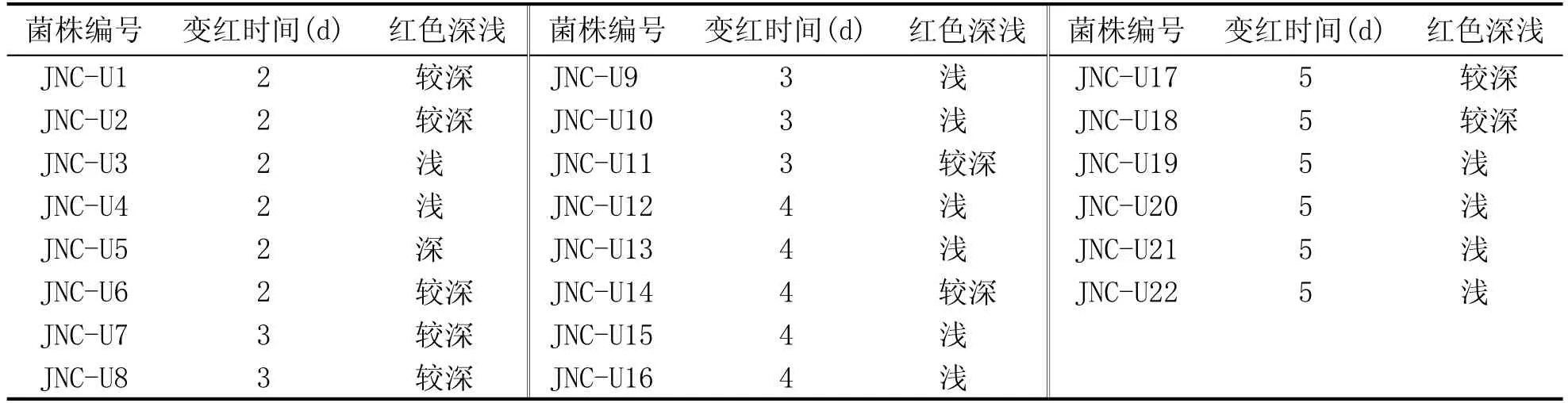
表1 初筛得到菌株的变红时间及颜色深浅
(3)18S rDNA序列分析
将扩增的18S rDNA片段送上海生工测序,通过美国国家生物技术信息中心的BLAST搜索程序进行比较,获得同源性比对分析结果。
1.2.6 脲酶制剂的制备
利用发酵罐生产脲酶制剂,选用发酵培养基对脲酶菌株进行发酵,发酵6 d后,收集菌丝体,用无菌水多次洗涤,然后低温冷冻干燥,4℃冷藏保存备用。干燥后的菌丝采用细胞破碎仪破碎与粉碎机粉碎后,测定脲酶活性,试验重复3次。
1.2.7 脲酶制剂在酿酒过程中的应用
(1)不同pH值对脲酶活性的影响
酿酒发酵过程中的pH值一般维持在3.5~4.5之间,因此研究pH值对其酶活性的影响对进一步的应用研究有指导意义。用乳酸和乳酸钠缓冲液调整不同pH值,用不同pH值乳酸和乳酸钠缓冲液代替柠檬酸缓冲液,测定脲酶制剂在不同pH值条件下的脲酶活性。
(2)脲酶制剂在酿酒中的应用
为了进一步研究酸性脲酶在酿酒中的应用,本研究购买市售黄酒实施了尿素去除率实验。将制成的脲酶制剂按照一定量加入上述酒样中,置于25℃条件下反应,每隔24 h测定尿素的含量[12]。
将JNC-U5菌株应用于中温大曲曲药生产,提高大曲的脲酶活性。将大曲应用于酿酒生产,去除生成EC的底物,确保白酒的食品安全性。
2 结果与分析
2.1 高产脲酶菌株的筛选
因为脲酶分解尿素产生氨使培养基呈碱性;酚酞遇碱变红,颜色的深浅初步表示了菌株产脲酶能力的大小,初筛结果见表1。
挑选菌落周围变红的22株单菌落保存,初筛得到的菌株经形态观察发现主要为霉菌和细菌。
将初筛的菌株进行复筛和遗传稳定性研究。经过多次转接后发现,绝大多数菌株产脲酶的能力逐渐丧失,结果见图1。经过多代筛选,最终选出1株产脲酶能力稳定的菌株JNC-U5,其产脲酶活力可达49.7 U/g,根据形态初步鉴定为霉菌。
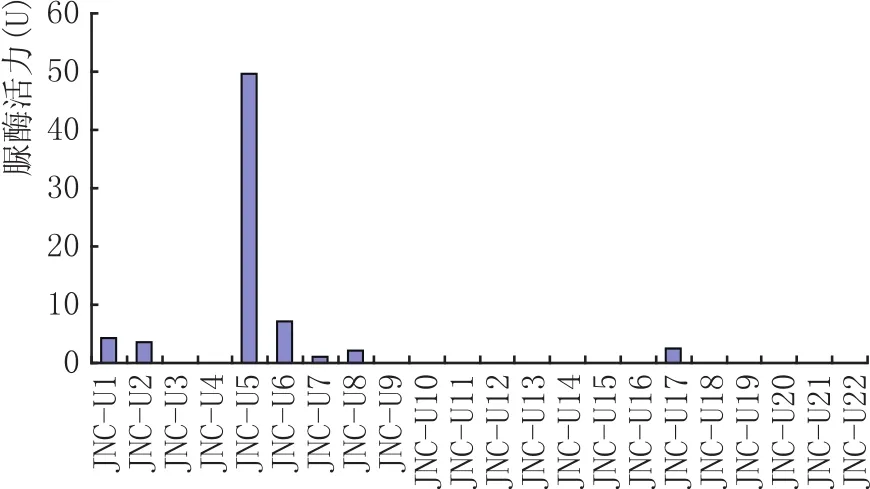
图1 22株菌株的脲酶活性
2.2 形态及生理生化鉴定结果
将4℃保存的菌株用ME斜面培养基活化3 d,然后用接种针挑取斜面的菌落接种到ME平板培养基上,以28℃培养7 d,观察菌落形态,于显微镜下观察分生孢子及分生孢子梗的形态,用扫描电镜Quanta TM450FEG观察菌体的超微结构(图2)。
该曲霉菌落在ME培养基上呈辐射生长,有辐射形沟纹,28℃培养7 d,直径22~30 mm;颜色呈灰绿色,周围有白色的晕圈;菌落反面呈淡褐或暗褐色。分生孢子梗直接生于基质或生于气生菌丝,分生孢子为球形或近球形,孢子表面粗糙,有小刺;小分生孢子头呈疏松柱形或散乱。

图2 菌落形态及菌体超微结构
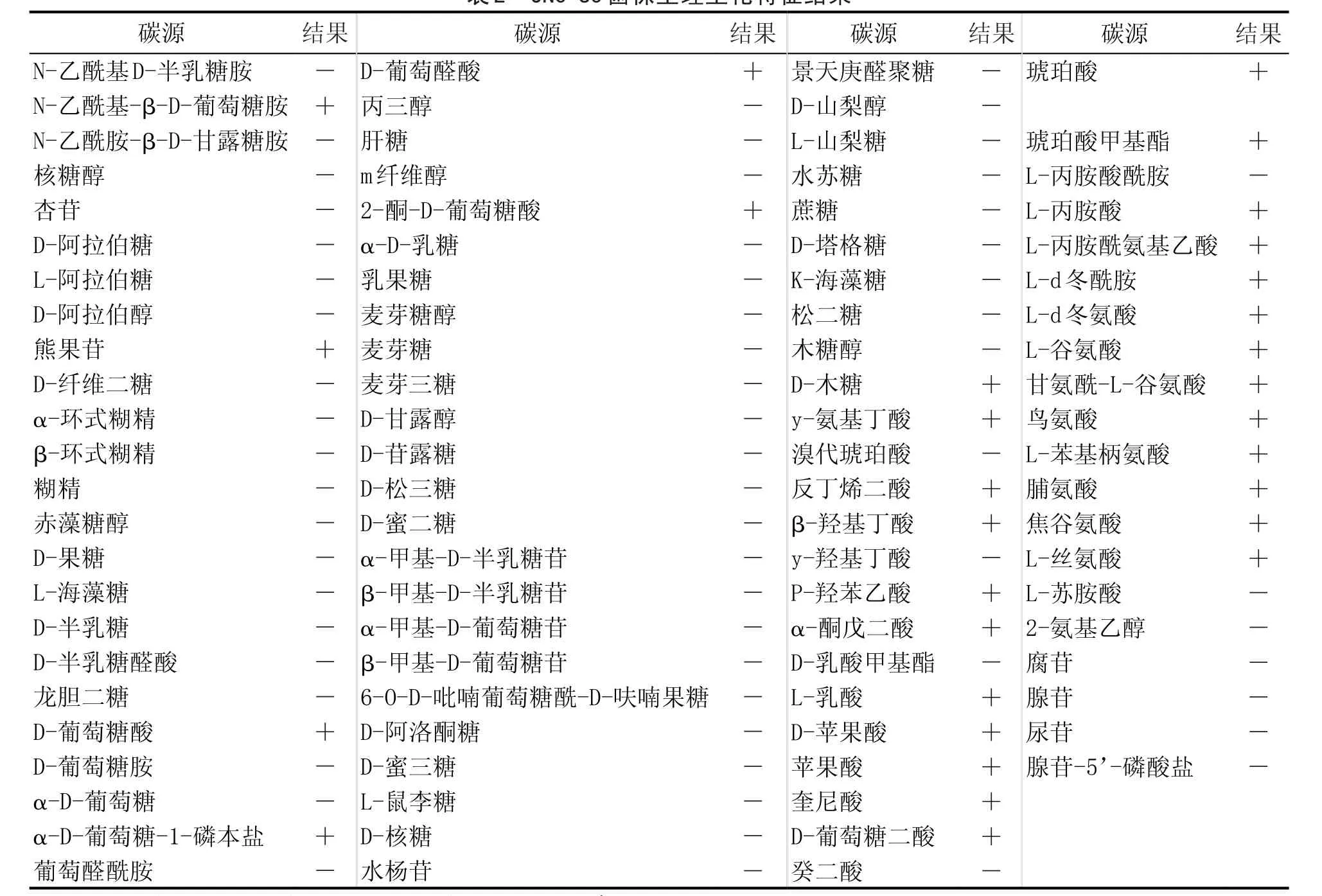
表2 JNC-U5菌株生理生化特征结果
生理生化鉴定采用Biolog微生物鉴定仪进行鉴定。将曲霉的孢子悬液接种到微生物鉴定板中,该鉴定板中含有各种碳、氮源及微量成分,以鉴定板的第一个小孔作为空白对照。在28℃条件下,培养48 h,然后用Biolog微生物鉴定仪,750 nm处测吸光值,得出的生理生化鉴定结果见表2。
生理生化鉴定结果与Biolog系统数据库比对,结果显示,筛选得到的产脲酶菌株JNC-U5为聚多曲霉。同时形态特征也与聚多曲霉形态特征相符。
2.3 18S rDNA分子生物学鉴定结果
以真菌18SF、18SR作为引物扩增,PCR产物经1.5%琼脂糖凝胶鉴定,在1800~1900 bp之间,目的条带清晰(图3),引物特异性强,与预期结果一致。将PCR产物送上海生工测序,测序结果通过美国国家生物技术信息中心的BLAST搜索程序进行比较获得同源性分析结果(见表3)。
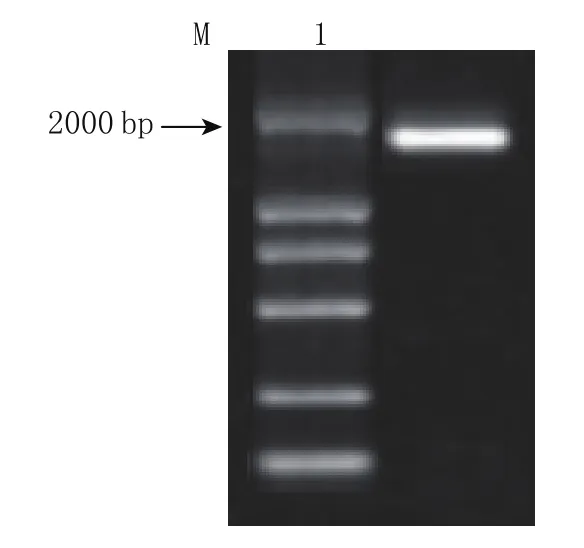
图3 JNC-U5 18S rDNA扩增产物电泳图
同源性分析结果表明,JNC-U5 18S rDNA基因序列与数据库中聚多曲霉(Aspergillus sydowii)基因序列覆盖度达99%,同源性达99%,因此认定JNC-U5菌株为聚多曲霉。
2.4 脲酶制剂的制备
JNC-U5脲酶产生菌株经过发酵培养基筛选、发酵条件的优化后,经5 L发酵罐发酵收集菌丝。菌丝低温冷冻干燥后采用细胞破碎仪破碎与粉碎机粉碎,其脲酶活性结果见表3。
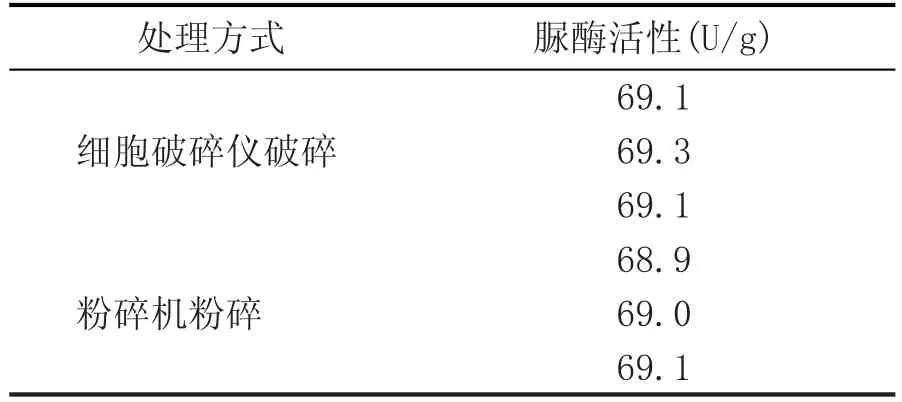
表3 不同制备方法脲酶活性
两种不同的处理方式酶活基本相同(表3),但采用粉碎机粉碎操作简单,所以该脲酶制剂的制备选用粉碎机直接粉碎即可用于生产,极大地降低了生产成本,更适宜工业化大生产。该脲酶制备方法已获得国家发明专利,专利号:ZL201210531870.2。
2.5 脲酶制剂在酿酒过程中的应用
2.5.1 不同pH值对脲酶活性的影响
酿酒发酵过程中的pH值一般维持在3.5~4.5之间,因此本文研究了pH值对脲酶活性的影响,结果见图4。
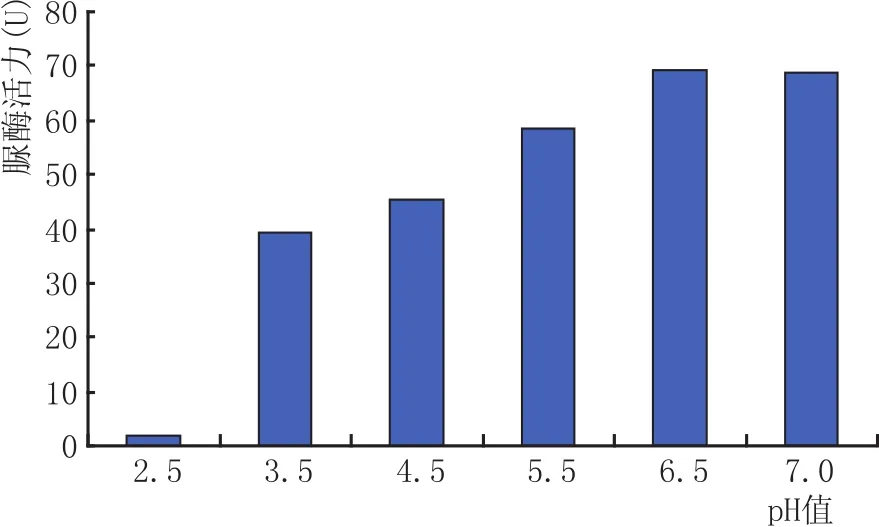
图4 不同pH值对脲酶活性的影响
从图4可以看出,尽管随着pH值的降低,该酶的活性受到一定的抑制,但是在pH3.5~4.5之间时仍然保持较高的活性。即说明JNC-U5菌株制备的脲酶制剂可用于酿酒生产。
2.5.2 脲酶制剂在酿酒中的应用
将脲酶制剂按照一定量加入市售黄酒样中,置于25℃条件下反应,每隔24 h测定尿素的含量。测定结果(图5)表明,添加脲酶制剂后24 h,尿素去除率可以达到78.5%,此后尿素去除率变化不大,48 h后尿素去除率超过80%。
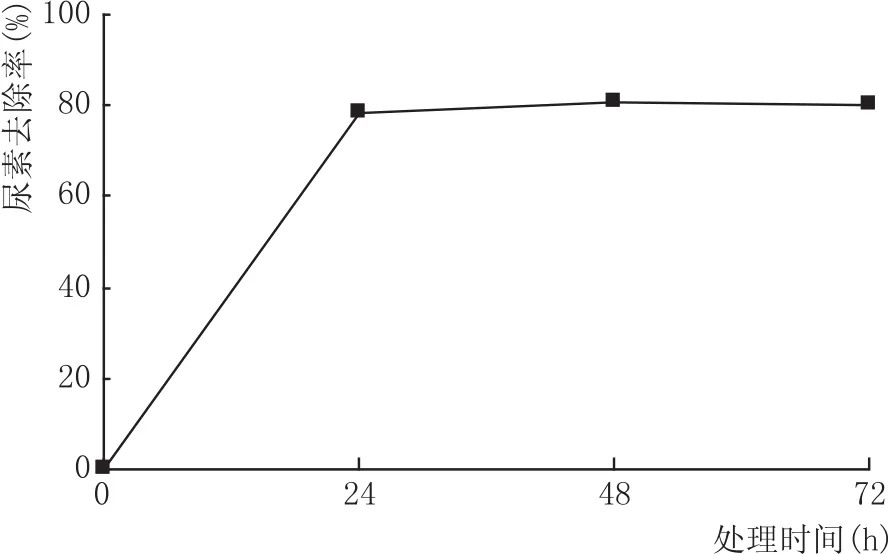
图5 尿素去除率
将JNC-U5菌株应用于中温大曲的生产,大曲各项理化性能结果如表4,糖化力提高了11.5%,液化力提高了9.7%,脲酶活力得到显著提高,提高了141%。该曲药应用于酿酒生产,能有效去除生成EC的底物,大幅降低EC含量,确保了白酒食品安全性。

表4 大曲理化性能结果
3 讨论
本研究筛选到1株产脲酶性能稳定的菌株JNC-U5,该菌经形态、生理生化及分子生物学鉴定定性为聚多曲霉。该菌产脲酶活性为69.3 U/g,为脲酶的生产提供了宝贵的菌株资源。该菌种所产酶制剂在pH3.5~4.5环境下仍保持较高活性,在复杂的黄酒体系中仍能保持活性,24 h尿素去除率高达78.5%,48 h尿素去除率超过80%,说明其在酒类尤其是黄酒酿造中具有极大的应用价值。
产脲酶菌株JNC-U5应用于中温大曲的生产,大曲糖化力提高了11.5%,液化力提高了9.7%,脲酶活力提高了141%。该大曲应用于酿酒生产,能有效去除生成EC的底物,大幅降低EC含量,确保了白酒的食品安全性。同时,JNC-U5菌株的筛选成功也为生产酒用脲酶制剂提供了新的选择,具有极大的应用和推广价值。
