不同氮源对一株溶藻弧菌好氧反硝化效率的影响
2018-07-24刘兴薄香兰陈继楚李连星朱会杰王军周文礼陈成勋
刘兴,薄香兰,陈继楚,李连星,朱会杰,王军,周文礼,陈成勋
(1.天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384;2.天津立达海水资源开发有限公司,天津 300280)
生物脱氮是去除养殖水体中氮污染的有效方法之一,具有经济高效的特点且不会对养殖水体造成二次污染[1]。通常认为,生物脱氮包括好氧硝化和厌氧反硝化两个过程,反硝化只有在厌氧条件下才会发生,20世纪80年代,随着副球菌属Paracoccus的首次发现[2],国内外学者对好氧反硝化细菌研究报道逐渐增多,主要包括假单胞菌属Pseudomonas[3]、产碱菌属Alcaligenes[4]、芽孢杆菌属Bacillus[5]等。在水产养殖方面,通常为保证养殖动物健康生长,养殖水体必须保证在高溶氧状态下,而厌氧反硝化脱氮效率就会因此严重降低,故研究好氧反硝化细菌势在必行[6]。
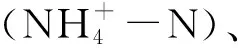
1 材料与方法
1.1 材料
1.1.1 试验菌株 试验菌株筛选自天津市某水产公司海水工厂化循环水养殖池。
1.1.2 培养基 维氏盐溶液:将5.0 g K2HPO4、2.5 g MgSO4·7H2O、0.05 g FeSO4·7H2O、0.05 g MnSO4·4H2O依次溶于1 L盐度为15的海水中。
铵态氮源培养基:将0.5 g NH4Cl、5.66 g 柠檬酸钠、50 mL 维氏盐溶液依次溶于1 L蒸馏水中,调节pH至7。培养基经过121 ℃灭菌20 min,下同。
硝态氮源培养基:将0.8 g NaNO3、5.66 g 柠檬酸钠、50 mL 维氏盐溶液依次溶于1 L蒸馏水中,调节pH至7。
亚硝态氮源培养基:将0.65 g NaNO2、5.66 g 柠檬酸钠、50 mL 维氏盐溶液依次溶于1 L蒸馏水中,调节pH至7。
对照组为生理盐水,调节pH至7.0。
1.1.3 试验仪器 麦氏浓度仪(DENSICHEK,IDK215957);紫外分光光度计(UVmini-1240)、一氧化氮检测仪(深圳市普利通电子科技有限公司,PLT-BX-NO);一氧化二氮检测仪(深圳市普利通电子科技有限公司,PLT-BX-N2O);氮气检测仪(深圳市普利通电子科技有限公司,PLT-BX-N2);pH计(SevenEasy Plus-S20P)。
1.2 方法
在容积为10 L的发酵罐中进行试验(图1),试验前将所有装置在121 ℃下灭菌处理20 min, 将7 L不同氮源的硝化培养基分别加入不同发酵罐中,各记为A(铵态氮源培养基)、B(硝态氮源培养基)、C(亚硝态氮源培养基)组,每组设3个重复,各试验组接种10 mL浓度为2.93麦氏浓度的溶藻弧菌HA2,试验温度为(26.03±1.16)℃,连续发酵120 h,在发酵的第0、12、18、36、39、42、45、48、51、54、57、60、63、66、69、72、84、96、108、120 h 取样。发酵液每次取10 mL,分别以5000 r/min离心10 min,测定上清液中铵态氮、硝态氮、亚硝态氮的浓度,检测发酵罐中N2、NO、N2O气体的含量,直到仪器显示浓度达到稳定值为止。

图1 试验装置Fig.1 A diagram of the apparatus used in the experiment
本试验中,分别采用纳氏试剂分光光度法、锌-镉还原分光光度法、重氮-偶氮光度法、麦氏浓度仪,检测铵态氮、硝态氮、亚硝态氮、菌液浓度;通过深圳市普利通电子科技有限公司的电子仪器检测N2、NO、N2O气体的含量。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。用SPSS 19.0软件进行非线性回归分析,根据细菌生长浓度、时间计算出3种培养基条件下非线性参数,再根据拟合曲线参数值、估计值、拟合度(R2)选出最优生长模型,模型表达式为指数函数y=k/[1+exp(a-b×t)],其中a为参数,b为瞬时生长率,k为生长极限值,t为自变量时间(h)。
2 结果与分析
2.1 溶藻弧菌HA2在3种培养基中的生长状况
根据各时期不同培养基中溶藻弧菌HA2测定的麦氏浓度数据,用Logistic非线性模型对溶藻弧菌HA2的生长曲线进行拟合。在铵态氮源培养基中,HA2的生长曲线通过多次调整拟合(图2),确定最高拟合度R2为0.791,拟合程度一般,生长极限k值为4.769,实际平均值比拟合值稍早到达生长极限k,试验第66 h时达到k值;在硝态氮源培养基中,HA2的生长曲线拟合见图3,拟合度R2为0.917,拟合曲线与实际平均值基本上吻合,生长极限k值为5.477,在试验第84 h 时达到k值;在亚硝态氮源培养基中,HA2的生长曲线拟合见图4,拟合度R2为0.977,拟合程度较高,拟合曲线与实际平均值基本吻合,生长极限k值为5.567,试验第108 h 时达到k值。 在铵态氮、硝态氮、亚硝态氮3种氮源培养基中溶藻弧菌HA2的生长拟合曲线均呈“S”型,经拟合曲线结果可得瞬时生长速率参数b依次减小(0.910、0.891、0.887),拟合度R2依次增加,HA2菌生长极限k值依次升高。

图2 溶藻弧菌HA2在铵态氮源培养基中的生长拟合曲线Fig.2 Growth curve of Vibrio alginolyticus HA2 in the ammonium nitrogen culture media
2.2 溶藻弧菌HA2在不同氮源培养基中对代谢的影响

图3 溶藻弧菌HA2在硝态氮源培养基中的生长拟合曲线Fig.3 Growth curve of Vibrio alginolyticus HA2 in nitrate nitrogen culture media

图4 溶藻弧菌HA2在亚硝态氮源培养基中的生长拟合曲线Fig.4 Growth curve of Vibrio alginolyticus HA2 in nitrite nitrogen culture media

图5 铵态氮源培养基中铵态氮、硝酸态氮、亚硝酸态氮含量变化Fig.5 Changes in concentrations of ammonia nitrogen, nitrate nitrogen and nitrite nitrogen in ammonium nitrogen culture media

图6 硝态氮源培养基中铵态氮、硝态氮、亚硝态氮含量的变化Fig.6 Changes in concentrations of ammonia nitrogen, nitrate nitrogen and nitrite nitrogen in nitrate nitrogen culture media

注:该次测定缺少硝态氮数据。硝态氮测定原理是通过硝态氮硝解还原为亚硝态氮,再进行亚硝态测定Note:The nitrate nitrogen data are absent because the reduction rate can not be accurately measured. The determination of nitrate nitrogen levle is based on nitrate-N reduction to nitrite nitrogen and then nitrite determination图7 亚硝态氮源培养基中铵态氮、亚硝态氮含量变化Fig.7 Changes in concentrations of ammonia nitrogen and nitrate nitrogen in nitrite nitrogen culture media
2.3 不同氮源培养基中代谢气体的含量
本试验中利用3种不同氮源培养基培养溶藻弧菌HA2,试验过程中均未检测出NO、N2O (仪器测定范围0~50 mg/L,分辨率为0.5 mg/L)。在不同培养基中N2的代谢状况见图8,各组N2量与对照组相比均有增加趋势。铵态氮组0~18 h时,N2量缓慢增加,51 h 时达到最高(80.38%),在第60 h时又有降低趋势,N2量最低为79.37%,最高达到80.39%;第51 h时硝态氮培养基中N2量达到最高(80.45%);第51 h时亚硝态氮培养基中N2量达到最高(80.53%)。从N2量趋势图可看出,3种氮源培养基同时在51 h时上升到最高点, N2量在铵态氮培养基中上升最早,在亚硝态氮培养基中上升最晚,但在亚硝态氮培养基上升速率最快。

图8 在不同培养基中溶藻弧菌HA2产生的N2量Fig.8 N2 levels produced by Vibrio alginolyticus HA2 in different culture media
2.4 不同氮源培养基中pH的变化
溶藻弧菌HA2在不同氮源培养基中pH变化如图9所示,各组培养基pH均呈增加趋势,在加入培养基的第24 h时,pH值开始上升,铵态氮组上升速率最快,硝态氮、亚硝态氮组上升速率趋于一致。培养开始时,铵态氮、硝态氮和亚硝态氮组pH值分别为7.88、8.45和8.54,到培养结束时,各组的pH分别为9.46、9.54和9.51。

图9 溶藻弧菌HA2在各培养基中pH的变化Fig.9 Changes in pH of Vibrio alginolyticus HA2 in the culture media
3 讨论
3.1 溶藻弧菌HA2在不同氮源培养基中的生长
本研究中对溶藻弧菌HA2菌株在3种氮源培养基中的生长进行Logistic模型曲线拟合,拟合曲线均呈“S”型,拟合曲线与实际平均值基本吻合。
同步硝化反硝化细菌在不同氮源培养基中生长状况有较大差异,梁贤[8]研究发现,异氧硝化细菌YL分别在以唯一氮源为亚硝态氮和硝态氮的培养基中生长状况均较好。潘玉瑾等[9]研究发现,好氧反硝化细菌ZPQ2分别在以KNO3、(NH4)2SO4为唯一氮源培养基中生长较好。本试验中分别以铵态氮(NH4Cl)、硝态氮(NaNO3)、亚硝态氮(NaNO2)为唯一氮源培养溶藻弧菌HA2,并拟合该菌株生长曲线,结果显示,溶藻弧菌HA2在铵态氮、硝态氮、亚硝态3种氮源培养基中达到生长极限k值分别需要66、84、108 h,拟合曲线瞬时生长速率参数b分别为0.910、0.891、0.887,由此可知,该菌株在3种氮源培养基中生长速率从快到慢分别为铵态氮、硝态氮、亚硝态氮。Logistic拟合模型本质是反映生物遗传生长潜力,不受环境、食物等因素影响,只与生物品种有关[10]。事实上,溶藻弧菌HA2生长过程中会受到氮源等因素的影响,从而影响拟合曲线的拟合度,拟合度大小反映氮源对该菌株生长影响程度,生长极限k值是细菌在该环境中所能达到的极限值,k值受不同种类氮源影响。本试验中,溶藻弧菌HA2在铵态氮、硝态氮、亚硝态氮3种不同氮源培养基中的生长曲线拟合度R2分别为0.791、0.917、0.977,生长极限k值分别为4.769、5.477、5.567,因此,该菌株受3种培养基的影响程度依次为亚硝态氮<硝态氮<铵态氮。本试验结果表明,溶藻弧菌HA2在这3种氮源培养基中均可以生长,这与杨浩锋等[11]、王弘宇等[12]、Ellington等[13]的研究结果一致。
3.2 溶藻弧菌HA2在不同氮源培养基中对代谢的影响


(ΔG°′=-274.7 kJ/mol),
(1)
(2)
(ΔG°′=-348.9 kJ/mol)。
(3)

3.3 溶藻弧菌HA2在不同氮源培养基中的代谢气体分析

3.4 溶藻弧菌HA2在不同氮源培养基中对pH的影响

4 结论
致谢:感谢天津立达海水资源开发有限公司为本试验提供帮助!
