饲料中添加木聚糖酶对刺参幼参生长、消化和体腔液酶活力的影响
2018-07-24武明欣王雅平李培玉张利民李宝山孙永智魏佳丽王际英
武明欣,王雅平,李培玉,张利民,李宝山,孙永智,魏佳丽,王际英
(1.山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室,山东 烟台 264006;2.上海海洋大学 水产科学国家级实验教学示范中心,上海 201306;3.上海海洋大学 上海水产养殖工程技术研究中心,上海 201306;4.上海海洋大学 农业部鱼类营养与环境生态研究中心,上海 201306)
刺参Apostichopusjaponicus隶属于刺参科、仿刺参属、刺参种,是中国名贵海珍品之一,也是目前中国单养价值最高的品种。近年来,随着刺参产业的发展,抗生素的使用成为影响其品质的关键因素之一。抗生素容易导致水产动物抗药性和药物残留,给水环境和人类健康带来了重大威胁,因此,其在水产养殖中逐渐被禁止和替代[1]。饲料中添加酶制剂作为一种安全、无毒害作用的蛋白质,可有效缓解因禁止抗生素使用而造成的肠道环境中有害细菌的增值,提高养殖动物的生长性能和饲料中营养物质的利用率,并在集约化养殖中对环境保护做出贡献,因而得到了许多研究者的关注。
木聚糖是自然界中除纤维素外多糖含量最高的物质,在植物性饲料原料中含量也较高[2-3]。木聚糖具有抗营养作用,一般水产动物较难将其直接消化利用。木聚糖也具有较强的结合水的能力,从而增大动物肠道内的食糜黏度,阻碍对营养物质特别是蛋白质、脂肪的吸收和利用[3],并能与肠道蛋白酶和脂肪酶络合,降低内源酶活性[4]。木聚糖酶是催化木聚糖水解的一类酶的统称,根据功能不同分为β-1,4-D-内切木聚糖酶、β-1,4-D-外切木聚糖酶和β-木糖苷酶三类[5]。三类酶协同作用把大分子木聚糖分解为木二糖、木三糖等低聚糖和少量阿拉伯糖[6-7],有利于动物的吸收利用。
在水产动物饲料中添加木聚糖酶能有效消除木聚糖的抗营养作用,同时破坏细胞壁,使养分充分出,降低肠道食糜黏度[8-9],增加饲料中营养成分与酶的反应面积,提高对营养物质的消化吸收,从而改善养殖动物的生产性能。目前,在水产饲料中对木聚糖酶的研究主要集中在鲫[10]、黄河鲤[11-12]、尼罗罗非鱼[13-14]、条石鲷[15]和南美白对虾[16]等少数品种,对其在刺参饲料中的研究较少。本试验中,在基础饲料中添加6个水平的木聚糖酶,研究了其对刺参生长、体成分、免疫和消化酶的影响,以期为确定其在刺参配合饲料中的最佳添加量提供依据。
1 材料与方法
1.1 材料
试验用木聚糖酶由武汉新华扬酶制剂有限公司提供,内附有酶活力检测报告,活力为10 000 U/g。试验用刺参幼参采自黄河三角洲新型农民培训学校试验基地,为该基地当年繁育的同一批参苗。
1.2 方法
1.2.1 试验饲料的制备 以鱼粉、豆粕、藻粉为主要蛋白源,设计粗蛋白质约为24%、粗脂肪约为1.5%的基础饲料配方,分别以0、0.03%、0.06%、0.09%、0.12%和0.24%木聚糖酶替代基础饲料中的α-淀粉,制成6组等氮等能的试验饲料(记为D0、D1、D2、D3、D4、D5组,D0为对照组)。饲料配方及营养组成见表1、表2。将固体原料超微粉碎后过200目筛,按配比称重,加入新鲜鱼油及适量蒸馏水混匀,用小型颗粒饲料挤压机制成直径为0.3 cm的颗粒,60 ℃下烘干,用小型粉碎机破碎,筛选粒度为80~100目的颗粒备用。

表1 试验饲料配方及成分分析(干质量)Tab.1 Ingredients of the experimental diets (dry matter) w/%
注: 1) 脱胶海带粉与马尾藻粉等量混合,粗蛋白质含量为16.7%;2) 经高温煅烧处理;3) 每千克维生素预混料含VA 38.0 mg,VB121.3 mg,VD313.2 mg,核黄素380.0 mg,硫胺素115.0 mg,α-生育酚210.0 mg,烟酸1030.0 mg,泛酸368.0 mg,生物素10.0 mg,叶酸20.0 mg,抗坏血酸500.0 mg,盐酸吡哆醇88.0 mg,肌醇4000.0 mg;4) 每千克矿物质预混料含KCl 3020.5 mg,KAl(SO4)211.3 mg,NaCl 100.0 mg,KI 7.5 mg,NaF 4.0 mg,ZnSO4·7H2O 363.0 mg,CuSO4·5H2O 8.0 mg,MgSO4·7H2O 3568 mg,MnSO4·4H2O 65.1 mg,Na2SeO32.3 mg, NaH2PO4·2H2O 25 558.0 mg,CoCl228.0 mg,C6H5O7Fe·5H2O 1523.0 mg,乳酸钙15 978.0 mg
Note: 1) Degummed kelp mixed withSargassumpowder at ratio of egual amount, containing 16.7% of crude protein;2) calcining at high temperature;3)one kilogram of mineral premix contains VA 38.0 mg,VB121.3 mg,VD313.2 mg,riboflavin 380.0 mg,thiamine 115.0 mg,α-tocopherol 210.0 mg, nicotinic acid 1030.0 mg,pantothenic acid 368.0 mg,biotin 10.0 mg,folic acid 20.0 mg,ascorbic acid 500.0 mg,pyridoxine hydrochloride 88.0 mg,and inositol 4 000.0 mg;4)one kilogram of mineral premix contains KCl 3020.5 mg,KAl(SO4)211.3 mg,NaCl 100.0 mg,KI 7.5 mg,NaF 4.0 mg,ZnSO4·7H2O 363.0 mg,CuSO4·5H2O 8.0 mg,MgSO4·7H2O 3568 mg,MnSO4·4H2O 65.1 mg,Na2SeO32.3 mg,NaH2PO4·2H2O 25 558.0 mg,CoCl228.0 mg,C6H5O7Fe·5H2O 1523.0 mg,and Ca-lactate 15 978.0 mg
表2试验饲料营养成分(干质量)

Tab.2 Proximate composition of the experimental diets (dry matter)w/%
1.2.2 试验设计及饲养管理 饲养试验在黄河三角洲新型农民培训学校试验基地循环水养殖系统中进行,试验开始前,将1000头刺参幼参放养于养殖系统中,暂养15 d,期间投喂基础饲料,待其完全适应饲养条件后,选择体格健壮、体质量为(7.73±0.09)g的刺参900头,随机放养于室内海水循环系统的18个圆柱形玻璃钢桶高(70 cm,直径80 cm)中,控制水深60 cm。用每种饲料随机投喂3个养殖桶的幼参。养殖车间利用遮阳布保持无光状态,每天8:00、16:30投喂,日投喂量根据试验幼参摄食情况及时调整。控制水温为(19±1)℃,pH为7.8~8.2,盐度为24~26,亚硝酸氮、氨氮均不高于0.05 mg/L。养殖试验持续56 d,每隔两天换水一次,换水量为1/3,换水时用虹吸法将残饵及粪便吸出。
1.2.3 样品收集 试验结束后,将幼参饥饿48 h,记录每桶幼参总数及总质量,用于存活率、增重率及特定生长率的计算。从每桶取10头刺参,用滤纸轻轻吸干体表水分,称体质量,待其自然舒展后用刻度尺测量体长。用2 mL 无菌注射器抽取体腔液后,置冰盘上解剖,分离体壁与肠道。将体腔液在4 ℃下以3000 r/min离心15 min后,取上清液分装于 2 mL 的离心管中。样品均保存于冰箱(-80 ℃)中,待测。
1.2.4 指标的测定与计算
(1)生长指标。
存活率(SR)=终末刺参数/初始刺参数×100%,
增重率(WGR)=(终末刺参总质量-初始刺参总质量)/初始刺参总质量×100%,
特定生长率(SGR)=(ln终末刺参质量-ln初始刺参质量)/饲养时间×100%,
肥满度(CF)= 体质量/体长3×100%,
肠长比(RIL)=肠长/体长×100%。
(2)饲料及幼参体壁营养成分。饲料及幼参体壁营养成分含量采用常规方法测定:干物质是指将被测物在105 ℃下烘干至恒重 (GB/T6435—2006);采用FOSS半自动凯氏定氮法(KjeltecTM2100)、索氏抽提法(GB/T643—1994)、550 ℃马福炉灼烧法(GB/T6438—2007)和燃烧法(PARR,6100)分别测定粗蛋白质、粗脂肪、粗灰分含量和能量。
(3)消化酶活力。将刺参肠道解冻后用4 ℃生理盐水小心冲洗,用滤纸吸干表面水分,按需要称取肠道质量,加入9倍生理盐水于冰水浴下匀浆,将组织悬液低温下以7000 r/min离心30 min,取上清液即粗酶液,分装后置于冰箱(4 ℃)中待测。采用福林-酚法、碘-淀粉比色法、滴定法和考马斯亮蓝染色法分别测定刺参蛋白酶、淀粉酶、脂肪酶活性和酶液总蛋白含量。以上指标均采用南京建成生物工程研究所的试剂盒进行测定。
(4)体腔液酶活性。溶菌酶(LZM)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)均采用南京建成生物工程研究所的试剂盒进行测定,相关酶活定义参见其说明书。谷丙转氨酶和谷草转氨酶活性采用全自动生化分析仪测定。
1.3 数据统计
试验数据用Excel 2007软件进行统计处理,并以平均值±标准偏差(mean±S.D.)表示。采用SPSS 11.0软件进行单因素方差分析(One-Way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同木聚糖酶水平下幼参生长性能的变化
从表3可见:饲料中添加木聚糖酶能显著提高刺参的增重率和特定生长率(P<0.05),并随着木聚糖酶添加量的增加呈现先升高后降低的趋势;木聚糖酶添加组的增重率和特定生长率与对照组相比均显著提高(P<0.05),其中0.09%木聚糖酶组增重率和特定生长率最高且显著高于其他各组(P<0.05);饲料添加木聚糖酶对刺参存活率无显著性影响(P>0.05)。
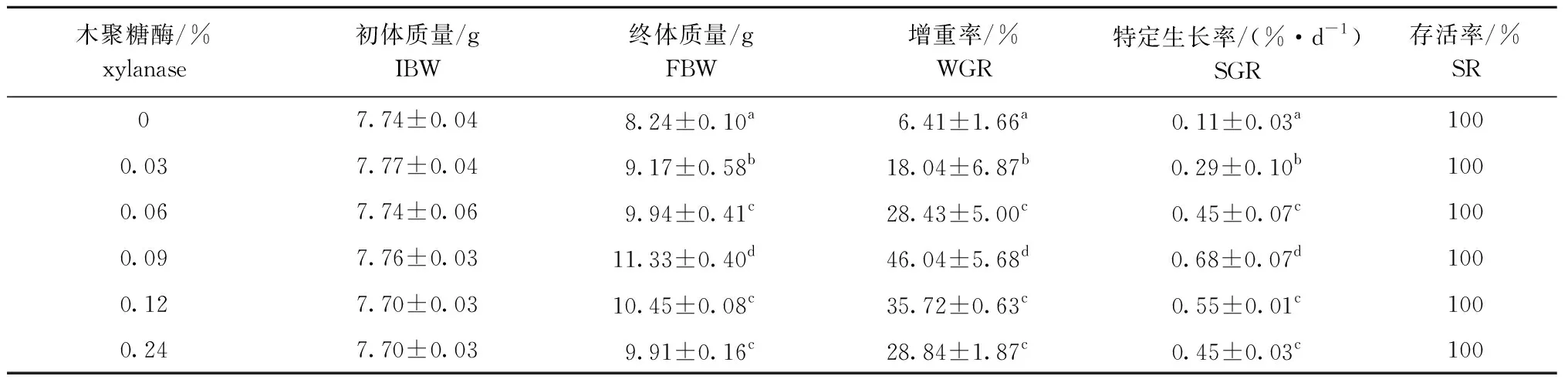
表3 不同木聚糖酶水平对幼参生长性能的影响
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
从图1可见,以饲料中木聚糖酶水平为自变量(X)、增重率为因变量(Y)的回归分析得出:
Y=42.641+0.041(X-900)+0.01(900-X)。
当X<900 mg/kg时,0.01(900-X)=0,此时R2=0.98;当X>900 mg/kg时,0.041(X-900)=0,此时R2=0.94;当X=900 mg/kg时,刺参获得最大增重率。因此,在本试验条件下,以增重率为评价指标,初始体质量为(7.73±0.09)g的刺参饲料中木聚糖酶最适添加量为900 mg/kg。

图1 饲料中木聚糖酶水平与幼参增重率的回归分析Fig.1 Regression analysis of dietary xylanase levels and weight gain rate of sea cucumber Apostichopus japonicus
2.2 不同木聚糖酶水平下幼参体壁基本成分的变化
从表4可见:饲料中添加木聚糖酶后不同程度地提高了刺参体壁粗蛋白质和粗脂肪含量,随着木聚糖酶添加水平的升高,刺参体壁粗蛋白质和粗脂肪含量均呈先升高后降低的趋势;各添加组粗蛋白质含量均显著高于对照组(P<0.05),但各添加组间无显著性差异(P>0.05);0.06%~0.24%木聚糖酶添加组粗脂肪含量均显著高于对照组(P<0.05),且以0.09%和0.12%添加组影响最为明显。
表4木聚糖酶水平对幼参体壁基本营养成分的影响

Tab.4 Effects of xylanase levels on approximate composition of body wall of sea cucumber Apostichopus japonicusw/%
2.3 不同木聚糖酶水平下幼参消化酶活力的变化
从表5可见:饲料中添加木聚糖酶能明显提高刺参肠道消化酶活力,随着木聚糖酶添加水平的提高,蛋白酶和脂肪酶活力呈现先升高后降低的趋势;0.06%、0.09%、0.12%木聚糖酶添加组刺参蛋白酶和脂肪酶活力均显著高于对照组和0.24%添加组(P<0.05),0.24%添加组淀粉酶活力显著高于对照组和其他木聚糖酶添加组(P<0.05)。
表5木聚糖酶水平对幼参肠道消化酶的影响

Tab.5 Effects of xylanase levels on digestive enzyme activity of sea cucumber Apostichopus japonicusU/mg prot
2.4 不同木聚糖酶水平下幼参体腔液酶活的变化
从表6可见:饲料中添加木聚糖酶能明显提高刺参体腔液酶活性,随着木聚糖酶添加水平的升高,体腔液中溶菌酶、过氧化氢酶、谷草转氨酶和谷丙转氨酶活性均呈现先升高后下降的趋势;各添加组(0.03%组除外)溶菌酶活性显著高于对照组(P<0.05);0.06%~0.12%添加组过氧化氢酶活性显著高于对照组(P<0.05);0.03%~0.12%添加组谷草转氨酶活性显著高于对照组(P<0.05);0.06%~0.24%添加组谷丙转氨酶活性显著高于对照组(P0.05);木聚糖酶添加组与对照组相比,超氧化物歧化酶活性有所增加,但无显著性差异(P>0.05)。
3 讨论
3.1 饲料中添加木聚糖酶对幼参生长性能的影响
本试验结果表明,添加木聚糖酶能显著提高刺参的增重率和特定生长率,并随着木聚糖酶添加水平的提高,刺参增重率和特定生长率呈现先升高后下降的趋势,且0.09%木聚糖酶添加组显著高于其他各组。这与对凡纳滨对虾[17]、异育银鲫[18]、鲫[7]、草鱼[6]、鲤[19-20]和尼罗罗非鱼[21-22]等的研究结果相一致。杨志刚等[17]对凡纳滨对虾的研究表明,经木聚糖酶解后各组增重率和特定生长率均显著高于对照组。黄峰等[18]研究发现,在饲料中添加100 mg/kg的木聚糖酶时,异育银鲫的生长和增重均显著提高。高春生等[6]研究发现,在草鱼饲料中添加木聚糖酶能显著提高鱼体增重率和饲料利用率,降低饵料系数,且草鱼饲料中木聚糖酶的适宜添加量为0.1%。明红等[22]研究显示,尼罗罗非鱼饲料中木聚糖酶最适添加量为0.1%。饲料中木聚糖酶添加过多反而不利于其增重率和特定生长率的提高,这是因为木聚糖酶添加过量时,过度降低了肠道食糜黏度,致使营养成分通过肠道速度过快,降低了肠道对养分的消化吸收[23]。

表6 不同木聚糖水平对幼参体腔液免疫酶活性的影响Tab.6 Effects of xylanase levels on coelomic fluid enzyme activity of sea cucumber Apostichopus japonicus U/mL
刺参饲料中含有较多的植物性成分,添加木聚糖酶能破坏植物细胞壁,使多糖等营养物质流出,同时,降解木聚糖等抗营养因子,促进肠道对营养物质的吸收利用。此外,木聚糖酶还能有效降低肠道食糜黏度,扩大酶与营养成分的接触面积,提高饲料利用率,并能补充外源酶,刺激内源酶的分泌,增加养殖动物的消化吸收能力[24],这可能是其促生长的主要原因。
3.2 饲料中添加木聚糖酶对幼参体壁成分的影响
本试验结果表明,饲料中添加木聚糖酶对幼参体壁基本成分有一定的改善作用,这与王俊丽等[25]对尼罗罗非鱼和刘伟成等[15]对鲤的研究结果一致。王俊丽等[25]研究表明,0.05%和0.10%木聚糖酶添加组的尼罗罗非鱼肌肉粗蛋白质、粗脂肪和粗灰分含量与对照组相比均有显著提高。刘凯等[26]对鲤的研究表明,0.05%、0.10%和0.15%木聚糖酶添加组与对照组相比,鲤肌肉粗脂肪含量有显著提高。
饲料中添加木聚糖酶能促进肠道蛋白酶活力,增加肠道内游离氨基酸和小肽数量,从而促进蛋白质的合成和积累。同时,添加木聚糖酶降低了肠道食糜黏度,肠道活动增强,从而促进了对脂肪的吸收,增加了体壁中脂肪的沉积。此外,添加木聚糖酶增加了肠道中低聚木糖含量,从而降低了肠道pH值,促进了钙等矿物质沉积,进而使粗灰分含量提高[25]。钟国防等[27]的研究表明,添加木聚糖酶对养殖动物体成分无显著影响。这可能是受所用木聚糖酶的活力及养殖动物种类影响所致。
3.3 饲料中添加木聚糖酶对幼参消化酶活性的影响
本试验结果表明,饲料中添加木聚糖酶对刺参肠道蛋白酶、淀粉酶和脂肪酶活性有不同程度的提高作用。刘凯等[26]对鲤的研究结果显示,饲料中添加0.10%和0.15%的木聚糖酶显著提高了肝胰脏蛋白酶和淀粉酶活性,并对肝胰脏中木聚糖酶、脂肪酶,以及肠道中木聚糖酶、淀粉酶和脂肪酶活性也有一定提高作用。聂国兴等[14,23]在尼罗罗非鱼饲料中添加木聚糖酶,显著提高了鱼体胃蛋白酶和纤维素酶活力,提高了肠道内多种消化酶的活力,饲料中添加木聚糖酶后肠道食糜黏度显著低于对照组,肠道绒毛表面的黏附性颗粒明显减少。
刺参肠道内消化酶主要有蛋白酶、脂肪酶、淀粉酶和纤维素酶,消化酶活力是考察其消化生理一个重要指标[28],其活性高低能影响刺参对营养的吸收和生长生活状况[29]。吴韬等[30]对中华绒螯蟹的研究表明,木聚糖阻碍消化酶与底物接触反应。木聚糖能与肠道中蛋白酶和脂肪酶结合[31],从而降低肠道消化酶活性,影响养殖动物对食物中营养的消化吸收。饲料中添加木聚糖酶,不仅能破坏植物细胞壁,使细胞中的养分充分溶出,促进机体对其的吸收利用并有效降解木聚糖,而且还能减少其与内源消化酶结合,使内源消化酶活力得以提高,外源添加木聚糖酶能有效降低肠道食糜黏度,增大食物营养与酶的接触面积,刺激肠道化学感受器诱导促胰酶素的分泌,进而刺激内源酶分泌[32]。
3.4 饲料中添加木聚糖酶对幼参体腔液酶活性的影响
水产动物普遍没有完善的特异性免疫系统,而刺参通常被认为缺乏特异性免疫应答[33],非特异性免疫在其抵御外界病原体和细菌的防御中起着尤为重要的作用[34-36]。溶菌酶、超氧化物歧化酶及过氧化氢酶均是其免疫及抗氧化过程中重要的功能因子[37]。本研究表明,添加木聚糖酶显著提高了刺参的溶菌酶和过氧化氢酶活性,对超氧化物歧化酶活性的提高尽管不显著,也表现出一定的提高作用。这与黄峰[38]、钟国防等[27]的研究结果相一致。黄峰[38]在异育银鲫饲料中添加50 mg/kg和100 mg/kg的木聚糖酶,显著提高了异育银鲫血清、头肾、脾脏中溶菌酶和超氧化物歧化酶活力。钟国防等[27]对尼罗罗非鱼的研究表明,饲料中木聚糖酶添加组肝胰脏和脾脏中溶菌酶及超氧化物歧化酶活性均显著高于对照组。添加酶制剂后,提高了刺参的消化吸收能力,特别是提高了鱼体对蛋白质及其他营养成分的利用率,从而也促进了相关免疫因子的合成,加强了鱼体的代谢水平,产生了更多的 O2-·等自由基,相应地也提高了超氧化物歧化酶的活力和抗氧化能力。张玲等[10]对尼罗罗非鱼的研究表明,饲料中添加木聚糖酶显著提高了谷丙转氨酶活力,但对谷草转氨酶活力影响不显著。转氨酶是催化氨基酸与酮酸间氨基转移的一种酶,谷草转氨酶和谷丙转氨酶是其中重要的两种,通常被用来评价动物肝脏细胞受损情况,也可以反映体内蛋白质代谢状况[39-40]。张玲等[10]指出,谷草转氨酶和谷丙转氨酶活力的提高能促进体内蛋白质代谢效率,转氨酶活性高低能反映氨基酸代谢水平。本试验研究显示,添加木聚糖酶能显著提高刺参体腔液中谷草转氨酶和谷丙转氨酶的活性。这说明,添加木聚糖酶提高了氨基酸代谢活力,参与了营养代谢过程,进而对于机体免疫性能也产生了一定的积极作用,但其具体影响机理还需进一步研究。
综上,饲料中添加适量木聚糖酶对刺参免疫酶、抗氧化酶和转氨酶活性的提高以及刺参免疫和抗氧化性能的增强具有重要意义。
4 结语
饲料中添加木聚糖酶能够显著提高刺参增重率和特定生长率,提高免疫和抗氧化能力,促进消化机能,对改善体成分也有一定影响。但木聚糖酶添加过少可能影响不明显,过量添加则可能产生一些负作用,导致促进作用不显著甚至抑制幼参生长。在本试验条件下,以增重率为评价指标,通过折线模型分析得知,初始体质量为(7.73±0.09)g的幼参饲料中木聚糖酶最适添加量为900 mg/kg。
