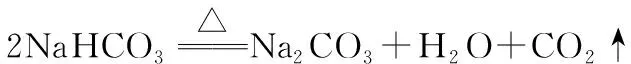梳理基础知识 强化备考方略——钠及其化合物的相关基础知识总结与实际应用
2018-07-20云南
云南
吴 霞
高中化学知识的介绍是呈螺旋式的,不断地反复,不断地加深。高考试题的考查,是对知识的综合考查,常常跳出教材考查教材知识的迁移应用和综合应用。高考复习时可以将三年已学知识进行整合,找到知识的内在联系,发散思维,灵活运用。通过思维导图和知识提纲的整理将教材知识变“薄”,在做题时再将知识变“厚”。
金属钠是短周期元素中金属性最强的元素,它是活泼金属的典型代表,除具有活泼金属的通性外,还有一些自己的特性。在高考知识的考查中,考查形式多样。现将钠及其化合物的知识进行串讲,将高中知识系统化,抛砖引玉,提供给同仁们一种整合知识和应对高考的方式方法。
一、钠及其化合物思维导图和知识要点归纳
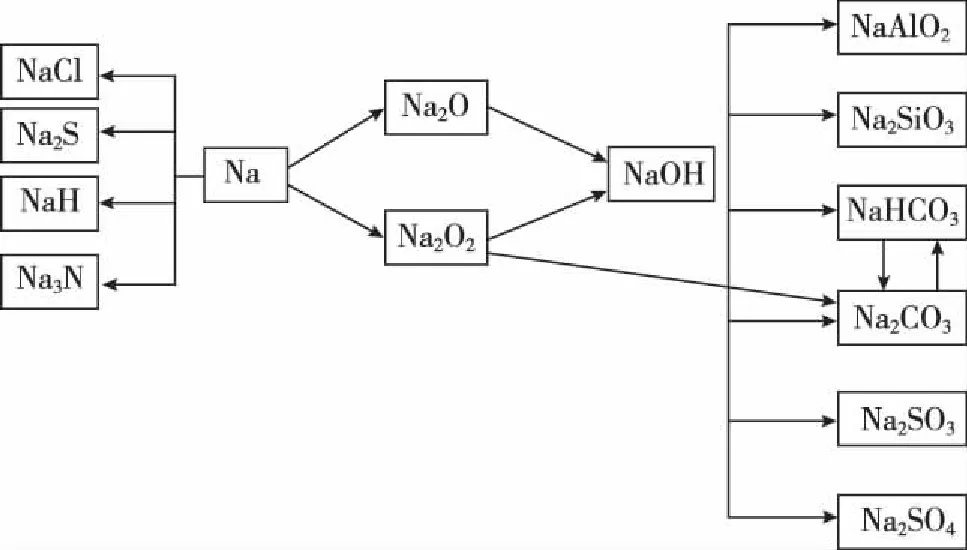
思维导图解析要点归纳:
1.注意金属钠在元素周期表、金属活动顺序表中的位置,金属钠的物理性质。
钠元素在元素周期表中位于第三周期第ⅠA族,是短周期中金属性最强、原子半径最大的元素。钠在周期表和金属活动顺序表中的位置反映出其在短周期中单质的还原性最强、与酸反应置换氢气的能力最强、最高价氧化物对应水化物的碱性最强。这些特点在高考题中常作为推导和确定钠元素的突破口。
钠的物理性质中最常被使用到的是:质软(可以用小刀切割)、熔沸点低(钠与水反应放出的热量就可让其熔成一颗闪亮的小球)、密度小(ρ水>ρ钠>ρ煤油,将钠放入煤油和水的混合物时,会在二者分界处上下跳动)。
2.金属钠与硫黄发生反应的条件是研磨;将金属钠点燃伸入到盛有氯气的集气瓶中,观察到黄色火焰、白烟。
3.实验室中金属钠、过氧化钠、氢氧化钠的保存。
①少量金属钠保存在煤油中,大量金属钠保存在石蜡油中;
②过氧化钠盛放在塑料袋中,密封后保存在铁罐中;

4.元素化合物性质的学习中,方程式记忆的准确性非常重要,可以采用比较记忆法,找出相似反应的异同,加以运用,可以提高记忆的准确性和牢固程度。比如:
①钠与氧气在常温和点燃条件下的反应,条件不同产物不同。

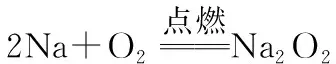


④碳酸钠与碳酸氢钠的相互转化、混合时的分离提纯、互为杂质时的除杂。
⑤Na、Na2O、Na2O2与水反应共同产物是NaOH,Na、Na2O2与H2O反应时产生的气体分别是H2、O2,注意对各个化学反应方程式化学计量数进行比较,找到异同便于记忆。



5.元素化合物知识中的特殊反应是知识考查中的热点,在学习中要注重分析原理、找规律、找异同,考试时常常是复习现有知识或通过陌生物质为平台,进行知识迁移的考查。
①过氧化钠分别与水及二氧化碳的反应都属于歧化反应,Na2O2既是氧化剂也是还原剂。关系式有:2Na2O2~O2~2e-,此知识点在关于NA的计算中是常常出现的考点、热点和易错点。

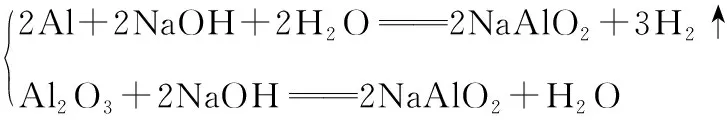
从以上两组反应可发现:
a.在短周期元素中能和强碱,比如NaOH、KOH反应产生氢气的金属单质是Al,非金属单质是Si。在高考中知识迁移,考到过和Al具有相似性质的还有锌(Zn)和镓(Ga);
b.单质及氧化物与强碱反应生成相同的盐的反应,常见的也只有这两组。该特点可用于记忆和书写化学反应方程式,也可用于物质的推导。
6.比值关系
①在Na2O和Na2O2晶体中,阳离子与阴离子的比值为2∶1。这在选择题中常常作为考点来考查。
②在短周期元素中A与B可形成原子个数比为2∶1和1∶1的物质,这样的组合有很多,例如:Na2O和Na2O2、H2O和H2O2、CO2和CO、NO2和NO等。
7.元素化合物的相互转化反应中,有同一种物质参与的连续反应作为特征反应常常出现, 如:
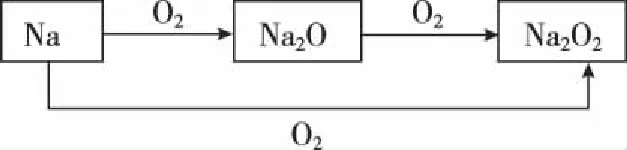
这样的知识点可衍生为用量不同,现象不同的物质性质考查试题。为了应对这样的考查,我们需对这类反应进行归纳整理,连续氧化的反应很多,主要集中在非金属元素物质的转化上,如:
①C、CO、CO2之间的转化。
②S、SO2、SO3之间的转化,但是需注意S不能与O2反应只通过一步反应生成SO3。
③H2S、S、SO2之间的转化(将②③两条连起来就是比较长的连续氧化反应)。相类似的还有NH3、N2、NO、NO2之间的转化。
④除了无机物质的反应,还有有机化学知识中伯醇、醛、羧酸之间的转化。
⑤除了连续氧化外,与同一种物质发生连续反应常见的还有:

二、钠及其化合物的应用与题型研究
通过对金属钠的总结并整合主体知识,进一步认识反应原理、实验原理,发现分析问题的多个角度,为高考中解答试题储备知识。熟记、理解上述知识点,将教材中的知识点进行比较、整合后,遇到考查相关知识点的考题就可以调用知识,迁移知识,提高准确度。
【例1】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
( )
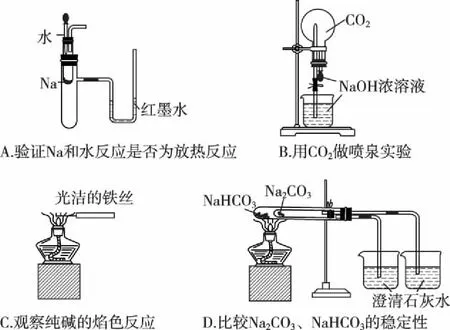
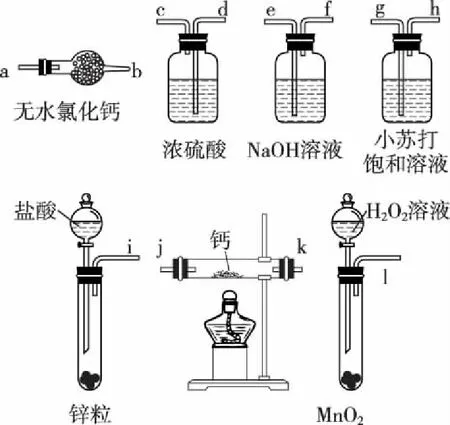
A.简单离子半径:W B.W与X形成的化合物溶于水后溶液呈碱性 C.气态氢化物的热稳定性:W D.最高价氧化物的水化物的酸性:Y>Z 【答案】B 【解析】本题的突破口是“X的原子半径是短周期主族元素原子中最大的”,联想分析判断出X为钠元素,ZX形成的化合物为中性,说明为氯化钠,W、X的简单离子具有相同电子层结构,则W在第二周期且是非金属元素,可能是氮元素或氧元素,则Y为硫元素或者是磷元素。A.钠离子和氧离子电子层结构相同,核电荷数越大,半径越小,故钠离子半径小于氧离子半径,故错误;B.氮或氧和钠形成的化合物为氧化钠或过氧化钠或磷化钠,其水溶液为氢氧化钠,显碱性,故正确;C.水和硫化氢比较,水稳定性强,故错误;D.最高价氧化物对应的水化物中高氯酸是最强酸,故错误。 【考点定位】考查原子结构和元素周期律的关系。 【例2】下列实验装置不能达到实验目的的是 ( ) 【答案】D 【解析】利用密闭容器中气体受温度影响而热胀冷缩达到实验目的,是对钠与水的反应的考查,A对;NaOH具有强碱性,可与酸性氧化物CO2反应,使圆底烧瓶中形成负压,可发生喷泉实验,B对;铁丝的焰色很浅,对钠的焰色无影响,可以达到实验目的,C对;利用套管实验对比Na2CO3和NaHCO3的热稳定性,热稳定性差的NaHCO3应放在内管中,D错。 【考点定位】钠及其化合物的性质。 【例3】(2008·北京理综,7)1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( ) A.Na2CO3B.Na2O2Na2CO3 C.NaOH Na2CO3D.Na2O2NaOH Na2CO3 【答案】A 【考点定位】定量考查钠化合物之间的相互转化。 【例4】氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。 回答下列问题: (1)请选择必要的装置,按气流方向连接顺序为__________________(填仪器接口的字母编号)。 (2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;________(请按正确的顺序填入下列步骤的标号)。 A.加热反应一段时间 B.收集气体并检验其纯度 C.关闭分液漏斗活塞 D.停止加热,充分冷却 (3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验确有CaH2生成。 ①写出CaH2与水反应的化学方程式:__________________; ②该同学的判断不准确,原因是__________________。 (4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象:__________________。 (5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是__________________。 【答案】(1)i→e, f→d, c→j, k(或k, j)→a (2)BADC (4)取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色 (5)氢化钙是固体,携带方便