低温胁迫对细茎柱花草与TPRC2001-1柱花草抗寒生理指标的影响
2018-07-13杨鹏郅柯善文钟天秀解新明
李 黎,杨鹏郅,柯善文,钟天秀,2,陈 曙,2,解新明,2
(1.华南农业大学林学与风景园林学院,广东 广州 510642; 2.广东省草业工程技术研究中心,广东 广州 510642)
Chen ShuE-mail:shuchen@scau.edu.cn
柱花草(Stylosanthesguianensis)是我国热带、亚热带地区分布较为广泛,且具有耐干旱、耐酸铝、抗炭疽病,营养丰富、适口性好、产量高等特点的优良豆科牧草[1-2]。同时柱花草也广泛应用于天然草地改良、果草生态建设及水土流失治理和退耕还林还草等各大领域[3]。但是大部分柱花草品种不耐寒冷,对低温十分敏感,在我国南方冬季难以存活,更难以在北方得到广泛推广种植[4]。细茎柱花草(S.guianensisvar.intermedia)是一种多年生优良豆科牧草,是柱花草的一个变种,1948年从美国引入澳大利亚(Gayndah和Brian地区)进行栽培,我国华南地区20世纪60年代从澳洲引进种植,国人常将其翻译为“奥茨利”或“奥克雷”,该变种具有较好的抗低温、耐酸和耐低肥等特点,在广东韶关地区可安全过冬长达40多年[5]。有研究对细茎柱花草转录组进行测序,发现低温胁迫下细茎柱花草中转录因子SgNAC1和SgNAC2能较早地响应低温,而SgGH3可能受其他基因的调控,在后期表达[6]。刘攀道等[7]发现磷高效基因型TPRC2001-1的根部酸性磷酸酶活性显著高于磷低效基因细茎柱花草。细茎柱花草对低温胁迫有一定的适应能力,但对其适应低温胁迫的主要生理机制鲜有报道。因此,研究细茎柱花草抗寒性的生理机制甚为重要,可以为今后的抗寒育种工程提供重要的研究基础。
植物的生长发育会受到环境因子的影响,低温是限制植物生长发育的环境因子之一。植物在受低温影响后几个小时,最多1 d即可表现出症状。低温不仅会使植物生长停滞,还会造成植物减产,严重时导致植物死亡[8]。生物膜系统是冷害作用的首要作用部位[9],膜的外形和厚度一旦发生变化,膜上会产生皲裂,因而膜的透性增大,离子大量外渗,电导率上升[10],导致代谢不平衡,合成能力降低,分解加速,最终导致细胞死亡。同时,低温胁迫下植物体内活性氧自由基积累,细胞膜脂过氧化,导致丙二醛含量上升[11]。植物在低温环境下,会通过积累相关渗透调节物质来降低、阻止或修复低温造成的伤害,使其仍保持正常的生理活动[12]。脯氨酸作为低温胁迫后的能源物质能有效清除活性氧,提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)的活性[8]。可溶性糖能够增加细胞液浓度,提高细胞的保水能力,降低细胞冰点,减少胁迫对植物伤害[13]。可溶性蛋白作为亲水性较强的物质,可以束缚较多的水分,在低温下减少细胞死亡的机率,从而提高植物的抗寒能力[13]。
本研究以细茎柱花草为材料,探讨叶片在低温胁迫下,相对电导率、丙二醛、游离脯氨酸、可溶性糖、可溶性蛋白等抗寒性相关的生理指标的变化,旨在检测细茎柱花草的抗寒性,以期对今后选育抗寒性强的柱花草品种提供鉴定参考。
1 材料与方法
1.1 试验材料
试验对象为细茎柱花草,种植于华南农业大学草业科学系引种园(113°28 N;23°12 E),对照为柱花草TPRC2001-1,其种子取自华南农业大学农学院根系生物学研究中心。
1.2 试验设计
在两种处于营养期的柱花草种质资源植株上剪下枝条扦插于盆中,每个品种10盆,每盆2株,于华南农业大学草业科学系温室中正常生长。60 d后,将其置于4 ℃冷库中进行低温处理,分别于0 h(低温处理前),24 h和48 h后取相同部位的叶片测定其相对电导率,每个处理3个重复。测定其余生理指标的叶片迅速放于液氮中至-80 ℃超低温冰箱保存备用。
1.3 指标测定及方法
参照测量相对电导率的方法[14],用电导仪(上海雷磁新泾仪器有限公司DDS-11A)检测溶液电导率;采用硫代巴比妥酸法[15]测定丙二醛(malonaldehyde,MDA)(FW)含量;茚三酮比色法[16]测定脯氨酸含量(FW);蒽酮显色法[17]测定可溶性糖的含量(FW);考马斯亮蓝比色法[17]测定可溶性蛋白含量的(FW)。每个指标数据均 3 次重复。
1.4 数据分析
采用SPSS 20.0软件对所测数据进行统计分析,用平均值和标准误表示测定结果,对不同低温时间处理进行单因素方差分析,并用Tukey法对各测定数据进行多重比较;采用Excel 2007制图。
2 结果与分析
2.1 低温胁迫对细茎柱花草质膜相对透性的影响
2.1.1相对电导率的变化细茎柱花草和TPRC2001-1柱花草的相对电导率随处理时间的增加而升高,且相对电导率表现为TPRC2001-1柱花草>细茎柱花草(图1A)。在低温处理前,两种柱花草的相对电导率无显著差异(P>0.05),处理24 h后,两种柱花草的相对电导率开始显著上升,说明此时柱花草细胞膜开始受损,且TPRC2001-1柱花草的相对电导率显著高于细茎柱花草(P<0.05)。在低温处理48 h下,TPRC2001-1柱花草的相对电导率达到了44.52%,显著高于细茎柱花草的21.23%(P<0.05);同时,处理48 h的细茎柱花草的相对电导率还显著低于低温处理后24 h的TPRC2001-1柱花草的相对电导率(P<0.05),说明低温处理时间越长,柱花草叶片受损伤越严重,细茎柱花草细胞膜受损程度相对TPRC2001-1柱花草小。
2.1.2丙二醛含量的变化两种柱花草低温胁迫后丙二醛浓度随着低温胁迫时间的增加均表现出逐渐升高的趋势,这说明随着低温处理时间的增加,柱花草细胞膜的膜脂过氧化反应加强,造成丙二醛的过量积累(图1B)。低温处理前,细茎柱花草和TPRC2001-1柱花草的丙二醛含量无显著差异,分别为0.81和0.76 μmol·g-1(P>0.05)。低温处理后,两种柱花草的丙二醛含量上升,在低温处理24 h和48 h后,细茎柱花草的丙二醛含量显著低于TPRC2001-1柱花草(P<0.05);但处理48 h后的细茎柱花草与处理24 h 后TPRC2001-1柱花草的丙二醛含量无显著差异(P>0.05)。以上结果说明低温导致细胞膜受到脂质过氧化损伤,且品种间受损伤程度不同;在相同低温处理条件下,相对TPRC2001-1柱花草而言,细茎柱花草受损伤程度较小。
2.2 低温胁迫对细茎柱花草渗透调节物质含量的影响
2.2.1脯氨酸含量的变化脯氨酸对逆境胁迫有一定的保护作用,它能防止细胞失水,保护大分子结构的稳定性。随着低温处理时间的延长,两种柱花草的游离脯氨酸含量持续上升(图2A)。低温处理前,细茎柱花草和TPRC2001-1柱花草的游离脯氨酸含量无显著差异(P>0.05),含量分别为6.40和6.72 μg·g-1;处理24 h后,两种柱花草的脯氨酸上升,且细茎柱花草的脯氨酸显著高于TPRC2001-1柱花草(P<0.05);处理48 h后,细茎柱花草游离脯氨酸的含量达到了处理前的4.31倍,为27.61 μg·g-1,显著高于TPRC2001-1柱花草(P<0.05),表明细茎柱花草能够积累更多脯氨酸以防止植物体脱水,细胞内环境稳定性较好。
2.2.2可溶性糖含量的变化在低温胁迫下植物体内的糖含量增高,糖的积累能提高胞内溶质浓度,增强持水力,使之在低温下更难结冰[18],降低低温胁迫对细胞的伤害。随着低温处理时间的延长,两种柱花草的可溶性糖含量持续上升(图2B)。低温处理前,细茎柱花草和TPRC2001-1柱花草的可溶性糖含量无显著差异(P>0.05),含量分别为5.12和4.93mg·g-1;处理后,两种柱花草的可溶性糖含量上升,低温处理24 h后,细茎柱花草的可溶性糖显著高于TPRC2001-1柱花草(P<0.05);处理48 h后,细茎柱花草可溶性糖含量达到了17.61 mg·g-1,显著高于TPRC2001-1柱花草(P<0.05),表明细茎柱花草可积累更多糖来增加细胞的渗透浓度,细胞的保水能力强于TPRC2001-1柱花草。
不同小写字母表示差异显著(P<0.05),下同。
Different lowercase letters indicate significant differences at the 0.05 level;similarly for Fig. 2.
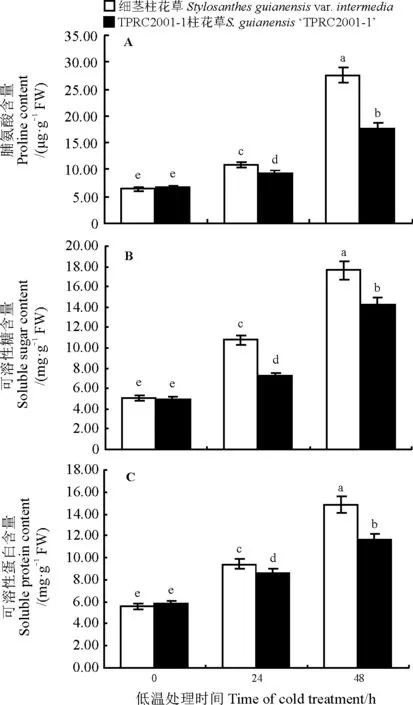
图2 低温胁迫对细茎柱花草和TPRC2001-1柱花草脯氨酸、可溶性糖、可溶蛋白含量的影响Fig. 2 Influence of low temperature stress on the proline, soluble sugar and soluble protein content of Stylosanthes guianensis var. intermedia and S. guianensis ‘TPRC2001-1’
2.2.3可溶性蛋白含量的变化植物在低温胁迫下通过增加可溶性蛋白的含量来提高抗寒性。随着低温处理时间的增加,两种柱花草的可溶性蛋白含量持续上升。低温处理前,细茎柱花草和TPRC2001-1柱花草的可溶性蛋白含量无显著差异(P>0.05),含量分为5.54和5.84 mg·g-1;处理24 h后,两种柱花草的可溶性蛋白上升,细茎柱花草的可溶性蛋白含量显著高于TPRC2001-1柱花草(P<0.05);处理48 h后,细茎柱花草可溶性蛋白的含量达到了处理前的2.67倍,显著高于TPRC2001-1柱花草(P<0.05),表明可溶性蛋白的含量与柱花草抗寒性相关,且细茎柱花草在低温胁迫下积累更多的可溶性蛋白(图2C)。
3 讨论
3.1 质膜透性与抗寒性的关系
当植物遭受低温胁迫时,植物中最先受伤害的部位是细胞膜,细胞膜破损导致胞内电解质的外渗,水分流失,外渗的电解质大小可以用相对电导率反映[19]。本研究中,低温处理后细茎柱花草与TPRC2001-1柱花草的相对电导率迅速增加,且两者存在明显差异,细茎柱花草的相对电导率增加较小,相对电导率的大小变化与抗寒性成负相关。董琛等[8]在研究24份柱花草资源的抗冷性评价中发现冷处理后,相对电导率随时间的增加而增加,且在处理1 d后,不同柱花草种质间的相对电导率差异显著,5 d后种质间的差异更大,其中热引18号柱花草、品109柱花草、马弓形柱花草和粤研1号柱花草电导率值低,抗冷性较强。这与本研究的结果相似,说明细茎柱花草较TPRC2001-1柱花草的抗寒性较强。
在低温锻炼期间,植物细胞会积累过多的活性氧自由基,这些物质会引起细胞膜脂过氧化反应,而丙二醛则为该反应的终端产物[20]。对马铃薯(Solanumtuberosum)抗寒性研究表明,在低温胁迫条件下,品种间丙二醛的含量差异显著,抗寒品种中丙二醛含量增加较小,且丙二醛的含量变化与抗寒性呈负相关关系[21]。本研究中,低温处理后,两种柱花草的MDA含量随着时间的推移不断上升,且品种间差异显著。在低温处理24和48 h细茎柱花草的MDA含量显著低于同处理TPRC2001-1柱花草的含量,表明细茎柱花草相对TPRC2001-1柱花草是抗寒能力较强的品种。
3.2 渗透调节物质与耐寒性的关系
脯氨酸是植物体内能有效调节渗透能力的重要物质之一[22],它不仅能够通过增强蛋白质水合作用来提高植物的保水能力,而且还能保持细胞中酶结构的稳定性,降低细胞损伤[23]。本研究中,低温处理后的游离脯氨酸含量迅速增加,且细茎柱花草与TPRC2001-1柱花草存在明显差异,细茎柱花草的游离脯氨酸含量增加较多。脯氨酸的大小变化与抗寒性呈正相关关系,通过脯氨酸含量测定比较10种宿根花卉抗寒性发现,低温处理后不同品种脯氨酸含量变化的幅度不同,抗寒性强的马蔺(Irislacteavar.chinensis)、紫萼(Hostaventricosa)、大花飞燕草(Delphiniumgrandiflorum)品种其脯氨酸总体的变化幅度较大[24]。这与本研究细茎柱花草表现一致,说明细茎柱花草的抗寒性较好。
糖是植物生长过程中重要的调节物质[25]。在逆境中,植物会通过增加可溶性糖含量来提高自身的抵抗力。可溶性糖能调节细胞渗透压来增大细胞的保水能力,防止其遭受低温而凝固,以增强植物耐寒性[26]。前人研究表明,在低温胁迫条件下,品种间可溶性糖的含量差异显著,抗寒品种中可溶性糖含量增加较多,且可溶性糖的含量变化与抗寒性呈正相关关系[27]。在本研究中,低温处理24和48 h的细茎柱花草的可溶性糖含量增加较同处理的TPRC2001-1柱花草显著增加,表明细茎柱花草的抗寒性强于TPRC2001-1柱花草。
可溶性蛋白是一类亲水性的、能束缚水分的高分子化合物,能降低因在低温下结冰而伤害致死的机率[28]。高京草等[29]对不同抗寒性枣树品种枝条中可溶性蛋白含量的测定结果表明,抗寒性强的木枣品种可溶性蛋白含量高,抗寒性弱的晋枣品种可溶性蛋白质含量较低。本研究中也得出相同的结果,两种柱花草的可溶性蛋白含量在处理后迅速上升,品种间差异显著,TPRC2001-1柱花草显著低于细茎柱花草。说明细茎柱花草是抗寒性较强的柱花草品种。
许多研究表明,植物的抗寒机制是一个极其复杂的生理生化的过程,涉及多种物质共同作用,单一的抗寒指标不能全面反映植物对冷胁迫的适应力[30]。植物的抗寒性评价受多种不同抗寒指标的综合影响。本研究中,综合相对电导率、丙二醛含量、脯氨酸、可溶性糖和可溶性蛋白各项生理指标,得到细茎柱花草的抗寒性强于TPRC2001-1柱花草。
4 结论
随着低温处理时间的增加,两个品种柱花草叶片中的相对电导率、丙二醛、脯氨酸、可溶性糖和可溶性蛋白含量显著增加,但两个品种各项指标的变化幅度有所不同。在4 ℃低温相同时间处理条件下,细茎柱花草的各项抗寒性生理指标均优于TPRC2001-1柱花草,说明细茎柱花草具有较强抗寒性,可作为一种抗寒品种加以开发、研究和利用。
