利用DNA免疫技术制备GATA1蛋白多克隆抗体
2018-07-06曹灵慧陈宇霖欧柏青吴秀山
郭 芬,曹灵慧,陈宇霖,欧柏青,吴秀山*
(1.湖南师范大学蛋白质化学及鱼类发育生物学教育部重点实验室, 心脏发育研究中心, 湖南 长沙 410081;2.湖南师范大学第一附属医院, 湖南 长沙410005)
GATA家族是一类能够特异性识别受调控基因启动子内GATA基序并与其结合的转录调控因子。其共同特点除了对一致性的序列(T/A)GATA(A/G)具有高度的亲和性之外还均具有锌指结构。GATA家族包括GATA1至GATA6六个成员[1],根据最初的研究及其参与的生命活动的不同,将此6种转录因子又细分为GATA1/2/3和GATA4/5/6。前者参与调控红细胞、淋巴细胞和性腺的发育,而后者则调控机体心脏、消化系统及胚组织的分化[2];已知GATA1是造血系统特有的转录因子[3],表达严格限制于造血细胞系,包括红系祖细胞、红细胞、巨噬细胞、肥大细胞等。GATA1控制不同谱系分化的功能大多通过与不同的蛋白质作用来实现,在红系发育过程中,GATA1会与造血转录因子或染色体重塑复合体形成多种复合体,发挥特定的功能[4]。
gata1基因定位于Xp21-11上,cDNA为1.8 kb,所编码的GATA1转录因子为413个氨基酸[5]。人的gata1基因具有6个外显子,分子量约为42 kD,研究表明,人体gata1基因突变至少与唐氏综合征儿童患者发生急性巨核细胞白血病部分有关[6]。斑马鱼gata1基因位于11号染色体上,共有6个外显子,cDNA全长1 257 bp,编码413个氨基酸。
本文采用的是一种新型的免疫学技术-DNA免疫技术[7]。该技术所用的质粒pCAGGGS-p7含有鸡的β-actin启动子和CMV增强子[8],可以使下游插入基因在哺乳动物细胞中更加高效的表达,且质粒上具有KpnI、XhoI、EcoR I等多种酶切位点,方便目的基因的插入。本研究将具有gata1目的基因的高纯度重组质粒pCAGGGS-p7/gata1注射进小鼠肌肉、皮下部位,使小鼠体内表达外源性的目的基因,发生抗原抗体免疫反应,从而诱导小鼠对外源DNA产生抗体。DNA免疫的详细机理目前尚不十分清楚,其免疫机制可能为:肌细胞通过T小管和细胞膜穴样内陷把外源基因纳入并表达相应的抗原蛋白[9],抗原蛋白被抗原呈递细胞摄取后被水解为多肽,一部分与MHC-Ⅰ类分子结合,被CD8+CTL细胞识别;另一部分多肽可以进入溶酶体/内体区与MHC-Ⅱ类分子结合,表达在细胞膜后被CD4+TH细胞识别,从而来激发机体有效的免疫应答[10]。分泌到细胞外的抗原则被带有相应抗体的B细胞捕捉,在Th细胞的作用下转化为浆细胞产生抗体。Vahlsing等[11]认为:肌细胞可能作为一种中心成分直接参与免疫应答,而小鼠肌细胞能够有效的吸收和表达外源DNA的机理尚不清楚,可能与其自身的结构有关[12]。该免疫技术可用于已知DNA编码而又不能得到目的蛋白或获得的抗原蛋白为低免疫原性抗原的免疫。
由于斑马鱼血细胞的谱系及调节血细胞的基因与哺乳动物高度保守,且斑马鱼心血管系统早期发育与人类极为相似,而血液和心血管系统有缺陷的斑马鱼突变体仍然可以存活数天,为该领域研究提供了极为有利的条件,斑马鱼成为了造血系统研究的最佳模式生物[13]。为了进一步通过斑马鱼研究gata1基因在血液血管发育方面的功能,我们需要制备GATA1多克隆抗体。本文克隆了斑马鱼gata1基因全部编码区,并构建真核表达质粒pCAGGGS-p7/gata1通过DNA免疫技术免疫小鼠,分离免疫后血清,制备多克隆抗体。结果表明制备的GATA1多克隆抗体特异性好,效价高,能用于GATA1功能的进一步研究。
1 材料与方法
1.1 菌株、质粒、细胞和主要试剂
大肠杆菌感受态DH5α、真核表达质粒pCAGGS-p7以及HEK293T细胞为湖南师范大学心脏发育实验室保存。BALB/c小鼠购自湖南斯莱克景达实验动物有限公司。常规RpMII640培养液,含10%新生牛血清(FBS),10 mmol/L Hepes,28 ℃、5%CO2条件下培养。高保真酶试剂盒购自唯赞公司,限制性内切酶KpnI、XhoI以及T4DNA连接酶均购自Takara公司。DNA纯化回收试剂盒、质粒提取试剂盒购自康为世纪生物公司。
1.2 引物设计与合成
在NCBI网站上搜索到斑马鱼gata1基因cDNA序列,经primer5.0软件设计引物p1/p2如下所示。在p1/p2引物前均加入同源臂序列,同源臂序列中分别引入限制性内切酶KpnI、XhoI识别位点。于上海生工公司合成,设计合成出的一对引物如下(下划线序列为内切酶识别位点):
p1:pCAG-gata1-F:
CTATAGGGCGAATTGGGTACC ATGGAGAACTCCTCTGAGCCTKpnI
p2:pCAG-gata1-R:ATCGATACCGTCGACCTCGAGTC ACACTAGTGTGGGCATCATXhoI
1.3 pCAGGS-p7/gata1表达质粒的构建
首先用Trizol从发育至24 h的野生型斑马鱼胚胎中提取总RNA,反转录合成cDNA。以cDNA为模板用上述p1/p2引物进行高保真pCR扩增,成功扩增出长1 257 bp的gata1基因序列。反应条件为:95 ℃预变性3 min,95 ℃变性15 s,56 ℃复性15 s,30个循环,72 ℃延伸30 s,4 ℃保存备用。将获得pCR产物琼脂糖电泳后经回收制备约1 200 bp的gata1片段,与用限制性内切酶KpnI和XhoI双酶切pCAGGS-p7质粒回收约5 000 bp片段,用T4DNA连接酶16 ℃连接16 h。
1.4 大肠杆菌的转化及重组质粒的鉴定
将上述gata1片段与pCAGGS-p7载体连接产物转化DH5α感受态细胞,通过氨苄青霉素抗性筛选,挑取阳性单克隆菌落至液体培养基中,37 ℃培养。以培养菌液为模板并以p1/p2为引物进行pCR扩增,经琼脂糖凝胶电泳后初步确定重组质粒pCAGGGS-p7/gata1阳性克隆,并将阳性的重组质粒进行进一步测序鉴定。
1.5 DNA免疫技术制备小鼠抗GATA1抗体
用pCAGGGS-p7/gata1重组质粒免疫6-8周龄小鼠:电击处理5只小鼠然后对其后肢股四头肌注射重组质粒DNA 50 μg,即每只小鼠注射100 μg。同时无目的基因片段的pCAGGGS-p7空载质粒DNA等量注射5只小鼠作为对照组。分别在小鼠注射后的0、30、60 d,按上述方法注射同种相同剂量质粒DNA。于67 d后取血分离血清,分装后的血清于-80 ℃保存备用。
1.6 Western blot实验检测GATA1多克隆抗体效价
将发育至24 h的野生型斑马鱼胚胎收集于1.5 mL离心管中。胚胎收集后用注射器将水吸净,加入裂解试剂并用研磨棒研磨,在4 ℃摇床静置30 min后将胚胎裂解物制成上样样本,沸水煮5 min,12 000 r/min,5 min取上清。取25 μL经SDS-pAGE凝胶电泳2 h,凝胶经半干转20 min转膜。5%脱脂牛奶室温封闭2 h,用DNA免疫产生的GATA1抗血清稀释成不同浓度作一抗,用免疫前血清做阴性对照,4 ℃摇床过夜。次日,用pBST洗涤3次后加入1∶2 000抗小鼠的二抗,室温孵育1.5 h,pBST洗涤3次后DAB显色观察。
1.7 免疫荧光检测GATA1多克隆抗体效价
将培养48 h的HEK293T细胞,在pBS洗1次后用4%多聚甲醛固定30 min,用pBS洗3次,0.2%Triton-X-100处理10 min和5%山羊血清封闭30 min后实验组用DNA免疫产生的GATA1抗血清1∶100稀释,4 ℃孵育过夜,对照组用等体积的免疫前血清4度孵育过夜。次日,pBS洗3次后,二抗孵育1.5 h,pBS洗3次。DApI按1∶1 000稀释,孵育10 min,pBS洗3次,封片荧光显微镜观察拍照。
2 结果与分析
2.1 真核表达质粒pCAGGS-p7/gata1的构建及鉴定
用p1/p2引物pCR扩增得到约1 257 bp的gata1条带(如图1),1、2、3号泳道对应pCR产物纯化回收后,在连接到pCAGGGS-p7质粒的KpnI和XhoI酶切位点之间,构建重组质粒pCAGGGS-p7/gata1(如图2)。以重组质粒转化后的单克隆菌液为模板进行pCR扩增,鉴定的结果如下图3所示,其中13,15,16号条带与预期目的DNA片段大小相同。为进一步确定重组质粒序列的准确性,选取13号泳道对应的菌液提取质粒测序,进行核苷酸序列比对,结果表明:pCAGGGS-p7/gata1重组质粒的目的基因序列与GenBank数据库中人类gata1序列一致。以上结果表明:pCAGGS-p7/gata1重组质粒构建成功。
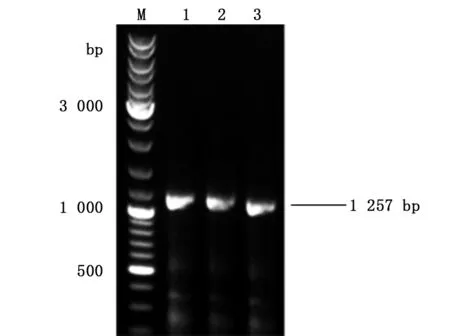
M:DNA marker,1, 2,3:gata1基因pCR扩增电泳图。M: DNA marker, 1, 2, 3: gtat1 gene pCR amplified electrophoresis.图1 pCR扩增电泳图Fig.1 pCR amplification electrophoresis
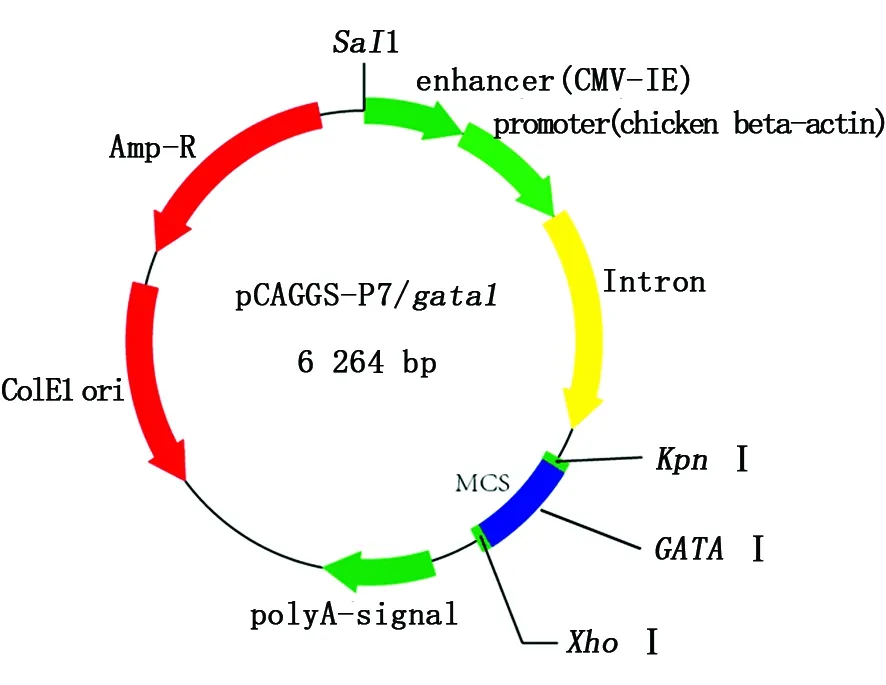
图2 pCAGGGS-p7/gata1重组质粒示意图Fig.2 Construction of pCAGGGS-p7/gata1 Recombinant plasmid
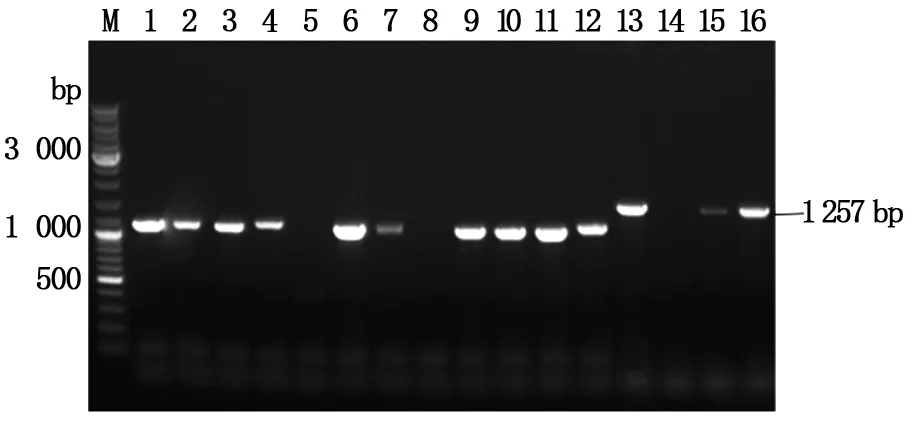
M:DNA标准;1-16:以重组质粒的菌液为模板的pCR产物;13,15,16号泳带为与预期目的条带大小相近的条带。M: DNA marker; 1-16: pCR products based on bacterial solution of Recombinant plasmid; The bands 13, 15 and 16 are similar to the size of the intended destination band.图3 pCAGGGS-p7/gata1重组质粒的pCR验证Fig.3 pCR Verification of pCAGGGS-p7/gata1 recombinant plasmid
2.2 GATA1多克隆抗体Western Blotting鉴定
提取发育至24 h的野生型斑马鱼胚胎总蛋白进行Western blot检测:用自制的GATA1多克隆抗体分别以1∶150、1∶500稀释作为一抗进行检测,结果显示阴性对照未见特异性条带,免疫后血清在42 kD处有一条特异的杂交带出现,且稀释浓度为1∶500时的杂交信号仍然非常明显(如图4)。说明免疫后的小鼠血清中产生了GATA1蛋白的特异性抗体,该抗体的特异性和敏感性良好。
2.3 GATA1多克隆抗体免疫荧光鉴定
免疫荧光实验检测结果表明:阴性对照未见特异性荧光,DNA免疫制备的GATA1抗血清检测HEK293T细胞中有较强特异性荧光,主要集中在细胞质区域(如图5);该结果进一步证明, DNA免疫产生的GATA1多克隆抗体能够识别细胞生理状态下的GATA1蛋白。
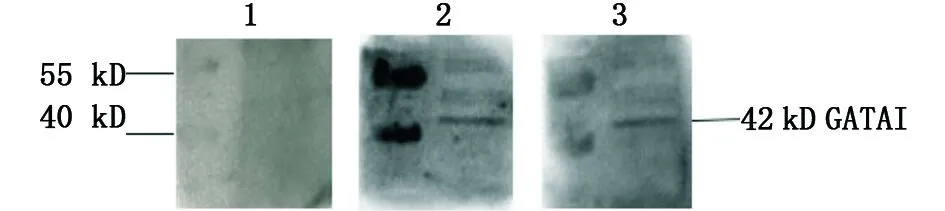
抗体稀释倍数为:1.免疫前血清;2.1∶150;3.1∶500The detection of the antibody titers: 1.control; 2.1∶150; 3. 1∶500图4 GATA1多克隆抗体Western-blotting鉴定Fig.4 Western-blotting of GATA1 polyclonal antibody
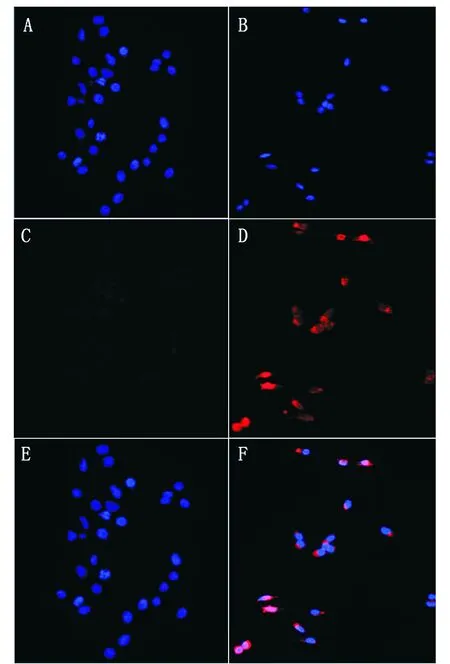
A:免疫前血清免疫的细胞核染色;B:用GATA1多克隆抗体免疫的细胞核染色;C:免疫前血清免疫的GATA1蛋白的表达;D:用GATA1多克隆抗体免疫的GATA1蛋白的表达;E:免疫前血清免疫的merge图;F:用GATA1多克隆抗体免疫的merge图A: Nuclear staining of serum immunization before immunization; B: Nuclear staining immunized with GATA1 polyclonal antibodies; C: Expression of GATA1 protein in serum before immunization; D: Expression of GATA1 protein immunized with GATA1 polyclonal antibody; E: Merge diagram of serum immunization before immunization; F: Merge diagram immunized with GATA1 polyclonal antibody图5 免疫荧光检测抗血清的特异性Fig.5 Immunofluorescence to detect antiserum specificity
3 讨论
GATA1是造血祖细胞或前体细胞发育为特定类型血细胞的关键调节因子[15,16],而斑马鱼又是生物研究的一个重要模式生物,斑马鱼心血管系统早期发育与人类极为相似,所以利用GATA1的抗体来进一步研究斑马鱼的血液血管尤为重要。本研究的目的是制备高效价和特异性好的GATA1多克隆抗体。在研究中,我们采用的是新型免疫技术-DNA免疫技术;通过基因重组技术将编码GATA1抗原蛋白的外源DNA直接导入动物细胞内,在pCAGGGS-p7载体上的强启动子的作用下,在宿主细胞中合成免疫原性蛋白;通过宿主细胞产生对该抗原蛋白的一系列免疫应答,获得免疫后血清。
Western Blot及免疫荧光实验鉴定血清的效价,制备的GATA1多克隆抗体能与真核生物体内表达的GATA1蛋白结合,同时检测显示该多克隆抗体与GATA1蛋白结合的特异性较好,杂带少,为今后进一步通过染色质免疫共沉淀,免疫共沉淀实验研究gata1基因生物学功能提供了重要的研究材料[17,18]。
[1] 汪海涛, 杨红旗, 罗龙龙, 等. GATA1转录因子调控巨核细胞分化机制的研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(5):439-444.
WANG Haitao, YANG Hongqi, LUO Longlong,etal. The GATA1 transcription factor regulates the development of the giant nuclear cell differentiation mechanism[J]. Chinese Journal of pharmacology and Toxicology, 2017, 31(5):439-444.
[2] 张书杰. 小鼠不同脂肪组织中Gata1的表达特点及其在白色脂肪棕色化中的作用研究[D]. 长春:东北师范大学, 2015.
ZHANG Shujie. The expression ofGata1 in different adipose tissues of mice and their role in the browning of white fat[D]. Changchun: Northeast Normal University, 2015.
[3] 赵丹华, 李丽华, 钱新华.GATA1在造血系统中的作用[J]. 发育医学电子杂志, 2013, 1(01):57-61.
ZHAO Danhua, LI Lihua, QIAN Xinhua. The role ofGATA1 in hematopoietic system[J]. Journal of Developmental Medicine, 2013, 1(01):57-61.
[4] 董小明. EDAG/p300/GATA1复合体作用机制研究[D]. 北京: 北京工业大学, 2013.
DONG Xiaoming. EDAG/p300/GATA1 complex mechanism research[D]. Beijing: Beijing University of Technology, 2013.
[5] 吴秀丽.GATA-1、GATA-2和GATA-3基因在白血病和再障骨髓机制细胞中的表达[D]. 广州: 暨南大学, 2003.
WU Xiuli.GATA-1,GATA-2,GATA-3 gene are expressed in the leukemia and the re-blind bone marrow mechanism[D]. Guangzhou: Ji’nan University, 2003.
[6] 轩和.GATA1基因对急性巨核细胞白血病的作用[J]. 国外医学情报, 2003, 24(02):42-43.
XUAN He. The role ofGATA1 gene in acute megakaryocytic leukemia[J]. Foreign Medical Information, 2003, 24(02):42-43.
[7] 刘丽梅, 陈宗涛, 高娜, 等. 利用DNA免疫技术制备抗登革2型病毒NS2B蛋白多克隆抗体[J]. 第三军医大学学报, 2010, 32(4):327-330.
LIU Limei, CHEN Zongtao, GAO Na,etal. Using DNA immuization technology preparation against dengue type2 virus NS2B protein polyclonal antibody[J]. Journal of Third Military Medical University, 2010, 32(4):327-330.
[8] 姜永萍, 张洪波, 步志高, 等. 表达载体pCAGGS显著增强禽流感DNA疫苗的免疫保护效果[J]. 中国农业科学, 2006, 39(4):825-830.
JIANG Yongping, ZHANG Hongbo, BU Zhigao,etal. The expression vector pCAGGS significantly enhanced the immune protection effect of avian influenza DNA vaccine[J]. Science Agricultural Sinica, 2006, 39(4):825-830.
[9] WOLFF J A, DOWTY M E, JIAO S,etal. Expression of naked plasmids by cultured myotubes and entry of plasmids into T tubules and caveolae of mammalian skeletal muscle[J]. Journal of Cell Science, 1992, 103(4):1249-1259.
[10] 杨丽琛. DNA免疫研究进展[J]. 卫生研究, 2006, 35(1):110-114.
YANG Lichen. Advance in DNA immunization[J]. Journal of Hygiene Research, 2006, 35(1):110-114.
[11] VAHLSING H L, YANKAUCKAS M A, SAWDEY M. Immunization with plasmid DNA using a pneumatic gun [J]. Immunol Methods, 1994, 175(1):11-22.
[12] 季玉红. DNA免疫制备单克隆抗体的研究进展[J]. 医学分子生物学杂志, 2000, 22(5):304-307.
JI Yuhong. The research prograss of DNA immune preparation of monoclonal antibodies[J]. Journal of Medical Molecular Biology, 2000, 22(5):304-307.
[13] WHALEN R G, DAVIS H L. DNA-mediated immunization and the energetic immune response to hepatitis B surface antigent[J]. Clin Immunol Immunopathol, 1995, 75(1):1-12.
[14] 霍中军, 温宗华, 刘靖, 等. 斑马鱼红系造血缺陷突变体的正向遗传学[J]. 南方医科大学学报, 2010, 30(5):931-935.
HUO Zhongjun, WEN Zonghua, LIU Jing,etal. positive genetics of hematopoietic defect mutants in zebrafish[J]. Journal of Southern Medical University, 2010, 30(5):931-935.
[15] BRESNICK E H, LEE H Y, FUJIWARA T,etal. “GATAswitches as developmental drivers”[J]. The Journal of Biological Chemistry, 2010, 285(41):31087-31093.
[16] BRESNICK E H, KATSUMURA K R, LEE H Y,etal. “Master regulatoryGATAtranscription factors:mechanistic principles and emerging links to hematologic malignancies”[J]. Nucleic Acids Research, 2012, 40(13):5819-5831.
[17] 朱婷, 黄文, 王跃群, 等. 斑马鱼Hand2基因的克隆、抗体制备及分析[J]. 湖南师范大学自然科学学报, 2010, 33(1):108-113.
ZHU Ting, HUANG Wen, WANG Yuequn,etal. Clonoing and polyclonal antibody preparation ofHand2 gene in zebrafish[J]. Journal of Natural Science of Hunan Normal University, 2010, 33(1):108-113.
[18] 杨建华, 杨青, 吴秀山, 等. 斑马鱼HAS2基因的克隆、抗体制备及分析[J]. 湖南师范大学自然科学学报, 2010, 33(3):73-77.
YANG Jianhua, YANG Qing, WU Xiushan,etal. Clonoing and polyclonal antibody preparation of HAS2 gene in zebrafish[J]. Journal of Natural Science of Hunan Normal University, 2010, 33(3):73-77.
