玫瑰黄酮醇合成酶FLS基因的克隆及生物信息学分析
2018-07-06李忠健张鹏远靳金粉赵兰勇徐宗大
李忠健 ,张鹏远 ,靳金粉 ,赵兰勇 *,徐宗大 *
(1.山东农业大学林学院,山东 泰安 271018;2.山东省林木种苗和花卉站,山东 济南 250000)
玫瑰属于蔷薇科蔷薇属,花形优美,花香四溢,耐寒抗旱,便于管理。花色作为玫瑰一种主要观赏特性,直接影响其观赏价值。类黄酮途径是玫瑰花色形成的主要途径[1],黄酮醇合成酶基因(FLS)是该途径中关键基因之一,它的表达量多少直接影响着花色的形成[2-3]。
Holton等[4]利用PCR技术首次从矮牵牛中克隆出黄酮醇合成酶基因,之后FLS在苦荞麦(Fagopyrum tataricum)[5]、 烟草 (Nicotiana tabacun)[6]、 茶树(Camellia sinensis)[7]、金银花(Lonicera japonica)[8]等多种植物成功被克隆,其蛋白结构也已明确。在此基础上,FLS基因开始通过基因工程应用于花色基因的改良工作,Zhou等[9]将金花茶的FLS基因在烟草中过量表达后,烟草花色转变为白色和黄色,并且花色苷成分明显减少,黄酮醇明显增加,进一步说明该基因是在类黄酮途径中的重要基因。
玫瑰花色多以紫色为主,也有少量粉色、白色品种,但是缺乏黄色、橙色等品种[10],花色的单一严重限制了玫瑰作为观赏植物的应用。目前杂交育种的手段是改良玫瑰花色的主要方法,而很少利用基因工程,因此怎样通过基因工程改良玫瑰花色可作为今后培育玫瑰新品种的一个新的研究方向。FLS基因作为玫瑰花色合成途径上的关键基因之一,本研究将其在玫瑰花瓣中分离并分析,对今后玫瑰花色的改良有重要意义。
1 材料与方法
1.1 试验时间地点
2016年于山东农业大学林学院花卉研究所进行试验。
1.2 植物材料
所用植物为山东农业大学玫瑰种质资源圃内的玫瑰野生类型 ‘珲春’(Rosa rugosa‘Hunchun’),2016年4月至5月中旬采摘初开期花瓣,迅速放入液氮中,然后保存于-80℃冰箱中。
1.3 试验方法
1.3.1 基因克隆
采用EASYspin植物RNA快速提取试剂盒提取‘珲春’花瓣的总RNA,1.0%的非变性琼脂糖进行凝胶电泳检测RNA的完整性,利用Nanodrop2000C微量分光光度检测RNA的纯度和浓度。检测合格的RNA参照反转录试剂盒5X ALL-In-One RT MasterMix说明书合成cDNA第一链。参照本实验室已有的玫瑰花瓣转录组测序结果,设计该FLS基因特异性引物:上游引物 RrFLS:5’-ATGGGGGTAGAGAGAGTTC-3’;下游 引 物 RrFLSR:5’-AGATGGCCAGTGGTACGAT-3’,引物合成由上海生物工程有限公司进行。
以cDNA作为模板,用设计的特异性引物扩增该基因的目的片段。PCR反应体系为:灭菌ddH2O 9.5uL、2×EasyTaqSuperMix 12.5μL、目的基因上下游引物各 1μL、模板 cDNA 1uL,共 25μL。 反应条件为:94℃预变性 5min;94℃变性 1min,55℃退火 45s,72℃延伸 1min,35个循环,72℃保温 10min。 用 1%的琼脂糖凝胶电泳检测获得的PCR产物。根据Magen胶回收试剂盒说明书将目的条带进行回收,与TaKaRa的PMD18-T载体进行连接,转化大肠杆菌,进行PCR鉴定后挑选阳性克隆进行测序。
3‘RACE扩增根据测序得到的玫瑰FLS基因片段序列,设计巢式PCR所需特异性引物:RrFLS-1:5’-TGCTCTTGGTGTGGTTGC-3’;RrFLS-2:5’-AGATGGCCAGTGGTACGAT-3’;B26:5’-GACTCTAGACGACATCGATTTTTTTTTTTTTTTTT-3’。
以cDNA为模板,用巢式PCR特异性引物进行3’端扩增。第一轮PCR:用RrFLS-1和B26做第一轮PCR引物,反应体系同上,反应条件为94℃预变性 5min;94℃ 变 性 1min,55℃ 退 火 30s,72℃ 延 伸45s,35 个循环,72℃保温 10min。 第二轮 PCR:将第一轮产物稀释100、500、700倍作为模板,RrFLS-2和B26做第二轮PCR引物,反应体系同上,反应条件为 94℃预变性 5min;94℃变性 1min,55℃退火30s,72℃延伸 45s,35 个循环,72℃保温 10min。 用1%的琼脂糖凝胶电泳检测获得的PCR产物。根据Magen胶回收试剂盒说明书将目的条带进行回收,与TaKaRa的PMD18-T载体进行连接,转化大肠杆菌,进行PCR鉴定后挑选阳性克隆进行测序。
1.3.2 生物信息学分析
借助NCBI提供的在线Blast进行同源序列的比对;利用DNAMAN对该蛋白与其他植物蛋白进行多重比对分析;利用ExPasy服务器中在线软件ProtParam预测RrFLS蛋白的基本理化性质;利用NCBI中的CD-Search功能预测目的基因的保守域;利用ORFFinder对RrFLS基因cDNA的开放阅读框进行查找;利用在线软件NetPhos3.1server、NetOGlyc4.0server和SignalP4.1,对目的基因编码蛋白磷酸化位点、糖基化位点和信号肽进行预测;利用在线软件TMpred软件预测RrFLS蛋白的跨膜结构域;利用在线软件SOPMA对目的基因编码的蛋白进行二级结构预测;利用MEGA5.0构建FLS系统进化树。
2 结果与分析
2.1 RrFLS基因克隆结果
以玫瑰花瓣cDNA为模板,经过扩增测序得到741bp的RrFLS中间片段 (图1),经过过3’RACE扩增后得到565bp的3’末端序列 (图2),利用DNAstar对两者经过拼接后得到1287bp的cDNA序列全长。利用DNAMAN对RrFLS的碱基序列进行分析,发现其包括完整的开放阅读框(ORF),含有起始密码子ATG和终止密码子TAA,具备长度为1008bp的完整阅读框架(ORF),有polyA尾巴,编码335个氨基酸(图3)。
2.2 RrFLS基因的生物信息学分析
2.2.1 RrFLS基因基本理化性质分析

图1 中间片段的克隆Fig.1 Cloning of intermediate fragments

图 2 3’RACE扩增Fig.2 3’RACE amplification

图3 RrFLS的基因序列及其氨基酸序列Fig.3 RrFLS cDNA nucleotide sequence and the deduced amino acid sequence
根据ProtParam软件对RrFLS蛋白的理化性质预测结果可以看出,RrFLS蛋白的相对分子质量为38018.54Da,理论等电点pI=5.85,该蛋白为酸性。该蛋白不稳定系数为34.10(<40),所以可推测RrFLS蛋白为稳定蛋白。从ProtScale对RrFLS蛋白的疏水性预测结果可看出,RrFLS蛋白疏水性最大值为1.878,最小值为-2.967,平均疏水指数为-0.455,所以推测该蛋白偏亲水。

图4 RrFLS蛋白保守域预测Fig.4 Prcdicts conservative structure domain of RrFLS
根据NCBI的CD-Search功能的结果可以看出,RrFLS基因有一个含有96个氨基酸残基的保守结构域,属2OG-Fe(II)_oxy超级家族(图4)
根据NetPhos 3.1 server的磷酸化位点预测结果可以看出,该蛋白存在8个Ser磷酸化位点,4个Thr磷酸化位点,8个Tyr磷酸化位点。磷酸化位点数量较多,可以说明在RrFLS蛋白中可逆磷酸化调控有重要作用。利用NetOGlyc4.0server预测关键结构基因编码的蛋白质的O糖基化位点,可知在玫瑰FLS中含有3个O糖基化位点,分别位于氨基酸序列的第22位、26位和108位。利用SignalP4.1软件对蛋白质序列信号肽进行分析,可以发现,没有信号肽及其剪切位点在RrFLS基因编码的蛋白中。
根据TMpred软件对RrFLS蛋白的跨膜结构域预测结果可以看出,玫瑰RrFLS蛋白不具有跨膜结构域。
根据SOPMA软件对RrLFS蛋白的二级结构分析结果可知,该蛋白由36.12%的α螺旋、33.13%的随机卷曲、7.46%的β转角和23.28%的延伸链组成(图 5)。

图5 RrFLS蛋白的二级结构图Fig.5 Predication of secondary structure of RrFLS
2.2.2 蛋白序列同源性和进化树分析
用DNAMAN软件对包括玫瑰在内的7种植物的FLS蛋白氨基酸进行多重序列对比,从比对结果(图6)可以看出,FLS在不同植物中保守性非常好,仅N端起始的1~19个氨基酸序列保守性比较差,表明不同物种的FLS的同源性非常高。
利用MEGA5,以包括玫瑰FLS在内的16种植物的氨基酸序列构建系统进化树,可以看出,与玫瑰同科的植物亲缘关系较近,玫瑰与桃最先聚合,说明在以下几种植物中它与桃的亲缘关系最近,与蔷薇、草莓在聚合为一个亚类,说明玫瑰与蔷薇、草莓也有非常近的亲缘关系,与其他科的植物亲缘关系相随比较远(图7)。
3 讨论
FLS基因是植物类黄酮物质合成途径中非常重要的基因,可以催化二氢黄酮醇结构中的C3发生羟基化,形成黄酮醇类化合物[11-15]。因二氢黄酮醇为FLS基因和二氢黄酮醇4-还原酶(DFR)基因的共同底物,所以黄酮醇以及花色苷的合成量与FLS基因表达量有直接联系,因此FLS表达量的高低对花色形成也有重要影响。FLS作为影响花色形成的关键基因,已成功从多种植物分离出来。本研究运用RT-PCR和RACE技术将FLS基因成功从玫瑰花瓣中克隆出来,经生物信息学分析得到,RrFLS基因含1005bp的开放阅读框,编码335个氨基酸,其蛋白的分子式为C1731H2681N443O502S9,相对分子质量为38018.54Da,等电点pI为5.85。该蛋白不稳定系数
为34.10(<40),为稳定蛋白,不存在信号肽和剪切位点。其蛋白质二级结构由36.12%α螺旋、33.13%随机卷曲、7.46%β转角和23.28%延伸链组成。

图6 不同植物FLS蛋白氨基酸序列多重比对Fig.6 Multiple alignment of FLS amino acid sequences from different plants
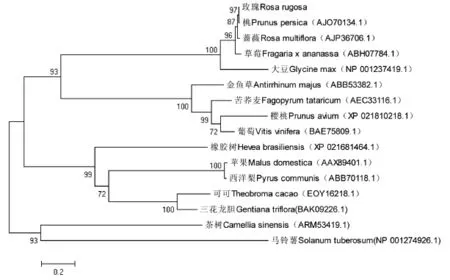
图7 RrFLS与其它物种FLS蛋白系统进化树分析Fig.7 The phylogenetic tree derived from the alignment of amino acid secquences of RrFLS and other FLS
RrFLS基因翻译得到的氨基酸序列经NCBI中Blast比对发现,它与其他植物氨基酸序列同源性较高,为67%~99%,与同科植物桃相比相似程度可达到99%,与蔷薇科许多植物相似度可以到90%以上,以上结果可以说明FLS基因在不同物种之间是相对比较保守的,与前人实验结果相同[16],可为不同科属植物亲缘关系的研究提供理论依据。
Nieslen等[17]利用基因沉默技术抑制FLS基因,使洋桔梗的花色由紫色变为红色,并能稳定遗传。Holton等[4]向烟草中导入反义FLS基因后,检测发现花色苷含量明显升高。以上实验结果都证明了FLS基因可以影响花色的形成。本研究通过对玫瑰花瓣中FLS基因进行分离,并对其进行生物信息学分析,探明了RrFLS的信息,为今后玫瑰花色的改良提供了理论依据。
[1] 杜鹃,吴津蓉,石秀花.玫瑰色素的化学成分研究[J].食品研究与开发,2012,33(04):137-139+143.
[2] Nielsen K,Deroles S C,Markham K R,et al.Antisense flavonol synthasealters copigmentation and flower color in lisianthus[J].Molecular Breeding,2002,(9):217-229.
[3] Ryoji T,Stephen M,Kouta.H,et al.A single-base deletion in soybean flavonol synthase gene is associated with manenta flower color [J].Plant Molecular Biology,2007,63(1):125-135.
[4] Holton T A,Brugliera F,Tanaka Y.Clonning and expression of flavonol synthase from Petunia hybrida[J].Plant J,1992,(4):1003-1010.
[5] 祝婷,苦荞麦黄酮醇合成酶基因Fls的克隆及其花期表达分析[D].四川雅安:四川农业大学,2011.
[6] 黄伟伟.烟草黄酮醇合成酶基因的分离及其序列分析[D].华中科技大学,2007.
[7] 马春雷.茶树查尔酮异构酶、黄酮醇合成酶和无色花色素还原酶等基因的克隆与表达分析[D].中国农业科学院,2007.
[8] 乔中全.金银花 chs、fls、chi基因全长克隆及序列分析[D].中南林业科技大学,2012.
[9] Zhou X W,Fan Z Q,Chen Y,et al.Functional analysis of a flavonol synthase-like gene from Camellia nitidissima reveal its roles in flavonoid metabolism during floral pigmentation[J].J Biosci,2013,(3):593-604.
[10] 张玲,徐宗大,汤腾飞,张辉,赵兰勇.‘紫枝’玫瑰(Rosa rugosa‘Zi zhi’)开花过程花青素相关化合物及代谢途径分析[J].中国农业科学,2015,48(13):2600-2611.
[11] Forkmann G,Marten S.Metabolic engineering and application offlavonoids [J].CurrOpin Biotechnol,2001,12(2):354-360.
[12] 乔小燕,马春雷,陈亮.植物类黄酮生物合成途径及重要基因的调控 [J].天然产物研究与开发,2009,21(02):354-360+207.
[13] Winkel-Shirley B.Biosynthesis offlavonoids and effect of stress[J].Curr Opin Plant Biol,2002,(5):218-223.
[14] Ferrey M,Rius S P,Casati P.Flavonoids:biosynthesis,biological functions,and biotechnological application[J].Pront Plant Sci,2013,(4):14950-14973.
[15] Petrussa E,Braidot E,Zancani M,et al.Plant Flavonoids-biosynthesis,transport and involvement in stree responses[J].Int J Mol Sci,2013,14:14950-14973.
[16] Forkmann G,Marten S.Metabolic engineering and applicationsofflavonoids [J].CurrOpin Biotechnol,2001,12(2):155-160.
[17] Nielsen K,Deroles S C,Markham K R,et al.Antisense flavonol synthasealters copigmentation and flower color in lisianthus[J].Molecular Breeding,2002,(9):217-229.
