气相色谱法测定水产品中4种三唑类农药残留
2018-07-05余颖
余 颖
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门361013)
三唑类农药是一类含有1,2,4-三唑环的有机含氮杂环化合物,是20世纪70年代发展起来的一种杀菌剂,主要产品有三唑醇、烯唑醇、己唑醇、三唑酮、丙环唑和氟硅唑等30多个品种。这类农药的化学结构式上相同的部分是主链上含有羟基(酮基)、取代苯基和1,2,4-三唑基团化合物。三唑类农药具有内吸杀菌活性、广谱、高效和低毒等特点,有的还具有植物生长调节作用。同时,它的一些特殊理化性质也使其具有长期有效和活性高的特性[1-3]。农药通过地表径流、淋溶、沉降等方式进入渔业环境,对渔业环境和水产养殖造成间接或直接的危害。人类食用被农药污染的水产品,就有可能致畸、致癌、诱变,以及对神经系统产生影响和引起免疫系统的过敏反应等[4]。
国内外常用的三唑类农药检测方法主要有以下几类:1)液相色谱法,主要有分散液相微萃取-高效液相色谱法[5-6]、分子印迹固相萃取-高效液相色谱法[7-9]等;2)液相色谱-质谱联用法,如超高效液相色谱-串联质谱法[10-12]、分子印迹固相萃取-液相色谱-质谱法[13]、QuEChERS-高效液相色谱-串联质谱法[14]等;3)气相色谱法[15-17];4)气相色谱-质谱联用法,如中空纤维膜液相微萃取-GC-MS法[18]、凝胶渗透色谱-气相色谱-串联质谱法[19]、分散液-液微萃取-气质联用法[20-21]、气相色谱-负化学离子源质谱法[22]等。三唑类农药残留检测方法研究已在水质、果蔬等基质中广泛开展,但在动物源基质中的研究鲜有报道,水产品中三唑类农药多组分残留的检测方法研究尚处空白。本研究采用微电子捕获检测器的气相色谱法进行检测,建立了水产品中4种三唑类农药残留量的检测方法。微电子捕获检测器的气相色谱法具有较高的灵敏度,不仅能够满足水产品中三唑类农药痕量残留检测的需求,也为三唑类农药相关标准的制定及其日常监管提供技术支持。
1 材料与方法
1.1 主要仪器与试剂
气相色谱仪(美国Agilent公司,6890N,带63Ni微电子捕获检测器);离心机(北京时代北利离心机有限公司,LD4-8);氮吹仪(天津恒奥科技发展有限公司,HGC-24);旋涡振荡器(德国IKA公司,MS3);旋转蒸发仪(上海申生科技有限公司,R205);固相萃取装置(美国Alltech公司);数控超声波清洗器(昆山市超声仪器有限公司,KQ-250DE)。
乙腈、丙酮、正己烷为色谱纯;无水硫酸钠(650℃灼烧4 h,冷却后贮于干燥器中备用)为分析纯;石墨化碳黑-弗罗里硅土复合柱(CNW,1 000 mg/250 mg/6 mL)。
标准物质三唑酮、三唑醇、联苯三唑醇和环丙唑醇购于德国Dr.Ehrenstorfer公司,分别用丙酮配制成10 μg/mL的标准溶液,储存于4℃冰箱中,使用时再用丙酮配制成所需浓度的混合标准工作液。
1.2 样品前处理方法
1.2.1 试样制备
取待测水产品的可食部分,并充分均质、混匀;将试样于-18℃以下冷冻保存备用。
1.2.2 提取
称取5 g样品(精确至0.01 g)置于50 mL离心管中,加入15 mL乙腈,旋涡振荡30 s,超声提取10 min。3 500 r/min离心5 min,移取上清液过无水硫酸钠后收集于100 mL鸡心瓶中。再往样品中加入10 mL乙腈重复提取一次,合并上清液于100 mL鸡心瓶中,40℃旋转蒸发至近干。用1 mL正己烷溶解鸡心瓶中的残留物,待净化。
1.2.3 净化
石墨化碳黑-弗罗里硅土柱用5 mL正己烷,5 mL丙酮-正己烷(1∶9,V/V)溶液活化,样液过柱并收集,用12 mL丙酮-正己烷(1∶9,V/V)溶液洗脱,收集洗脱液。将洗脱液于40℃氮吹至近干,用正己烷定容至1 mL,供气相色谱分析。
1.3 分析条件
色谱柱:DB-5MS(30 m×0.25 mm×0.25 μm);升温程序:起始温度150℃,保持1 min,以15℃/min升到280℃保持5 min,再以20℃/min升到300℃保持3 min;进样口温度:280℃,进样方式:不分流进样,进样体积为1 μL;检测器温度:300℃;载气:高纯氮气(纯度≥99.999%),流速1.0 mL/min。
2 结果与讨论
2.1 气相色谱分析条件优化
已报道的三唑类农药的气相色谱分析方法中,色谱柱通常采用弱极性的DB-1MS[17]或DB-5MS[18]和中等极性的DB-17MS[22]。本研究比较了DB-5MS和DB-17MS这两种色谱柱对4种三唑类农药的响应值及分离效果。结果表明,2种色谱柱都能将4种目标物完全分离,但采用DB-5MS色谱柱可获得响应值更高的目标峰且峰型尖锐对称,对目标物的定性与定量更加准确。进样口温度是对目标物响应值有较大影响的条件之一,本研究在前期研究的基础上确定进样口温度为280℃,可在不引起样品分解的情况下,使样品全部组分完全汽化,以获得最佳响应值。按1.3已优化的分析条件,4种三唑类农药混合标准溶液(三唑酮浓度为2.5 ng/mL,三唑醇、联苯三唑醇和环丙唑醇浓度为50.0 ng/mL)的色谱图见图1。
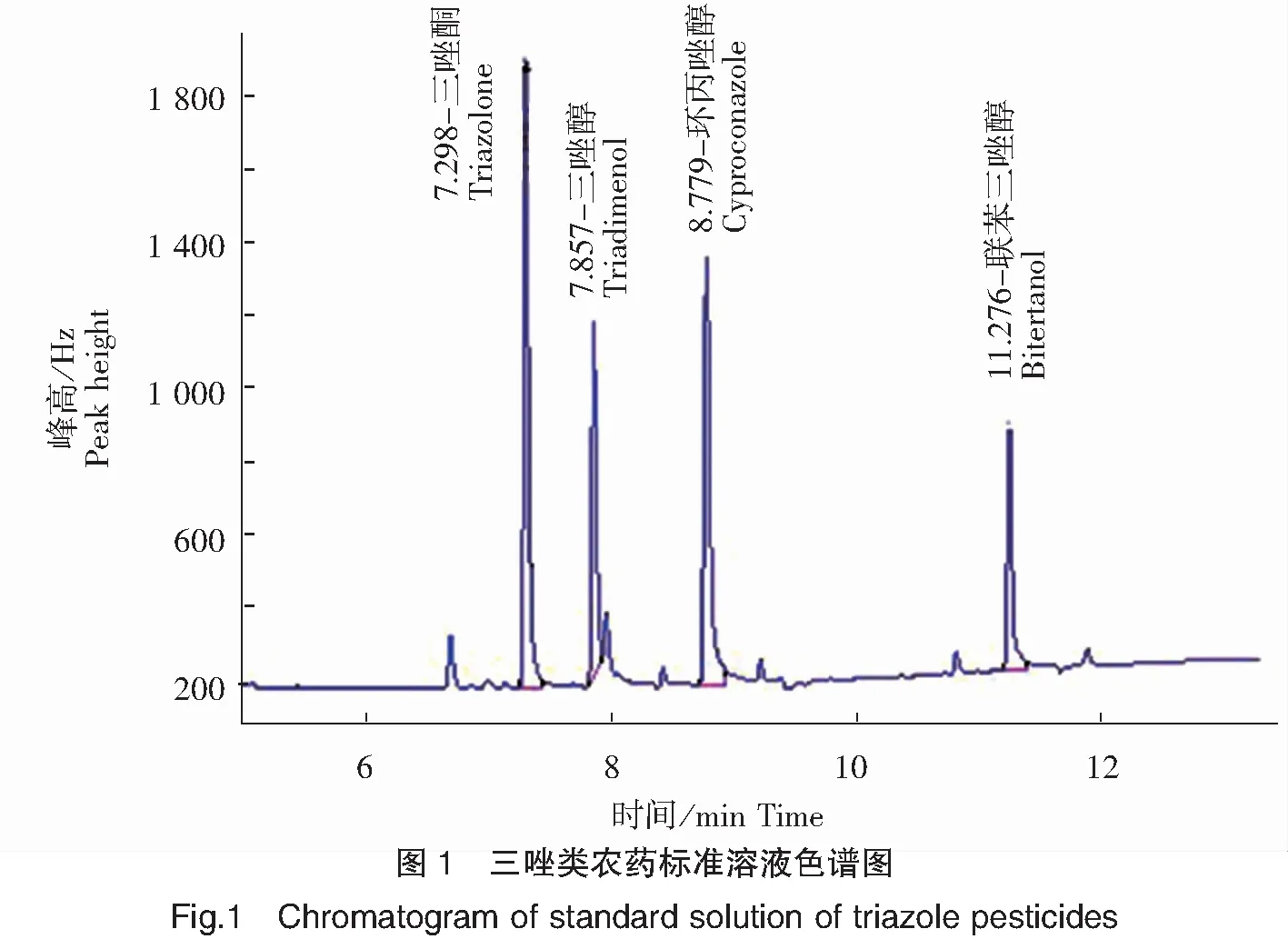
2.2 样品前处理方法的研究
2.2.1 提取溶剂的选择
水产品中含有较多的蛋白质、油脂和色素等物质,基质比较复杂,为了降低后续样品净化的难度,应选择对目标物溶解性好且对杂质溶出尽可能小的溶剂。已报道的研究常采用乙酸乙酯、乙腈、正己烷、石油醚或丙酮等作为提取溶剂。本研究比较了乙酸乙酯、乙腈和正己烷对4种三唑类农药的提取效果,结果见图2。乙酸乙酯对4种目标物的提取率无法都达到满意的效果,且杂质峰较多,基线噪音大,对目标物的准确定性和定量造成干扰。乙腈的提取效果优于正己烷,且正己烷对油脂及色素的溶解度也较大,会增加后续净化的难度。因此选择乙腈为提取溶剂,可获得较满意的提取效果。
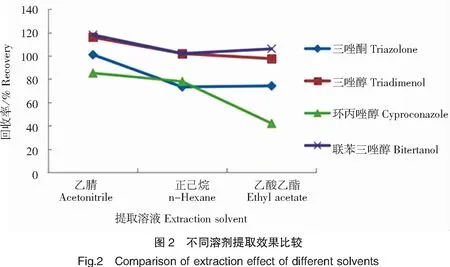
2.2.2 净化方法
由于水产品基质的复杂性会干扰三唑类农药的定性定量分析,并对色谱柱及检测器造成污染,且乙腈会使蛋白质变性造成提取液浑浊,因此有必要对乙腈提取液进行有效净化。固相萃取是已报道的较常用的三唑类农药提取液的净化方式。固相萃取不仅能对复杂样品基质进行有效净化,还可富集样品中的极低浓度组分,并减少色谱应用中的基质效应,在水产品痕量残留的检测中得到广泛应用。由于弗罗里硅土柱是三唑类农药残留检测中较常用的固相萃取柱,其对目标物各组分的回收率高,且能有效去除杂质,使杂质峰与目标峰完全分离,而且部分含有色素的水产品如甲壳类、某些贝类等,石墨化碳黑能较好地吸附色素,使净化效果更理想,因此本研究采用石墨化碳黑-弗罗里硅土复合柱对乙腈提取液进行净化,进一步去除杂质,能满足检测分析要求。
1)洗脱液的选择
本研究比较了不同体积比的丙酮-正己烷溶液对4种三唑类农药的洗脱效果。分别比较了体积比为1∶9、3∶7、5∶5这3种溶液,结果见图3,丙酮-正己烷溶液体积比为1∶9时,固相萃取柱上的待测组分基本能洗脱下来,回收率高于另两种体积比的溶液,能满足检测要求。

注:1为丙酮-正己烷(1∶9,V/V);2为丙酮-正己烷(3∶7,V/V);3为丙酮-正己烷(5∶5,V/V)。
Notes:1 indicated acetone-n-hexane(1∶9,V/V);2 indicated acetone-n-hexane(3∶7,V/V);3 indicated acetone-n-hexane(5∶5,V/V).
2)洗脱体积的优化
确定洗脱液之后,对洗脱液体积进行优化,使目标物能从固相萃取柱上完全洗脱下来。将5 g空白样品按1.2.2法提取,提取液加入4种三唑类混合标准溶液(三唑酮浓度为25 ng/mL,三唑醇、联苯三唑醇和环丙唑醇浓度为500 ng/mL),浓缩液过石墨化碳黑-弗罗里硅土复合柱,用丙酮-正己烷(1∶9,V/V)溶液洗脱,收集不同体积的洗脱液,测定各目标物的回收率。结果见图4,在洗脱体积为12 mL时,目标物各组分可完全被洗脱。

按优化后的样品前处理方法所得的日本对虾空白样品和加标样品(添加浓度分别为三唑酮0.4 μg/kg,三唑醇、联苯三唑醇和环丙唑醇8.0 μg/kg)色谱图见图5~图6。结果表明,该方法前处理过程步骤少易操作,有机试剂用量少,样品净化效果较理想,适用于大量样品的快速检测。


2.3 方法有效性的评价
2.3.1 线性范围、检出限和最低定量限
将4种三唑类农药标准储备液用丙酮配制成不同质量浓度的系列标准混合溶液,浓度分别为三唑酮1.25、2.50、25.00、62.50、125.00 ng/mL,三唑醇、环丙唑醇和联苯三唑醇25、50、500、1 250、2 500 ng/mL,进行气相色谱分析,外标法定量。以标准溶液质量浓度为横坐标,峰高为纵坐标,绘制标准曲线,计算相关系数。方法检出限是以信噪比≥3估算,三唑醇、环丙唑醇和联苯三唑醇检出限均为4.0 μg/kg,三唑酮的检出限为0.2 μg/kg。最低定量限的确定依据实际样品加标回收率在70%~120%之间,信噪比≥10,相对标准偏差≤15%时所对应的浓度值。实验中4种三唑类各组分加标浓度分别为三唑酮0.4 μg/kg,三唑醇、环丙唑醇和联苯三唑醇8 μg/kg时,平均回收率为83.6%~86.6%,相对标准偏差为2.77%~10.7%,且信噪比大于10。因此,本方法确定三唑酮的最低定量限为0.4 μg/kg,三唑醇、联苯三唑醇和环丙唑醇的最低定量限均为8.0 μg/kg。各组分的线性回归方程、相关系数、检出限和最低定量限见表1,三唑酮在1.25~ 125.00 ng/mL,三唑醇、联苯三唑醇和环丙唑醇在25~2 500 ng/mL范围内线性关系良好,相关系数为0.999 7~0.999 8。

表1 4种三唑类农药的线性回归方程、相关系数、检出限和最低定量限
2.3.2 方法的准确度和精密度
按1.2所述方法,分别在鳗鲡、日本对虾、鲍鱼及龙须菜空白样品中添加不同浓度的三唑类混合标准溶液进行加标回收试验,添加浓度分别为三唑酮0.4 μg /kg、4.0 μg/kg、8.0 μg /kg,三唑醇、联苯三唑醇和环丙唑醇8 μg/kg、80 μg/kg、160 μg/kg,每个浓度水平重复6次。为了验证方法的再现性,又进行了这三个浓度水平的日间加标回收试验。结果分别见表2~表3,日内平均回收率为78.8%~94.0%,相对标准偏差为1.48%~11.4%;日间平均回收率为79.1%~95.0%,相对标准偏差为1.92%~9.12%,均符合药残检测技术要求。

表2 加标样日内平均回收率和相对标准偏差
表3 加标样日间平均回收率和相对标准偏差
3 结论
本研究建立了水产品中4种三唑类农药三唑酮、三唑醇、联苯三唑醇和环丙唑醇残留的气相色谱检测方法。样品选用乙腈作为提取液,石墨化碳黑-弗罗里硅土复合柱进行固相萃取,使样品中蛋白质、油脂和色素等杂质得到有效净化,前处理过程步骤少,缩短了样品检测周期,试剂用量少,检测成本低,适合批量样品的快速检测。本研究对色谱分析条件进行了优化,提高仪器对目标物的响应,建立的分析方法灵敏度、准确度和精密度均符合药残检测技术要求,可应用于水产品中三唑类农药残留的日常检测。
参考文献:
[1]蔡智华,郭正元.三唑类杀菌剂的研究进展[J].农化新世纪,2006,(3):17-18.
[2]王佳韵,张一宾.全球三唑类杀菌剂的市场概况及发展趋势[J].农药,2017,(2):30-31.
[3]周子燕,李昌春,高同春,等.三唑类杀菌剂的研究进展[J].安徽农业科学,2008,36(27):11842-11844.
[4]张会芳.气相色谱-串联质谱法测定蔬菜水果中18种三唑类杀菌剂残留的研究[D].郑州:郑州大学,2012.
[5]胡楠,伍心妮,王和平,等.分散液相微萃取-高效液相色谱法测定三唑类衍生物[EB/OL].[2012-07-01][2018-06-05]/.http://www. cnki. net/KCMS/detail/detail.aspx? QueryID=1&CurRec=2&filename=HNHX20120700139&dbname=CPFD09 14&dbcode=CPFD&pr=&urlid=&yx=&v=MzE2NjRadTV2RUNuaFU3dk5KMTRVTFRVTFNQ RGRyRzRIOVBNcUk5Rlp1Z0dDQk5LdWhkaG5qOTh UbmpxcXhkRWVNT1VLcmim.
[6]张敏,黄其亮,殷帅,等.基于离子液体的分散液相微萃取-高效液相色谱法测定水中三唑类农药[J].华中农业大学学报,2012,21(3):341-345.
[7]胡静,吴晓燕,高文惠.分子印迹固相萃取-高效液相色谱法分析2种三唑类杀菌剂残留[J].药物分析杂志,2012,(6):1043-1047.
[8]赵春娟,庞军,高文惠.分子印迹固相萃取-高效液相色谱法分析食品中3种三唑类杀菌剂残留[J].中国食品学报,2015,15(3):175-180.
[9]高文惠,王姣姣.分子印迹固相萃取膜-高效液相色谱法检测粮谷中的三唑类杀菌剂[J].现代食品科技,2014,30(12):225-229.
[10]王菲,李彤,马辰.超高效液相色谱-串联质谱法测定中药材中三唑类杀菌剂及三嗪类除草剂的残留量[J].色谱,2013,31(3):191-199.
[11]Beste K Y,Burkhardt O,Kaever V.Rapid HPLC-MS/MS method for simultaneous quantitation of four routinely administered triazole antifungals in human plasma [J].Clinica Chimica Acta,2012,413(1-2):240-245.
[12]Raina R,Smith E.Determination of azole fungicides in atmospheric samples collected in the canadian prairies by LC/MS/MS [J].Journal of Aoac International,2012,95(5):1350-1356.
[13]胡艳云,徐慧群,姚剑,等.分子印迹固相萃取-液相色谱-质谱法测定果蔬中20种三唑类农药残留[J].分析化学,2014,42(2):227-232.
[14]孙星,丁悦,汪佳蕾,等.QuEChERS-高效液相色谱-串联质谱法测定果蔬中多效唑残留[J].食品科学,2014,35(8):76-79.
[15]刘红梅,李文英,黎小鹏,等.全自动索氏提取-气相色谱法检测小麦粉中菊酯、取代苯类、三唑类农药残留[J].广东农业科学,2012,39(12):93-95.
[16]吴俐,陈铭学,牟仁祥,等.植物源食品中6种三唑类杀菌剂残留量的气相色谱法测定[J].分析测试学报,2009,28(7):846-848,854.
[17]徐颖洁.SPE-GC-μECD测定蔬菜中6种三唑类农药的残留量[J].安徽农业科学,2014,42(18):5813-5815.
[18]陈丽华,张丽君,张磊,等.中空纤维膜液相微萃取-GC-MS测定水果和蔬菜中三唑类杀菌剂残留量[J].光谱实验室,2011,28(1):413-418.
[19]李继革,王玉飞,施家威,等.分散液-液微萃取-气质联用法同时测定水中13种三唑类杀菌剂[J].中国卫生检验杂志,2013,(6):1345-1349.
[20]贾楠.凝胶渗透色谱-气相色谱-串联质谱法测定农产品中18种三唑类杀菌剂残留的研究[D].郑州:郑州大学,2013.
[21]Farajzadeh M A,Djozan D,Mogaddam M R,et al.Extraction and preconcentration technique for triazole pesticides from cow milk using dispersive liquid-liquid microextraction followed by GC-FID and GC-MS determinations[J].Journal of separation science,2011,34(11):1309-1316.
[22]沈伟健,桂茜雯,余可垚,等.气相色谱-负化学离子源质谱测定大豆和玉米中12 种三唑类杀菌剂的残留量[J].色谱,2009,27(1):91-95.
