轻度认知功能障碍患者血小板脂质筏内胆固醇水平的研究
2018-07-04王金春曹云鹏
刘 丽, 张 可, 王金春, 曹云鹏
轻度认知功能障碍(mild cognitive impairment,MCI)是指记忆力或其它认知功能进行性减退,但不影响日常生活能力,且未达到痴呆的诊断标准,是一种介于正常衰老与痴呆之间的认知功能障碍[1]。MCI患者是阿尔茨海默病(Alzheimer’s disease,AD)发病的高危人群。Petersen等的纵向临床研究表明,MCI以每年10%~15%转化率,高风险地转化为痴呆[2]。即使MCI的受试者认知在某一时间点转归正常,后来发展为MCI或AD的概率仍高于认知功能正常的人[3]。因此,早期诊断和识别MCI对延缓AD发生发展有重要意义。
目前,阿尔茨海默病(Alzheimer’s disease,AD)的确切病因和发病机制尚不清楚,但β淀粉样蛋白(Aβ)在脑组织中的大量沉积被认为是AD病理机制的核心所在,是AD发病的始动环节。脂质筏为膜脂双层内含有特殊脂质和蛋白的微区,富含胆固醇和鞘脂。近年研究表明脂质筏在AD的病理发生及发展过程中发挥重要作用,参与Aβ致AD发病的全过程[4],而MCI为AD的前期状态,所以本研究检测轻度认知功能障碍患者血小板脂质筏内胆固醇水平变化并进行相关性研究,探讨其在MCI诊断中的应用价值,旨在寻找MCI的外周血标记物来帮助尽早的诊断MCI,将有助于早期识别AD的高危人群,并对探索有效的治疗策略以延缓AD病情进展有重要意义。
1 资料和方法
1.1 研究对象
1.1.1 MCI组 2014年6月-2017年12月于神经内科诊治的MCI患者,所有患者均进行MMSE、蒙特利尔认知评估量表(MoCA)、日常生活能力量表、临床痴呆评定量表、Hachinski缺血量表和汉密顿抑郁量表评分评定,均符合Peterson制订的MCI诊断标准和美国精神障碍诊断与统计手册第4版(DSM-IV)有关MCI的诊断标准。
1.1.2 AD组 2014年6月-2017年12月于神经内科诊治的AD患者,所有患者均进行MMSE、蒙特利尔认知评估量表、日常生活能力量表、临床痴呆评定量表、Hachinski缺血量表和汉密顿抑郁量表评分评定,均符合美国国立神经病及语言障碍和卒中研究所-AD和相关疾病学会(NINDS-ADRDA)制定的“很可能AD”的诊断标准。
1.1.3 对照组 对照组来自同期体检中心的健康体检者,均经MMSE评分、蒙特利尔认知评估量表、Hachinski缺血评分证实无明显记忆障碍,无认知、社交及生活能力受损,无痴呆家族史。
1.1.4 排除标准 (1)脑卒中(包括既往严重脑梗死、脑出血等病史,急性脑卒中);(2)可导致认知功能下降的神经系统疾病;(3)影响中枢神经系统功能的内科疾病;(4)具有精神疾病病史,严重抑郁导致的假性认知障碍;(5)酒、药物依赖史,曾服用改善认知及抗抑郁的药物;(6)近期服用过降脂药及抗血小板聚集类药物的患者。
1.1.5 该试验得到我院伦理委员会的批准,并且所有受试者或其家属均书面签署了知情同意书。
1.2 研究方法
1.2.1 血小板的分离 空腹静脉抽取全血20 ml,柠檬酸钠抗凝,200×g室温离心15 min,小心抽取富含血小板的血浆层,2000×g室温离心15 min,弃上清。
1.2.2 血小板脂质筏的制备[5]将血小板(1×109)用1 ml 4℃预冷的裂解缓冲液(1% Triton X-100,25 mmol Mes,150 mmol Nacl,1×Protease inhibitor cocktail,pH 6.5)溶解,冰上裂解30 min。向细胞裂解物中加入2 ml 60%的Optiprep,使其终浓度为40%,将其放入超速离心管底部,上层依次覆盖30%、25%、5%、0%的Optiprep,200000×g于4 ℃超速离心5 h,从上到下依次收集离心样品10份,每份约1 ml。
1.2.3 脂质筏的鉴定 根据Shrimpton等[5]的方法,将离心后收集的10层样品点样于硝酸纤维素膜上,自然晾干,将此硝酸纤维素膜于含5%BSA的PBST中室温封闭1 h。倾去封闭液,加入含1 μg/ml辣根过氧化物酶标记的霍乱毒素β亚基的PBST,4 ℃孵育过夜。倾去孵育液,用PBS洗膜3次,每次10 min。加入1 ml混合ECL发光试剂盒中的液体,铺在LAS3000 mini化学发光成像仪中,采集图像。
1.2.4 血小板脂质筏内胆固醇含量测定 根据Amplex red cholesterol assay kit试剂盒(美国Invitrogen公司)提供的标准步骤进行。
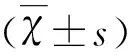
2 结 果
2.1 3组受试者的一般资料 MCI组51例,男25例,女26例,平均年龄(66.67±1.51)岁。AD组40例,男19例,女21例,平均年龄(66.95±1.63)岁。对照组52例,男24例,女28例,平均年龄(65.65±1.38)岁。3组在年龄、性别和受教育程度构成方面差异无统计学意义,具有可比性。MCI组和AD组的MoCA总分、MMSE评分均低于对照组,差异有统计学意义(P<0.01)。AD组的MoCA总分、MMSE评分均低于MCI组,差异有统计学意义(P<0.01)。血浆总胆固醇、甘油三酯、高密度脂蛋白及低密度脂蛋白水平在3组之间无差异(见表1)。
2.2 脂质筏的鉴定 离心完成后,光照情况下在离心管内Optiprep 25%~30% 交界面处可见一条白色的闪亮的环带,即为脂质筏。点印迹法检测的结果亦表明(见图1),仅第6层中含有GM1,肉眼所见的处于25%~30%密度梯度离心界面的白色环带即在第6层中,因此第6层中的环带部分就是我们所需制备的脂质筏。
2.3 MCI组、AD组和对照组的血小板脂质筏内胆固醇水平的比较 MCI组和AD组血小板脂质筏内胆固醇水平分别为(20.65±1.22)μg/ml和(25.68±1.93)μg/ml,均高于对照组(16.11±1.01)μg/ml,差异有统计学意义。MCI组血小板脂质筏内胆固醇水平低于AD组,差异有统计学意义(见表1)。
2.4 MCI组、AD组血小板脂质筏内胆固醇水平与认知功能评分的相关性分析 血小板脂质筏内胆固醇水平与年龄、外周血总胆固醇含量无相关性(P>0.05)。对照组血小板脂质筏内胆固醇水平与MoCA、MMSE评分无相关性(P>0.05)。MCI组血小板脂质筏内胆固醇水平与MoCA总分(r=-0.378,P=0.006)及MoCA评分中的延迟回忆(r=-0.296,P=0.035)、注意力和计算力(r=-0.276,P=0.046)、视空间与执行功能(r=-0.294,P=0.037)亚项呈显著负相关,与MoCA评分中的命名(r=-0.005,P=0.972)、语言能力(r=-0.048,P=0.73)、抽象力(r=-0.003,P=0.983)、定向力(r= -0.111,P=0.439)亚项无相关性。AD组血小板脂质筏内胆固醇水平与MMSE总分(r=-0.198,P=0.221)及MMSE评分中的定向力(r=-0.175,P=0.281)、即时记忆力(r=-0.011,P=0.948)、注意力和计算力(r=-0.106,P=0.513)、语言能力(r=-0.118,P=0.467)亚项无相关性,与MMSE评分中的回忆能力(r=-0.337,P=0.033)呈显著负相关。

表1 患者的一般资料
与对照组相比*P<0.05,**P<0.01;与MCI组相比#P<0.05,##P<0.01

图1 点印迹法证实,仅离心后的第6份样品中含GM1,说明处于25%~30%密度梯度离心界面,即第6份样品中的白色环带为脂质筏
3 讨 论
轻度认知功能障碍(MCI)平均每年痴呆转化率约10%~15%,明显高于正常人,已被公认为正常老化与痴呆间的过度状态,是AD的重要危险因子[2,6],因此,MCI的早期诊断和治疗是延缓和预防AD发生的关键。目前MCI的诊断主要依赖于各种神经心理量表检查,但神经心理测试可受多种因素影响,如年龄、文化背景及受教育程度等,在认知功能的早期阶段,量表的敏感性和特异性也有较大限制。近年来尽管脑脊液Aβ和tau蛋白已成为最为公认的诊断MCI的生物标记物[7],但因脑脊液采集的复杂性和风险性,使其临床应用受到很大的限制。本研究探讨血小板脂质筏内胆固醇水平与MCI的关系,以期寻找到对MCI诊断有辅助作用的外周血生物学标记物,为其早期干预治疗提供科学依据。
目前研究表明,Aβ在脑组织沉积是MCI患者最先出现的异常病理改变,其可通过脑脊液或PET技术检测出来,并且从Aβ过度沉积到出现临床症状可间隔10 y[8]。Andreasen等研究发现,MCI患者脑脊液Aβ42水平介于AD和正常对照之间[9],通过多中心大样本的研究表明,与稳定的MCI相比,发展为AD的MCI患者的平均Aβ42水平更低[7]。Aβ来自于淀粉样前体蛋白(amyloid precursor protein,APP),通过β和γ分泌酶作用于APP,产生各种长度Aβ片段和一个较小的碳末端片段(CTFγ)[10]。近来研究表明脂质筏与AD的病理发生及发展过程密切相关,脂质筏为膜脂双层内含有特殊脂质和蛋白的微区,富含胆固醇和鞘脂,其内含有APP、β分泌酶、γ分泌酶及Aβ[11]。目前研究发现,APP经β分泌酶降解形成Aβ的过程在脂质筏区进行,而经α分泌酶降解的非淀粉样蛋白生成途径在细胞膜的非脂质筏区进行[10]。脂质筏不仅参与Aβ的生成,其在Aβ聚集形成低聚体及Aβ低聚体与神经元上的受体相结合而致病等过程中同样发挥重要作用[12]。
胆固醇为脂质筏内的重要成分,主要通过影响脂质筏的结构及调节与Aβ生成密切相关的3种蛋白(APP、β分泌酶和γ分泌酶)在脂质筏内的分布来促进Aβ的生成[13]。脂质筏很小,在正常情况下,APP和β分泌酶可能存在于脂质筏内,也可能存在于磷脂区,而且即使位于脂质筏区,APP和β分泌酶也不可能同时存在于同一脂质筏内。脂质筏需要经过胞吞而聚集在一起,使APP和β分泌酶相互接触。当胆固醇水平升高时,脂质筏的数目及体积均增大,含脂质筏的质膜相对增多,APP及β分泌酶位于同一脂质筏内的可能性就会增大,进而使Aβ生成增多[14]。Kosicek等观察到,胆固醇蓄积使APP移入脂质筏,进而增加APP在脂质筏内经淀粉样蛋白生成途径的降解,促进Aβ生成[13]。与Kosicek的研究结果相一致,Ehehalt等亦证实,去除胆固醇可减少APP分隔进入脂质筏,进而阻止其与β分泌酶及γ分泌酶的相互接触,抑制β分泌酶对APP的裂解和Aβ的生成。而且,当存活的海马神经元的胆固醇水平下降达70%时,其内Aβ的生成将完全停止[14]。此外,胆固醇与Aβ的聚集及毒性作用密切相关。Kakio等发现质膜外层胆固醇的增高可加速Aβ的聚集。相反,移除胆固醇后,细胞可抵抗Aβ对其毒性作用[15]。Schneider等研究发现,从AD患者脑内海马神经元的脂质筏中分离得到的Aβ低聚体具有胆固醇依赖性,去除胆固醇可使Aβ聚集减少[16]。最新研究表明,GAβ,作为AD早期的病理改变[17],是神经节苷脂GM1在脂质筏内结合Aβ形成,其如同“种子”一样启动并加速Aβ的聚集[18]。Fantini等研究发现,神经节苷脂GM1与Aβ的结合具有胆固醇依赖性,脂质筏内胆固醇通过氢键驱动构象效应作用于神经节苷脂GM1的糖基,进而促进神经节苷脂GM1与Aβ结合形成GAβ[19]。
目前,关于MCI的胆固醇水平的相关研究结果说法不一[20~22],同样有关AD患者脑总胆固醇含量的改变情况存在争议。但Gibson Wood等研究认为,神经细胞膜脂质双分子层外层内胆固醇水平的持续升高在AD的发病过程中起重要作用[23]。因此,与血及脑总胆固醇含量的改变相比,位于脂质双分子层外层的脂质筏内胆固醇含量的变化可能与AD的发病更为密切相关。我们的研究亦表明外周血血小板脂质筏内胆固醇含量与外周血总胆固醇水平无相关性,可见,外周血血小板脂质筏内胆固醇水平异常可能更具特异性。
人类血小板内含有APP及所有APP加工形成Aβ过程中所需的酶,其不但可用于研究AD和MCI患者APP 处理加工和Aβ代谢途径,还可以用来研究AD和MCI的凋亡途径和认知功能。因此血小板很有可能成为AD和MCI诊断的合适的外周标记物来源[24]。本研究中,我们检测外周血血小板脂质筏内胆固醇水平,发现MCI组血小板脂质筏内胆固醇水平高于对照组,低于AD组,两两比较差异有统计学意义,表明血小板脂质筏内胆固醇水平可能是MCI的生物学标志物指标之一。AD组血小板脂质筏内胆固醇水平较对照组明显增高,具有统计学意义,提示血小板脂质筏内胆固醇水平检测对AD的诊断具有重要的意义。我们对血小板脂质筏内胆固醇水平与MCI、AD患者的认知功能进行了相关性分析,MCI组血小板脂质筏内胆固醇水平与MoCA总分及MoCA评分中的延迟回忆、注意力和计算力、视空间与执行功能亚项呈显著负相关,说明脂质筏内胆固醇参与了认知损害的致病过程,血小板脂质筏内胆固醇水平升高是早期轻度认知功能受损的重要表现,其水平的高低在一定程度上能够反映MCI患者认知功能障碍的程度。MCI组和AD组血小板脂质筏内胆固醇水平均与神经心理量表中的延迟回忆(回忆能力)呈显著负相关,说明血小板脂质筏内胆固醇水平变化在一定程度上与MCI和AD早期最常见的临床表现相一致,血小板脂质筏内胆固醇水平有望成为MCI和AD早期诊断的生物标记物。
综上所述,检测外周血血小板脂质筏内胆固醇水平对早期诊断MCI患者具有一定的临床应用价值,有望成为MCI和AD早期诊断和病情评估的重要生物学标记物。当然,外周血血小板脂质筏内胆固醇水平检测对MCI的诊断价值尚缺乏大样本多中心数据支持,在后续的研究中,将尽量扩大样本量,减少偏倚,以便进一步证实血小板脂质筏内胆固醇水平与MCI之间真正存在相关性。
[参考文献]
[1]Peter RC.Clinical practice.Mild cognitive impairment[J].N Engl J Med,2011,364(23):2227-2234.
[2]Peter RC,Roberts RO,Knopman DS,et al.Mild cognitive impairment:ten years later[J].Arch Neurol,2009,66(12):1447-1455.
[3]Roberts RO,Knopman DS,Mielke MM,et al.Highter risk of progression to dementia in mild cognitive impairment cases who revert to normal[J].Neurology,2014,82(4):317-325.
[4]Rushworth JV,Hooper NM.Lipid rafts:linking Alzheimer’s amyloid-β production,aggregation,and toxicity at neuronal membranes[J].Int J Alzheimers Dis,2011,2011:603052.
[5]Shrimpton CN,Gousset K,Tablin T,et al.Isolation and analysis of platelet lipid rafts[J].Methods Mol Biol,2004,273:213-228.
[6]Singh B,Parsaik AK,Mielke MM,et al.Association of Mediterranean diet with mild cognitive impairment and Alzheimer’s disease:a systematic review and meta-analysis[J].J Alzheimer’s Dis,2014,39(2):271-282.
[7]Albert MS,Dekosky ST,Dickson D,et al.The diagnosis of mid cognitive impairment due to Alzheimer’s disease:recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J].Alzheimers Dement,2011,7(3):270-279.
[8]Sperling RA,Aisen PS,Beckett LA,et al.Toward defining the preclinical stages of Alzheimer’s disease:recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J].Alzheimers Dement,2011,7(3):280-292.
[9] Andreasen N,Minthon L,Vanmechelen E,et al.Cerebrospinal fluid tau and Abeta42 as predictors of development of Alzheimer’s disease in patients with mild cognitive impairment[J].Neurosci Lett,1999,273(1):5-8.
[10]Ohno-Iwashita Y,Shimada Y,Hayashi M.Plasma membrane microdomains in aging and disease[J].Geriatr Gerontol Int,2010,1:S41-52.
[11]Ariga T.The Pathogenic role of ganglioside metabolism in Alzheimer’s disease-cholinergic neuron-specific gangliosides and neurogenesis[J].Mol Neurobiol,2017,54(1):623-638.
[12] Schenqrund CL.Lipid rafts:keys to neurodegeneration[J].Brain Res Bull,2010,82(1-2):7-17.
[13]Kosicek M,Malnar M,Goate A,et al.Cholesterol accumulation in Niemann Pick type C (NPC) model cells causes a shift in APP localization to lipid rafts[J].Biochem Biophys Res Commun,2010,393(3):404-409.
[14]Ehehalt R,Keller P,Haass C,et al.Amyloidogenic processing of the Alzheimer β-amyloid precursou protein depends on lipid rafts[J].J Cell Biol,2003,160(1):113-123.
[15]Kakio A,Nishimoto S,Yanagisawa K,et al.Cholesterol-dependent formation of GM1 ganglioside-bound amyloid β-protein,an endogenous seed for Alzheimer amyloid[J].J Biol Chem,2001,276(27):24985-24990.
[16]Shneider A,Schulz-Schaeffer W,Hartmann T,et al.Cholesterol depletion reduces aggregation of amyloid-beta peptide in hippocapal neurons[J].Neurobiol Dis,2006,23(3):573-577.
[17]Hong S,Ostaszewski BL,Yang T,et al.Soluble Aβ oligomers are rapidly sequestered from brain ISF in vivo and bind GM1 ganglioside on cellular membranes[J].Neuron,2014,82(2):308-319.
[18]Thakur G,Pao C,Micic M,et al.Surface chemistry of lipid raft and amyloid Aβ(1-40) Langmuir monolayer[J].Colloids Surf B Biointerfaces,2011,87(2):369-377.
[19]Fantini J,Yahi N,Garmy N.Cholesterol accelerates the binding of Alzheimer’s β-amyloid peptide to ganglioside GM1 through a universal hydrogen-bond-dependent sterol tuning of glycolipid conformation[J].Front Physiol,2013,4:120-130.
[20]Kim Y,Kim C,Jang HY,et al.Inhibition of Cholesterol biosynthesis reduces γ-secretase activity and amyloid-β generation[J].J Alzheimers Dis,2016,51(4):1057-1068.
[21]Jensen CS,Hasselbalch SG,Waldemar G,et al.Biochemical markers of physical exercise on mild cognitive impairment and dementia:systematic review and perspectives[J].Front Neurol,2015,6:187-197.
[22]McGuinness B,Fuchs M,Barrett SL,et al.Platelet Membrane β-secretase activity in mild cognitive impairment and conversion to dementia:a longitudinal study[J].J Alzheimers Dis,2016,49(4):1095-103.
[23]Gibson Wood W,Eckert GP,Iqbavboa U,et al.Amyloid beta-protein interactions with membranes and cholesterol:causes or casualties of Alzheimer’s disease[J].Biochim Biophys Acta,2003,1610(2):281-290.
[24]Borroni B,Agosti C,Marcello E,et al.Blood cell markers in Alzheimer disease:Amyloid precursor protein form ratio in platelets[J].Exp Gerontol,2010,45(1):53-56.
