温度对海月水母浮浪幼虫的影响
2018-07-02刘青青于洋孙婷婷董志军
刘青青, 于洋, 孙婷婷, 董志军,*
1. 中国科学院烟台海岸带研究所, 烟台 264003
2. 中国科学院大学, 北京 101408
3. 海南省海洋与渔业科学院, 海口 571126
1 前言
海月水母(Aurelia aurita), 属刺胞动物门(Cnidaria), 钵水母纲(Scyphozoa), 旗口水母目(Semaeostomeae), 洋须水母科(Ulmaridae), 海月水母属(Aurelia)[1]。海月水母为全球广布种, 在我国主要分布于黄渤海近岸海域[2]。近年来, 海月水母爆发事件在烟台、威海、青岛、秦皇岛等地均有报道[3], 是我国近岸海域常见的灾害水母种类之一。海月水母爆发会造成滨海发电厂冷却系统堵塞, 影响用电供应;阻塞或破坏渔网影响渔业生产[4]; 同时, 海月水母还会捕食经济鱼、虾、贝类等的幼体, 并与经济鱼类争夺饵料, 进而影响近海渔业资源的恢复[5]。
海月水母生活史复杂, 包括有性浮游世代和无性底栖世代[6]。海月水母属雌雄异体种, 在有性生殖季节, 成熟的雄性海月水母将精子排出体外, 进入雌性水母体内, 进行体内受精。受精卵在雌性水母口腕边缘发育为浮浪幼虫, 浮浪幼虫离开雌性水母, 海水中浮游数小时至数天之后, 在适宜的附着基附着变态或者于水—气界面直接变态发育为螅状幼体[7-9]。螅状幼体可通过多种无性繁殖方式进行生殖, 发育为横裂体释放碟状幼体, 碟状幼体逐渐发育为幼水母[10]。海月水母早期生活史幼体阶段的种群动态直接决定海月水母成体的种群数量[6], 因此, 环境因子对海月水母不同阶段幼体的影响成为目前海月水母爆发机制研究的热点。在早期生活史阶段, 海月水母浮浪幼虫生存附着、螅状幼体无性生殖均是影响海月水母种群变化的重要因素[11]。目前国内外研究者对海月水母螅状幼体无性生殖和碟状幼体生长发育的研究较多, 但海月水母浮浪幼体生存附着方面的研究较少。
浮游幼虫阶段是大部分海洋无脊椎动物在发育过程中经历的一个重要阶段[12]。国内外研究者对浮游幼虫的外部形态特征以及各种环境因子(如温度、盐度、光照等)对于浮游幼虫生长发育的影响等, 开展了大量研究工作[13-16]。以往研究者认为, 浮游幼虫如果没有合适的底质附着, 会继续经历一段浮游时期, 但浮游存活时间一般不超过两周[17]。但近年来的研究表明, 某些无脊椎动物种类浮浪幼虫具有较长的浮游存活时间。如: Nozawa等人研究发现海孔蜂巢珊瑚(Favites halicora)和粗糙菊花珊瑚(Goniastrea aspera)浮浪幼虫的最大存活时间分别为 56—63天和63—70天[18]。而对于海月水母浮浪幼虫的最大存活时间, 国内外相关报道较少。同时, 本研究探讨了温度对海月水母浮浪幼体存活和附着的影响, 研究结果将为海月水母早期生活史阶段种群动态研究提供重要参考。
2 材料与方法
2.1 实验材料
2016年 8月, 值海月水母成熟期, 在烟台近岸海域(37.4789°N; 121.4627°E)用手抄网采集性成熟的海月水母(口腕处可见受精卵), 放入盛有自然海水的整理箱中充氧培养。第二天用孔径500 μm筛绢过滤整理箱内海水, 去除水母组织碎片等杂物。然后将海水用38 μm筛绢进行二次过滤收集海月水母浮浪幼虫。用过滤海水(经孔径0.22 μm滤膜过滤)冲洗筛绢将浮浪幼虫冲洗到1000 mL塑料量筒, 静置30分钟, 等待浮浪幼虫浮在表面而其它杂质沉到量筒底部, 用吸管吸取浮浪幼虫置于500 mL烧杯中,加入过滤海水常温保存, 当天进行海月水母浮浪幼虫实验。
2.2 实验方法
2.2.1 实验温度设置
烟台近岸海域海月水母有性生殖一般发生在夏末秋初, 因此本研究温度设置为 19 ℃和 24 ℃, 其中24 ℃为烟台近岸海域夏末(9月份)的海水平均温度, 而19 ℃为烟台近岸海域秋初(10月份)的海水平均温度。温度采用光照培养箱控制, 光照周期为 12 L: 12 D。实验所用海水为0.22 μm滤膜过滤的海水,实验前用YSI-600多参数水质监测仪测定记录海水盐度和pH。
2.2.2 温度对海月水母浮浪幼虫存活和附着影响
温度对海月水母浮浪幼虫存活和附着影响实验使用灭菌过的24孔深孔培养板, 每个温度设置5个平行样。分别向每个深孔中加入0.22 μm滤膜过滤的海水10 mL, 用吸管小心吸取海月水母浮浪幼虫1只,放入每个深孔内, 然后放置于对应温度的光照培养箱, 用于浮浪幼虫存活和附着研究。每周在解剖镜下观察记录海月水母浮浪幼虫存活和附着的数目, 并用吸管换取约80%左右的0.22 μm的过滤海水。
2.2.3 温度对海月水母浮浪幼虫形态影响
温度对海月水母浮浪幼虫形态影响使用灭菌过的100 mL塑料瓶, 每个温度梯度设置5个平行样。分别向每个塑料瓶中加入0.22 μm过滤海水100 mL,用吸管吸取海月水母浮浪幼虫约 100只, 放入每个塑料瓶内, 然后放置于对应温度的光照培养箱, 用于浮浪幼虫形态学观察测量。每周在每个塑料瓶随机挑取浮浪幼虫2只, 使用OPT Pro软件在解剖镜下测量记录浮浪幼虫的长度和宽度。
2.3 数据分析
运用双因素方差分析(two-way ANOVA)检验温度和时间对海月水母浮浪幼虫死亡、附着和形态的影响, 以最小显著差异法(LSD)检测不同温度海水处理组的差异程度, 以P< 0.05和P< 0.01为显著性水平。本研究统计分析均使用SPSS20.0软件。
3 结果
3.1 海月水母浮浪幼虫存活时间
本研究中使用的过滤海水的盐度和 pH变化范围较小, 盐度范围为30.46—31.11, pH范围为7.95—7.99。海月水母浮浪幼虫的存活个体数随着实验时间的推移逐渐减少, 在第四周时存活数目为 0, 可知本次实验中海月水母浮浪幼虫的最大存活时间为 21—28 天(图1)。
3.2 海月水母浮浪幼虫死亡率
通过双因素方差分析, 从表 1可知, 温度对海月水母浮浪幼虫的死亡率有显著影响(F= 4.238;P<0.05), 在 24 ℃的条件下浮浪幼虫的死亡率显著高于19 ℃(图2)。实验时间对海月水母浮浪幼虫的死亡率有极显著影响(F= 60.921;P< 0.01), 海月水母浮浪幼虫的死亡率随着实验时间的增加而显著上升,在19 ℃条件下的最终死亡率为(53.3 ± 4.2)%(Mean ±SE), 24 ℃时的最终死亡率为(60.0 ± 3.9)%(Mean ±SE)(图2)。
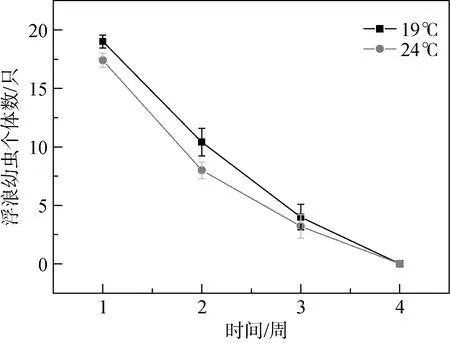
图1 海月水母浮浪幼虫存活数目随时间的周变化(平均值±标准误差)Fig. 1 The number of the survival planula larvae under the two temperature conditions during four-week experimental time(Mean ± SE)
3.3 海月水母浮浪幼虫附着率
由表 1可知, 温度对于浮浪幼虫的附着率无显著影响(P> 0.05)。实验时间对于浮浪幼虫的附着率有极显著影响(F= 27.346;P< 0.01), 附着率随着实验时间的推移逐渐增加, 直至幼虫全部附着或死亡。浮浪幼虫最终附着时间发生在14—21天, 在19 ℃的温度条件下浮浪幼虫的最终附着率为(46.7 ± 4.2)%(Mean ± SE), 24 ℃时的最终附着率为(40.0 ± 3.9)%(Mean ± SE) (图3)。
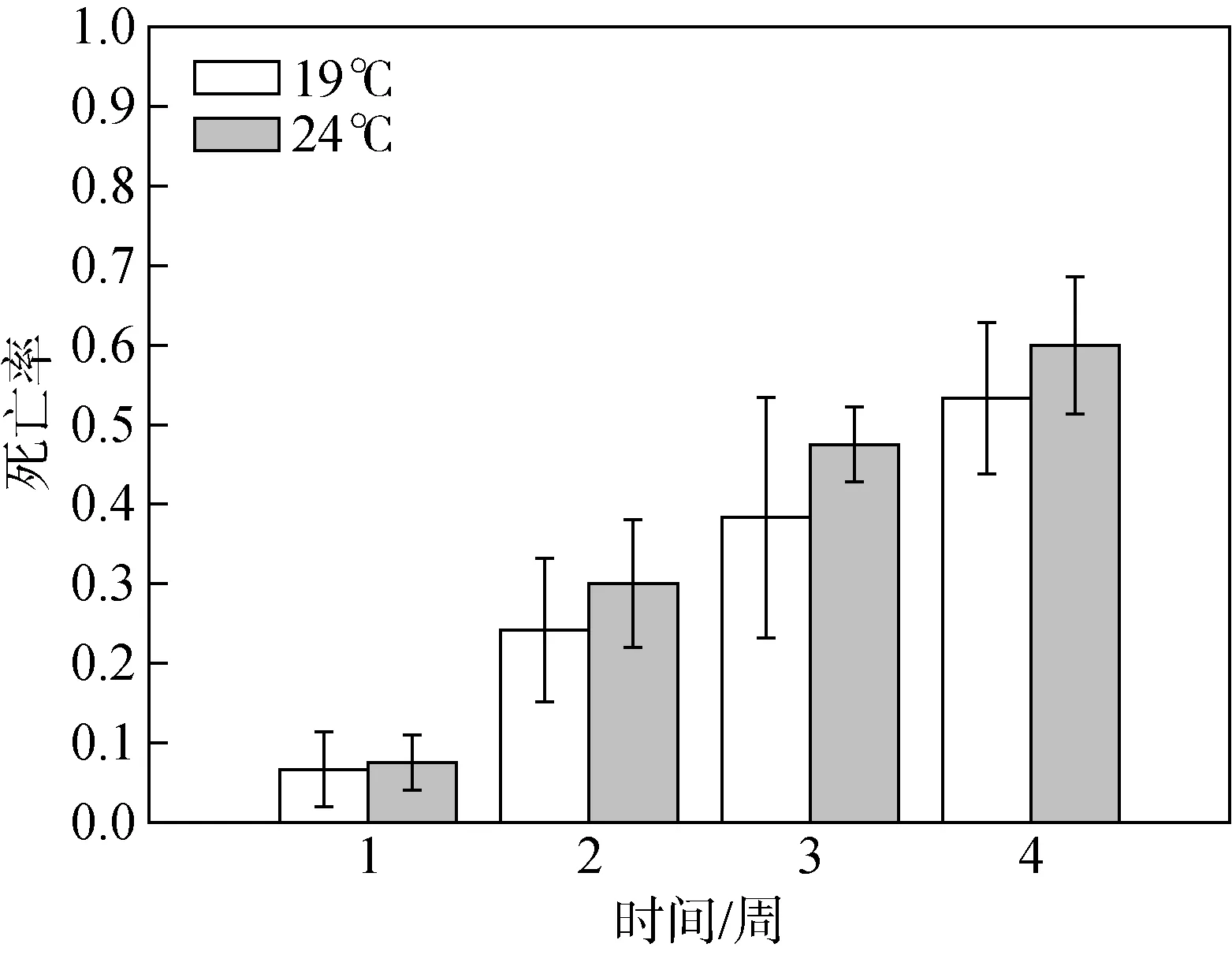
图2 不同温度条件下浮浪幼虫死亡率的周变化(平均值±标准误差)Fig. 2 The morality rates of planula larvae under the two temperature conditions during four-week experimental time(Mean ± SE)
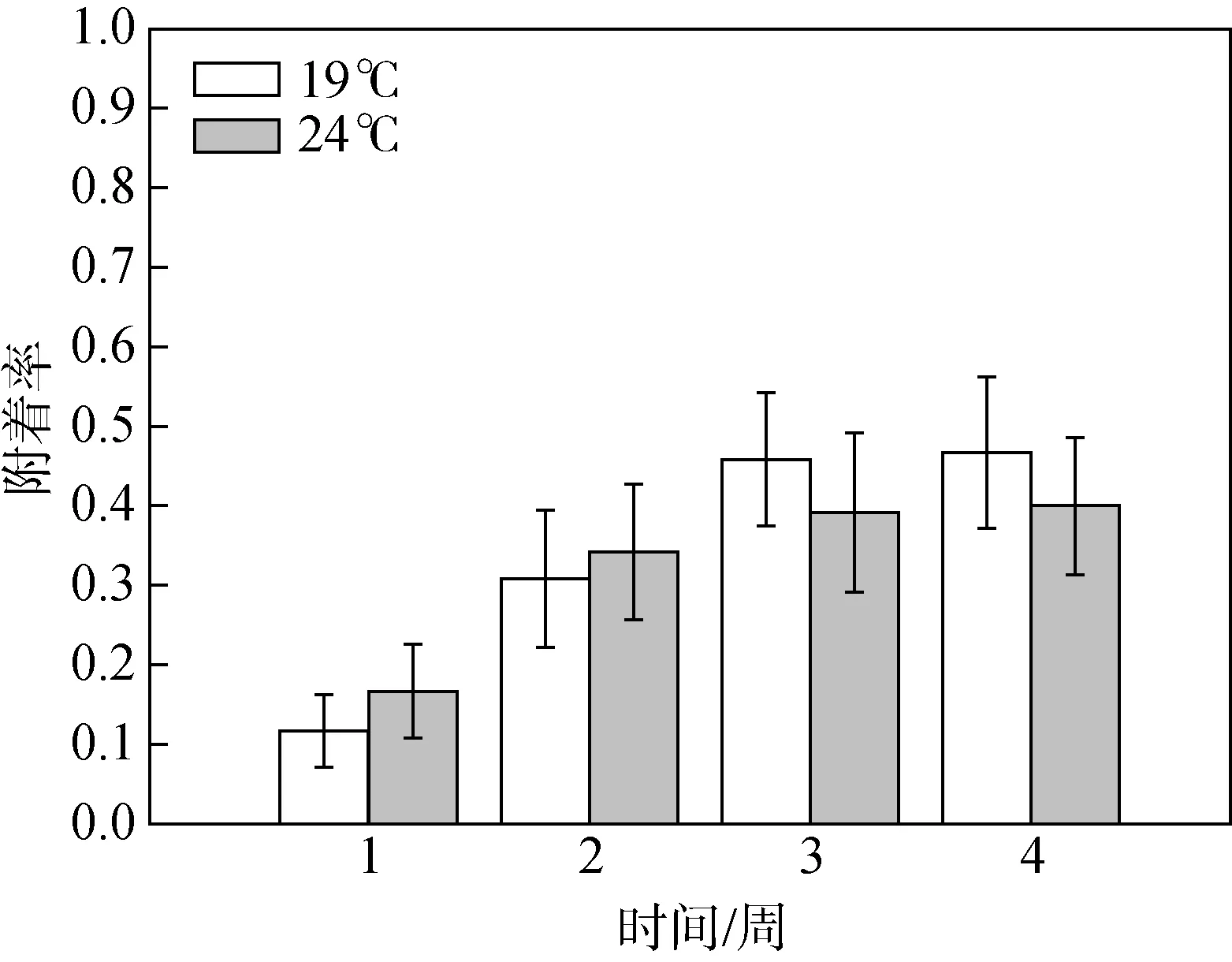
图3 不同温度条件下浮浪幼虫附着率的周变化(平均值±标准误差)Fig. 3 The settlement rates of planula larvae under the two temperature conditions during four-week experimental time(Mean ± SE)
3.4 海月水母浮浪幼虫形态
温度对于海月水母浮浪幼虫的长度有显著性影响(F= 7.153,P< 0.05)(表1), 在19 ℃的条件下浮浪幼虫的长度大于24 ℃时(图4)。实验时间对于海月水母浮浪幼虫的长度有极显著影响(F= 31.313;P<0.01), 浮浪幼虫的长度随着实验时间的增加而显著减小。而温度和实验时间单因素对海月水母浮浪幼虫的宽度影响不显著(P> 0.05) (表1)。
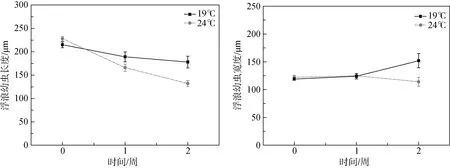
图4 海月水母浮浪幼虫在不同温度条件下形态学长度(左)和宽度(右)变化(平均值±标准误差)Fig. 4 Size in length (left) and width (right) of survival planula larvae under the two temperature conditions during two-week experimental time (Mean ± SE)
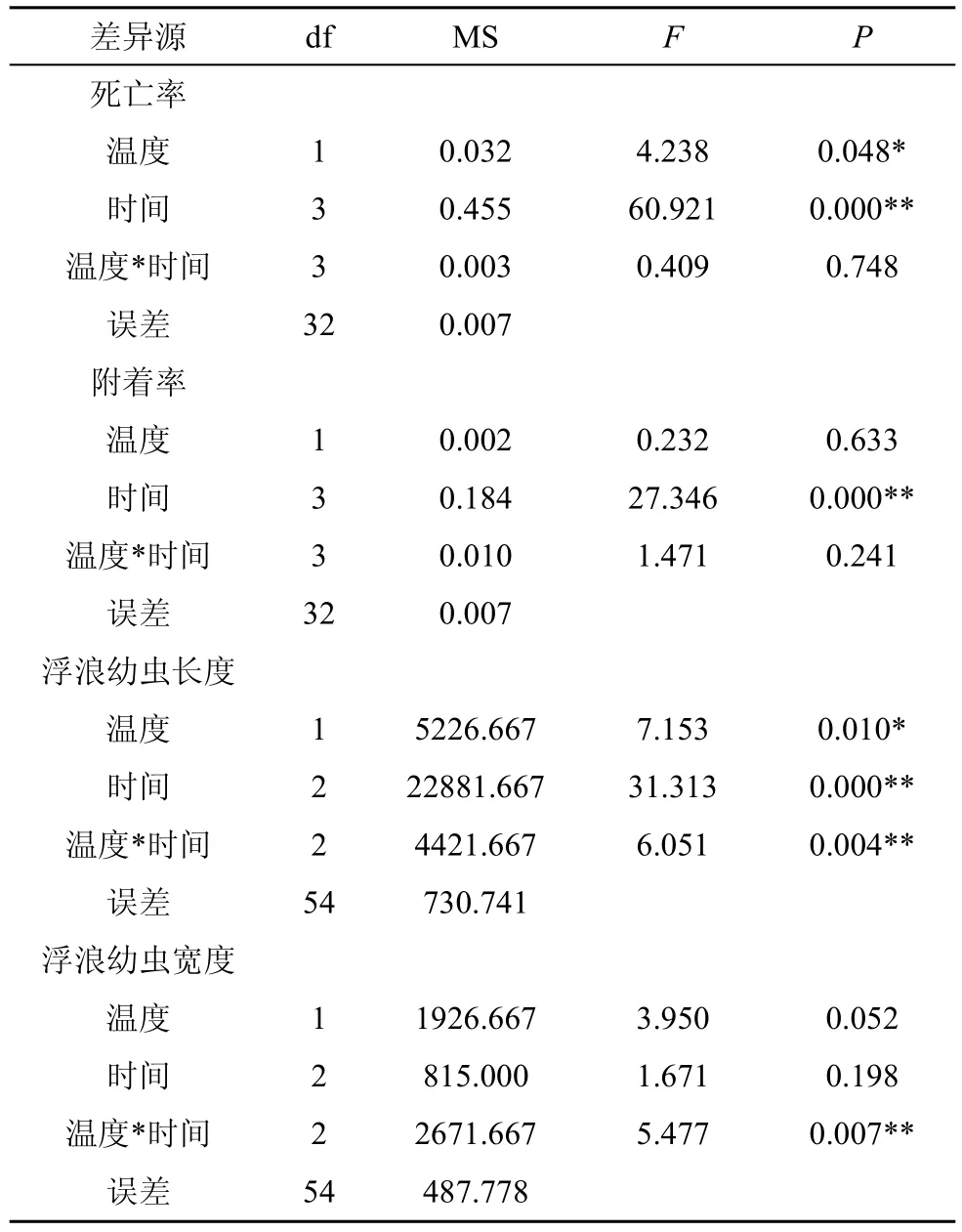
表 1 海月水母浮浪幼虫死亡率、附着率、形态的双因素方差分析Tab. 1 Results from a two-way ANOVA on differences in the morality rates, settlement rates and size in length and width of Aurelia aurita planula larvae
4 讨论
海月水母的繁殖方式包括有性生殖和无性生殖两种类型。目前, 国内外关于海洋环境因子对海月水母无性生殖影响的研究较多。例如, Purcell 等认为盐度和温度的交互作用可以影响海月水母螅状体的出芽生殖, 在低温低盐(7 ℃、20 ppt)下海月水母螅状体出芽率最低[19]。温度影响海月水母螅状体的出芽生殖, 升温可以促进大多数温带种水母的出芽生殖[20]。近年来, 对于海洋环境因子对海月水母有性生殖影响的研究也有了一定进展, 如野外观察发现光照影响海月水母成体性成熟及产卵, 海月水母成体追随阳光主动迁移、聚集并产卵[21]。然而海月水母初生浮浪幼虫阶段个体非常小, 且历时较短, 故对于海月水母的浮浪幼虫阶段的研究相对较少, 本实验补充研究了海月水母的早期生活史阶段。
4.1 海月水母浮浪幼虫存活时间
自由游动状态的浮浪幼虫阶段会直接影响螅状体种群建立和成体水母种群的迁移, 故研究浮浪幼虫的浮游时期具有重要意义[22]。在以往的报道中,Schneider 等人发现海月水母浮浪幼虫在19.6—21.5℃时的最大自由浮游时间为一周, 低温会降低浮浪幼虫的代谢速率, 因此深水区浮浪幼虫存活的时间可能更久[23]。Vagelli等人的研究结果表明海月水母浮浪幼虫附着前会经历 14—21天的自由浮游阶段, 即最大浮游时间为14—21天[24]。而本实验设置的温度(19 ℃和24 ℃)条件下, 海月水母浮浪幼虫的最大浮游时间均是 21—28天。本研究结果与以往报道得出的结论相符, 且比上述报道中海月水母浮浪幼虫的浮游时间略长一些。浮游幼虫的浮游时间取决于多种环境因素的共同影响, 包括温度、盐度、水团扰动和水流的输送等条件。目前 Conley等人通过设置盐度梯度(15, 20, 25和32 ppt)研究其对于海月水母浮浪幼虫浮游时间的影响, 结果显示海月水母浮浪幼虫的浮游时间在低盐的条件下显著增加[25]。充气可以影响浮浪幼虫在培养海水中的存活时间: 在充气的过滤海水中, 海月水母浮浪幼虫从释放到附着的时间大于 8 天; 在不充气的未过滤海水中则不到3 天, 甚至可在24 小时内完成附着[7]。
4.2 海月水母浮浪幼虫死亡
大多数的浮浪幼虫会在其浮游阶段死亡, 但由于缺乏自然海域中浮浪幼虫密度的数据,因此无法准确估算浮浪幼虫在海水中的死亡率。本次室内实验通过模拟海水环境, 探讨了温度对浮浪幼虫死亡率的影响, 结果显示温度对浮浪幼虫的死亡率有显著影响, 且 24 ℃条件下的浮浪幼虫死亡率高于 19℃, 两种温度条件下浮浪幼虫的最终死亡率均达50%以上, 与Ishii提出的浮游阶段浮浪幼虫高死亡率的特点相符[26]。
4.3 海月水母浮浪幼虫附着
浮浪幼虫自雌性海月水母体内释放后, 在适宜的基质上附着并变态为螅状体。目前关于温度影响海月水母浮浪幼虫附着率的文献报道较少, 但关于钵水母纲其他水母的相关研究有了一定进展。Prieto等人在温度(20, 24和30 ℃)范围内, 研究温度对蛋黄水母(Cotylorhiza tuberculata)浮浪幼虫附着率的影响, 结果显示在20, 24和30 ℃条件下浮浪幼虫的附着率约为40%[27]。Gambill等研究发现在温度为20 ℃, 光照周期为12 L: 12 D的条件下,霞水母浮浪幼虫附着率最高, 在温度为10 ℃和15℃, 完全黑暗的条件下, 附着率最低[28]。本实验通过双因素方差分析探讨了温度和实验时间对于海月水母浮浪幼虫附着率的影响, 结果显示两种温度条件下浮浪幼虫的附着率无显著差异。在19 ℃的温度条件下浮浪幼虫的最终附着率为(46.7 ± 4.2)%,24 ℃时的最终附着率为(40.0 ± 3.9)%, 与Prieto等人的研究结果相符。实验时间对于浮浪幼虫的附着率有极显著影响, 附着率随着实验时间的增加而显著增加。此外, 探讨浮浪幼虫的动态附着机制是了解螅状体种群如何建立栖息地的重要依据[11]。之后的研究还需考察自然环境中浮浪幼虫的附着偏好,并结合室内实验的研究, 以便更好地了解水母种群的动态分布。
4.4 海月水母浮浪幼虫形态学变化
浮浪幼虫为两端钝圆的长圆形, 自雌性水母体释放后, 即可进行纤毛运动。自由游泳一段时间后,前后轴变短, 游泳速度变慢[29]。依据其形态学特征,实验中对海月水母浮浪幼虫的长度和宽度进行了测量和分析。结果表明, 浮浪幼虫的长度变化范围为 125.37—232.67 μm, 宽度变化范围为 105.94—164.89 μm。温度和实验时间对于海月水母浮浪幼虫的长度有显著影响, 浮浪幼虫的长度随着实验时间的增加而显著减小。温度和实验时间单因素对于海月水母浮浪幼虫的宽度影响不显著。目前,Nozawa等研究发现海孔蜂巢珊瑚(Favites halicora)和粗糙菊花珊瑚(Goniastrea aspera)幼虫的宽度和长度随着时间的增加而显著减少[18]。本实验结果与Nozawa等研究的珊瑚浮浪幼虫形态学变化的结果类似。国外有学者指出襟疣海葵(Anthopleura elegantissima)浮浪幼虫不需摄食而通过自身卵黄营养完成变态[30], 故浮浪幼虫的形态学变化可能与浮浪幼虫发育成螅状体的过程中幼虫的卵内营养物质消耗有关[18]。
5 结论
烟台近岸海域海月水母有性生殖一般发生在夏末秋初, 本实验研究了温度对海月水母浮浪幼虫浮游时间、死亡率、附着率和形态学变化的影响。结果显示, 两种温度条件下海月水母浮浪幼虫的最大浮游时间为21—28天。温度对浮浪幼虫的死亡率有显著影响, 且 24 ℃时幼虫的死亡率时高于19 ℃。而两种温度条件下浮浪幼虫的附着率无显著差异。另外, 不同温度条件下浮浪幼虫的长度差异显著, 宽度差异不显著。本实验结果丰富了海月水母早期生活史的研究, 为螅状体种群和成体水母种群变化提供理论依据。未来的实验设计中可以考虑多种因素(温度、盐度、pH, 充氧和光照等)的交互作用对于钵水母浮浪幼虫的行为和附着机制的影响。
[1] RUSSELL F S. The Medusae of the British Isles: Pelagic Scyphozoa with a Supplement to the First Volume on Hdromedusae[M]. University Press, 1970: 280.
[2] 高尚武, 洪惠馨, 张士美. 中国动物志(第二十七卷): 水螅虫纲 钵水母纲[M]. 北京: 科学出版社, 2002: 30-34.
[3] 王建艳, 于志刚, 甄毓, 等. 环境因子对海月水母生长发育影响的研究进展[J]. 应用生态学报, 2012, 23(11):3207-3217.
[4] DONG Zhijun, LIU Dongyan, KEESING J K. Jellyfish blooms in China: dominant species, causes and conesquences[J]. Marine Pollution Bulletin, 2010, 60(7):954-963.
[5] HANSSON L J, MOESLUND O, KIORBOE T, et al.Clearance rates of jellyfish and their potential predation impact on zooplankton and fish larvae in a neritic ecosystem (Limfjorden, Denmark)[J]. Marine Ecology Progress Series, 2005, 304: 117-131.
[6] LUCAS C H. Reproduction and life history strategies of the common jellyfish, in relation to its ambient environment[J].Hydrobiologia, 2001, 451(1/3): 229-246.
[7] BREWER R H. Larval settlement behavior in the jellyfish,Aurelia aurita(Linnaeus) (Scyphozoa: Semaeostomeae)[J].Estuaries, 1978, 1(2): 120.
[8] 和振武. 海月水母的生殖[J]. 生物学通报, 1993, 28(8):14.
[9] HOLST S, JARMS G. Substrate choice and settlement preferences of planula larvae of five Scyphozoa (Cnidaria)from German Bight, North Sea[J]. Marine Biology, 2007,151(3): 863-871.
[10] 付瑶, 董志军, 刘东艳. 海月水母无性生殖的影响因子[J].生态科学, 2012, 31(3): 335-339.
[11] LUCAS C H, GRAHAM W M, WIDMER C. Jellyfish life histories: role of polyps in forming and maintaining scyphomedusa populations[J]. Advances in Marine Biology,2012, 63:133.
[12] 郑重. 浮游幼虫生态研究—海洋浮游生物学的新动向之三[J]. 自然杂志, 1978, 8: 13.
[13] 鲁南, 刘春洋, 郭平. 盐度对海蜇各发育阶段幼体的影响[J]. 生态学报, 1989, 4: 304-309.
[14] HOLST S, JARMS G. Effects of low salinity on settlement and strobilation of scyphozoa (Cnidaria): Is the lion’s maneCyanea capillata(L.) able to reproduce in the brackish Baltic Sea?[J]. Hydrobiologia, 2010, 645(1): 53-68.
[15] 孙明, 董婧, 付志璐, 等. 光照度对海月水母螅状体存活和生长的影响[J]. 水产科学, 2012, 31(4): 211-215.
[16] FITT W K, COSTLEY K. The role of temperature in survival of the polyp stage of the tropical rhizostome jellyfishCassiopea xamachana[J]. Journal of Experimental Marine Biology and Ecology, 1998, 222(1): 79-91.
[17] 郑重. 海洋浮游幼虫附着和变态的生态研究[J]. 生态学杂志, 1993, 12(3): 36-38.
[18] NOZAWA Y, HARRISON P. Temporal settlement patterns of larvae of the broadcast spawning reef coralFavites chinensisand the broadcast spawning and brooding reef coralGoniastrea asperafrom Okinawa, Japan[J]. Coral Reefs, 2005, 24(2): 274-282.
[19] PURCELL J E, SCHWARCK N T. Interannual variation of strobilation by the scyphozoanAurelia labiatain relation to polyp density, temperature, salinity, and light conditions in situ[J]. Marine Ecology Progress Series, 2009, 375:139-149.
[20] PURCELL J E. Climate effects on formation of jellyfish and ctenophore blooms: a review[J]. Journal of the Marine Biological Association of the United Kingdom, 2005, 85(3):461-476.
[21] HAMNER W M, HAMNER P P, STRAND S W.Sun-compass migration byAurelia aurita(Scyphozoa):population retention and reproduction in Saanich Inlet,British Columbia[J]. Marine Biology, 1994, 119(3):347-356.
[22] DUARTE C M, PITT K A, LUCAS C H, et al. Is global ocean sprawl a cause of jellyfish blooms?[J]. Frontiers in Ecology and the Environment, 2013, 11(2): 91-97.
[23] SCHNEIDER G, WEISSE T. Metabolism measurements ofAurelia auritaplanula larvae, and calculation of maximal survival period of the free swimming stage[J]. Helgoländer Meeresuntersuchungen, 1985, 39(1): 43.
[24] VAGELLI A A. New observations on the asexual reproduction ofAurelia aurita(Cnidaria, Scyphozoa) with comments on its life cycle and adaptive significance[J].Invertebrate Zoology, 2007, 4(2): 111-127.
[25] CONLEY K, UYE S I. Effects of hyposalinity on survival and settlement of moon jellyfish (Aurelia aurita)planulae[J]. Journal of Experimental Marine Biology and Ecology, 2015, 462: 14-19.
[26] ISHII H, OGAWA C. Survivorship ofAurelia auritathroughout their life cycle in Tokyo Bay (Japan)[J].Bulletin of the Plankton Society of Japan, 2005, 52: 77-81.
[27] PRIETO L, ASTORGA D, NAVARRO G, et al.Environmental control of phase transition and polyp survival of a massive-outbreaker jellyfish[J]. Plos one,2010, 5(11): e13793.
[28] GAMBILL M, MCNAUGHTON S L, KREUS M, et al.Temperature-dependent settlement of planula larvae of two scyphozoan jellyfish from the North Sea[J]. Estuarine,Coastal and Shelf Science, 2018, 201: 64-71.
[29] DONG Jing, LIU Chunyang, WANG Yanqing, et al.Laboratory observations on the life cycle ofCyanea nozakii(Semeostomida, Scyphozoa)[J]. Acta zoologica Sinica,2005, 52(2): 389-395.
[30] SCHWARZ J, WEIS V, POTTS D. Feeding behavior and acquisition of zooxanthellae by planula larvae of the sea anemoneAnthopleura elegantissima[J]. Marine Biology,2002, 140(3): 471-478.
