南美蟛蜞菊花挥发油化学成分分析及其抗细菌活性
2018-06-29伍慧雄方萍张伟豪王伟欧阳锦逵单体江
伍慧雄,方萍,张伟豪,王伟,欧阳锦逵,单体江
(广东省森林植物种质创新与利用重点实验室,华南农业大学林学与风景园林学院,广东 广州 510642)
南美蟛蜞菊Wedeliatrilobata(L.) Hitchc,又名三裂叶蟛蜞菊、地锦花、穿地龙等,为菊科Aste-raceae蟛蜞菊属多年生草本植物,原产于南美洲及中美洲地区,20世纪70年代作为绿化地被植物引进我国,因其环境适应性强,繁殖速度快,定居后很快逃逸为野生[1-5]。南美蟛蜞菊被列为世界最有害的100种外来入侵物种之一[1,6],同时也是广东省主要的外来入侵植物之一,目前已成为华南地区危害性严重的杂草,对花生、水稻等农作物危害较大,严重破坏森林生态环境,威胁生态物种的多样性,并造成较大的经济损失[7-8]。
入侵植物生态适应能力强,不仅是受其本身的生物学特性影响,其产生的丰富的生态化学物质也起到了重要作用[9]。外来入侵植物可通过根部分泌化感物质进入土壤,通过直接或间接的方式改变土壤微生态环境,进而改变土壤微生物群落组成和功能,提高竞争优势[10]。因此对于南美蟛蜞菊的研究也主要集中于化感作用和生物学特性等方面,包括对各种杂草、水稻和花生等农作物以及各种蔬菜的化感作用[7-8,10-14]。南美蟛蜞菊挥发油具有一定的抗菌活性[15]和对害虫的拒食、毒杀等活性[16-17],对畜禽、水产养殖中常见致病细菌以及人体病原细菌表现出较强的抑制活性,且随着挥发油浓度的增大,其抑菌活性增强[18-19]。然而目前尚未见南美蟛蜞菊对农业和林业病原细菌抗菌活性的报道。
本研究通过水蒸汽蒸馏法提取南美蟛蜞菊花中的挥发油,分析和鉴定其化学组成,并通过抑菌圈法测定了南美蟛蜞菊花挥发油对6种供试细菌的抑菌活性,以期为外来入侵植物的防控以及南美蟛蜞菊综合利用提供理论依据。
1 材料与方法
1.1 材料 南美蟛蜞菊花于2014年7月21采自华南农业大学校园,标本由华南农业大学林学与风景园林学院郑明轩老师鉴定。
供试细菌:枯草芽孢杆菌Bacillussubtilis,G+,桉树青枯菌Ralstoniasolanacearum,G-,番茄疮痂病菌Xanthomonasvesicatoria,G-,黄瓜角斑病菌Pseudomonaslachrymans,G-,大肠杆菌Escherichiacoli,G-以及根癌土壤杆菌Agrobacteriumtumefaciens,G-,以上菌株由华南农业大学林学与风景园林学院森保教研室提供。
1.2 仪器与试剂 水蒸汽蒸馏装置(北京永光明医疗仪器厂);6890N-5975C气相色谱-质谱联用仪(GC-MS)(Agilent Technologies,USA);正构烷烃C8-C40,硫酸链霉素(美国Sigma公司);氯化钠、无水乙醚、无水硫酸钠等均为国产分析纯(北京化学试剂公司)。
1.3 南美蟛蜞菊花挥发油的提取及其GC-MS分析 南美蟛蜞菊花挥发油的提取参照Lou等[20]的方法,花挥发油化学组分的鉴定在6890N-5975C GC-MS(Agilent Technologies,USA)上进行,色谱柱为DB-5(30 m × 250 μm × 0.25 μm),无分流进样,进样量1 μL。升温程序:进样口温度230 ℃,起始温度70 ℃,保持1 min,以8 ℃/min上升到120 ℃,保持1 min,以30 ℃/min上升到150 ℃,保持1 min,以5 ℃/min上升到175 ℃,保持0 min,再以1 ℃/min上升到180 ℃,保持0 min,最后以5 ℃/min上升到240 ℃,保持0 min。离子源温度230 ℃,电离方式为EI,电离能量70 eV,载气为He,流速1 mL/min,全扫描采集,质谱检测器(MSD)检测。通过NIST(2011)谱库检索,与标准化合物的保留时间和质谱图作对比,确定待测成分。保留系数(retention index,RI)的测定参照Wang[21]和Van den Dool[22]等的方法。
1.4 南美蟛蜞菊花挥发油抗菌活性的测定 南美蟛蜞菊花挥发油抗细菌活性的测定参照赵文越[23]等的方法,在活性测定前,先用LB 平板进行活化培养(28℃,暗)48 h,然后挑取单菌落,在LB液体培养基中摇培( 28 ℃,暗,150 rpm ) 24 h,将菌液浓度稀释到108cfu /mL,备用。倒好平板后,用移液枪分别吸取50 μL菌液,用玻璃棒涂板。用镊子夹取直径6 mm的无菌滤纸片放在带菌平板上,每皿放置3片,滤纸片保持一定的距离,每片滤纸片滴加5 μL的供试挥发油,阳性对照为5 μL 0.2%硫酸链霉素,空白对照为5 μL无菌水。而后在28 ℃,黑暗条件下培养24 h,用尺子量取抑菌圈直径的大小,每个处理重复3次。采用SAS 8.2软件对数据进行分析,显著性差异水平为0.05。
2 结果与分析
2.1 南美蟛蜞菊花挥发油化学成分分析 采用水蒸汽蒸馏法提取南美蟛蜞菊花中的挥发油,得率为0.067% (以鲜重为基础)。南美蟛蜞菊花挥发油总离子流色谱图如图1所示。
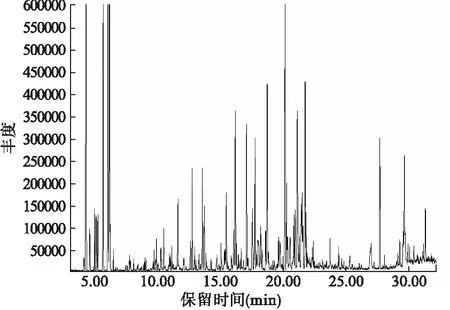
图1 南美蟛蜞菊花挥发油总离子流色谱图
通过GC-MS分析,各组分峰用NIST Library(2011版) 质谱库进行检索,从南美蟛蜞菊花中共鉴定出46个组分,占总相对含量的91.90%,采用GC峰面积归一化法定量分析,计算出各成分的相对含量,南美蟛蜞菊花挥发油组分及其相对含量见表1。其中主要成分为(1R)-α-蒎烯(28.22%)、D-柠檬烯(14.82%)、间异丙基甲苯(7.51%)、α-水芹烯(4.11%)、(-)-Alloisolongifolene(3.52%)和Eudesma-3,7(11)-diene(2.52%),其余成分的相对含量均在2.50%以下。该实验结果与海南海口的南美蟛蜞菊花挥发油[4],广东潮州的南美蟛蜞菊叶挥发油[24]以及广西桂林[9]、广东揭阳[15]、海南海口[25]和福建福州[19]的南美蟛蜞菊地上部分挥发油比较发现,无论是化合物的组成还是化合物的相对含量,均存在较大差异,但其主要成分相差不大,均为α-蒎烯、D-柠檬烯和α-水芹烯等。说明南美蟛蜞菊挥发油的化学成分与样品产地、植株部位、分析方法以及采集时间等因素有关。以上结果表明,南美蟛蜞菊花中含有种类丰富的挥发性成分。这些化学成分是否与南美蟛蜞菊极强的生物入侵性以及化感作用有关还有待于进一步研究。
2.2 南美蟛蜞菊花挥发油的抗细菌活性 南美蟛蜞菊花挥发油对6种供试细菌均表现出一定的抑菌作用,但对不同细菌的抑制活性差异显著(图2)。南美蟛蜞菊花挥发油对黄瓜角斑病菌的抑制活性最强(图3e),其次为番茄疮痂病菌(图3c),抑菌圈直径分别为(21.0±1.0) mm和(15.7±1.5) mm,其中对黄瓜角斑病菌的抑制活性要明显强于阳性对照硫酸链霉素(抑菌圈直径为(18.0±1.0) mm;而对大肠杆菌和枯草芽孢杆菌的抑制活性较弱,抑菌圈直径分别为(8.2±0.3) mm和(10.3±0.6) mm。南美蟛蜞菊花挥发油对桉树青枯病菌(图3b)及根癌土壤杆菌(图3a)的抑菌圈直径分别为(12.0±0.5) mm和(14.0±0.5) mm,其对桉树青枯病菌的抑菌活性与阳性对照硫酸链霉素(抑菌圈直径为(13.0±1.0) mm)相比相差不大。
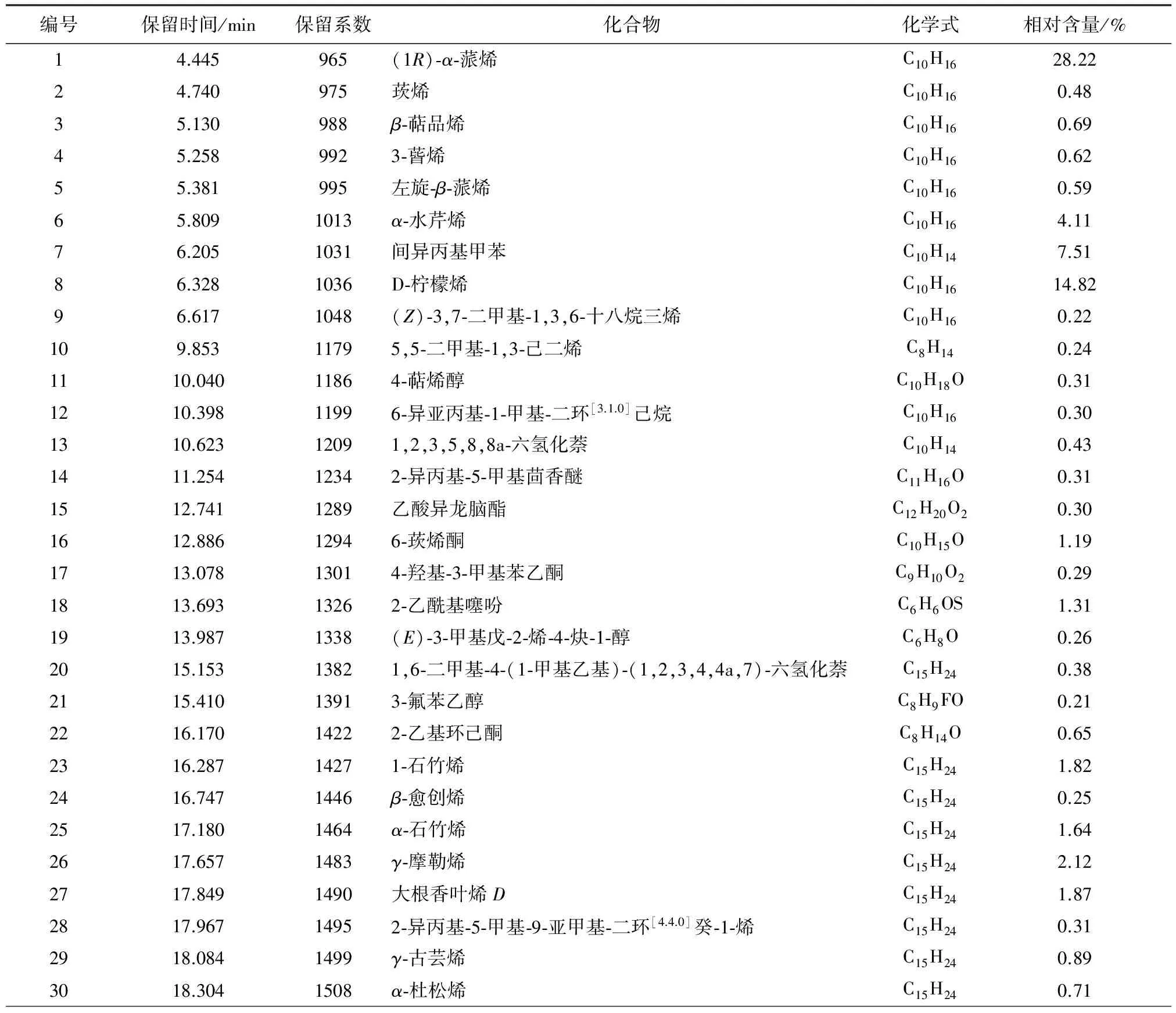
表1 南美蟛蜞菊花挥发油成分及其含量测定结果
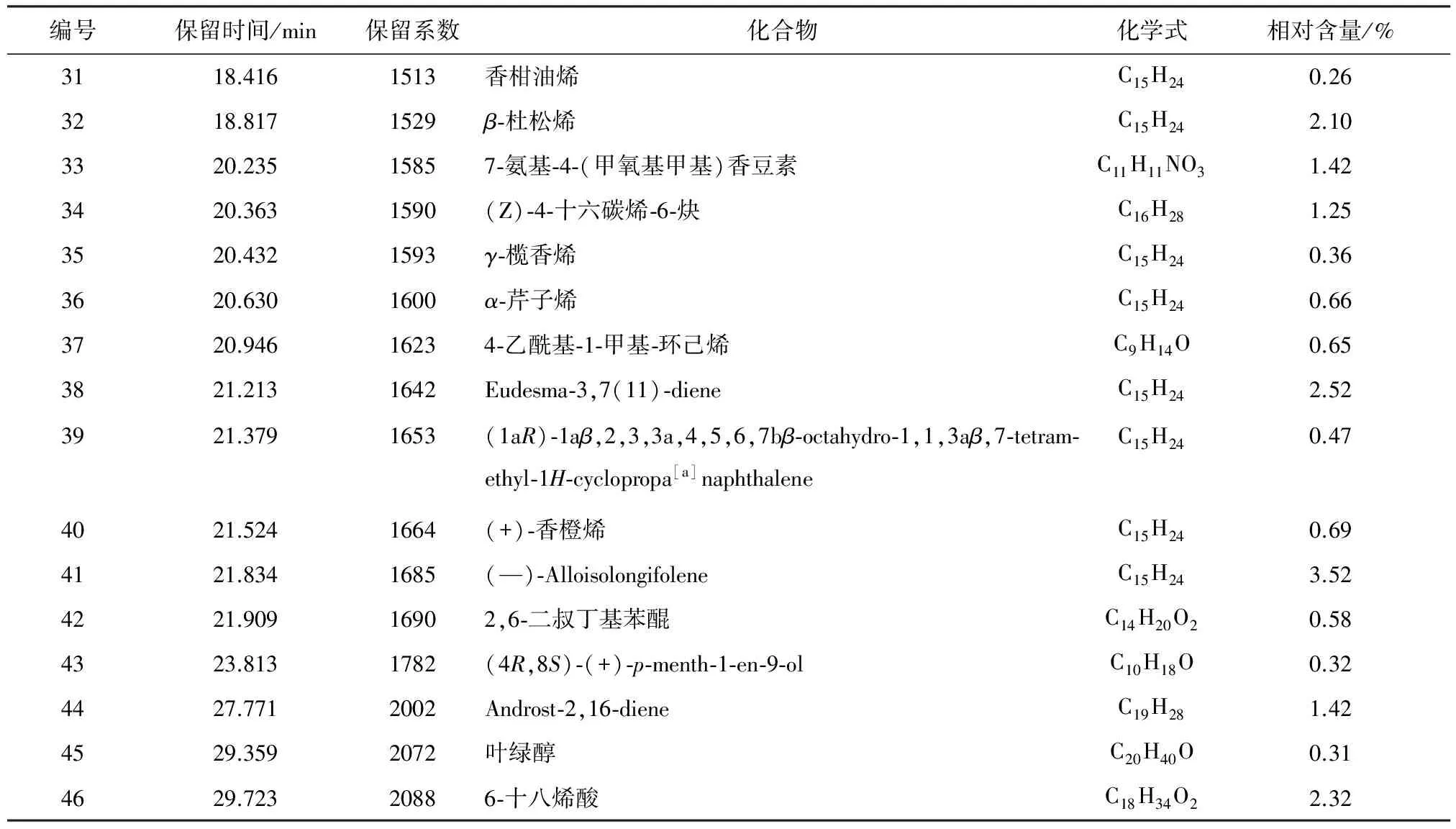
续表
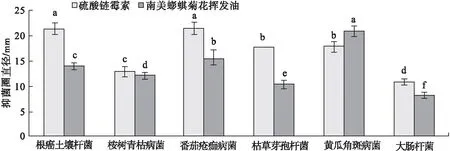
图2 南美蟛蜞菊花挥发油的抗细菌活性
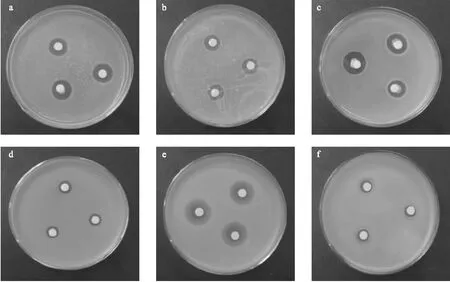
注:根癌土壤杆菌(a),桉树青枯病菌(b),番茄疮痂病菌(c),枯草芽孢杆菌(d),黄瓜角斑病菌(e),大肠杆菌(f)图3 南美蟛蜞菊花挥发油对不同供试细菌的抑制活性
3 讨论
外来植物入侵已成为全球性问题,我国是外来植物入侵严重的国家之一。据统计,我国已知外来入侵植物达352种[1,9,26];至2010年,广东省外来入侵植物有99种[7]。外来入侵植物不仅破坏生态系统,威胁本地物种的生存,导致生物多样性丧失,还严重威胁着农林业生产的发展,甚至直接影响人类健康[9,11,26]。本研究从广州的南美蟛蜞菊花挥发油中共鉴定出46个组分,占总相对含量的91.90%,其中主要成分为(1R)-α-蒎烯、D-柠檬烯、间异丙基甲苯和α-水芹烯。南美蟛蜞菊虽为入侵植物,但具有清热解毒、凉血止血、消炎退肿、利咽止咳等功效[2,4,24,27-29]。外来入侵植物产生的生态化学物质也是优良的植物保护剂,具有较好的开发利用价值[9]。南美蟛蜞菊挥发油含有大量芳香族类化合物,尤其是萜类化合物,其主要成分α-蒎烯有明显镇咳和祛痰功能,并有抗真菌(如白念珠菌)、驱虫、杀虫、除螨的作用[30];水芹烯广泛存在于各种精油和香精香料中[31];D-柠檬烯可镇咳、祛痰、抗菌,对肺炎双球菌、甲型链球菌、卡他双球菌、金黄色葡萄球菌有很强的抑制作用[32]。本实验的研究结果也表明南美蟛蜞菊花挥发油对黄瓜角斑病菌和番茄疮痂病菌表现出较强的抑制活性,对桉树青枯病菌抑制活性与阳性对照硫酸链霉素相差不大,可能与挥发油中的主要成分有关。如果将南美蟛蜞菊开发成植物源农药进行利用,就能变害为利,既可控制入侵植物的危害,又能生产出低毒、低残留、低耐药性等对环境安全的无公害植物源农药产品[9],本研究结果将为南美蟛蜞菊的进一步开发和应用提供一定的科学依据。
参考文献:
[1] DAI Z C,QI S S,MIAO S L,et al.Isolation of NBS-LRR RGAs from invasiveWedeliatrilobataand the calculation of evolutionary rates to understand bioinvasion from a molecular evolution perspective [J].BiochemSystEcol,2015(61):19-27.
[2] REN H,XU Q L,LUO Y,et al.Two newent-kaurane diterpenoids fromWedeliatrilobata(L.) Hitchc [J].PhytochemLett,2015(11):260-263.
[3] QI S S,DAI Z C,MIAO S L,et al.Light limitation and litter of an invasive clonal plant,Wedeliatrilobata,inhibit its seedling recruitment [J].Ann Bot,2014,114(2):425-433.
[4] 沈卓豪,刘磊,韩姣姣,等.南美蟛蜞菊花挥发油GC-MS分析及抗菌活性研究[J].中国实验方剂学杂志,2014,20(7):54-58.
[5] 吴清韩,朱慧,马瑞君,等.入侵植物南美蟛蜞菊营养器官的形态解剖研究[J].生态环境学报.2014,23(6):958-961.
[6] IUCN,2010.Sphagneticolatrilobata.In:100 of the world's worst invasive alien species [DB/OL].IUCN/SSC Invasive Species Specialist Group (ISSG) (2010-10-04).http://www.issg.org/database/species/search.asp?st=100ss.
[7] 黄泽文,郑庭义.广东地区外来植物南美蟛蜞菊入侵的历史阶段与特点[J].广东农业科学,2013(4):68-71.
[8] 孙见凡,吴易,吴鹏飞,等.入侵植物南美蟛蜞菊不同组织部位浸提物的化感作用研究[J].广东农业科学,2013(23):74-78.
[9] 邓业成,李瑞钰,杨林林,等.加拿大一枝黄花和南美蟛蜞菊精油的杀虫活性及化学成分[J].广西师范大学学报(自然科学版).2014(2):122-129.
[10]苏琴,杜晨,郑安妮,等.三裂叶蟛蜞菊入侵对土壤微生物和pH的影响[J].湖北农业科学,2013,52(11):2543-2546.
[11]DAI Z C,FU W,QI S S,et al.Different responses of an invasive clonal plantWedeliatrilobataand its native congener to gibberellin:implications for biological invasion [J].JChemEcol,2016,DOI:10.1007/s10886-016-0670-6.
[12]许华,魏宇昆,蒋梦娇,等.2种草本植物对三裂叶蟛蜞菊化感物质胁迫的响应[J].中国农学通报,2011,27(28):158-162.
[13]欧少云.南美蟛蜞菊毛状根乙醇提取液对种子萌发的影响[J].中国农学通报.2013,16(4):58-61.
[14]朱慧,吴双桃.三裂蟛蜞菊入侵对植物多样性的影响及其根提取物的抑草效应[J].西北农业学报,2012,21(8):38-44.
[15]江贵波,陈实,曾任森.入侵物种三裂叶蟛蜞菊挥发物质的鉴定及其抗菌活性[J].中国生态农业学报,2008,16(4):905-908.
[16]朱彩云,梁明龙,郭景,等.蟛蜞菊粗提物对玉米螟拒食作用研究初报[J].植物保护科学,2006,22(1):264-265.
[17]陈泽坦,符悦冠,骆焱平.蟛蜞菊抽提物对花生蚜忌避及毒杀作用[J].热带作物学报,2003,24(3):51-53.
[18]KOHEIL M A.Study of the essential oil of the flower-heads ofWedeliatrilobata(L.) Hitchc [J].Al-AzharJPharmSci,2000(26):288-293.
[19]林碧芬,黄志坚.南美蟛蜞菊挥发油的抑菌活性及成分分析[J].中国畜牧兽医,2011,38(11):69-72.
[20]LOU J,MAO Z,SHAN T,et al.Chemical composition,antibacterial and antioxidant properties of the essential oils from the roots and cultures ofSalviamiltiorrhiza[J].JEssentOilBearPl,2014,17(3):380-384.
[21]WANG J,LIU H,GAO H,et al.Antimicrobial and antioxidant activities of the flower essential oil ofHalimodendronhalodendron[J].NatProdCommun.2011,6(11):1749-1753.
[22]VAN DEN DOOL H,KTATZ P D.A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography.JChromatogra,1963(11):463-471.
[23]赵文越,王雪青,邵明辉,等.水蒸气蒸馏法制备板栗花精油及其抑菌活性[J].食品研究与开发,2014,35(13):38-43.
[24]杨东娟,郭守军,陈远平,等.南美蟛蜞菊叶挥发油化学成分分析[J].西北林学院学报,2010,25(1):131-134.
[25]LI D,LIANG Z,GUO M,et al.Study on the chemical composition and extraction technology optimization of essential oil fromWedeliatrilobata(L.) Hitchc [J].Afr J Biotechnol,2012,11(20):4513-4517.
[26]舒易星,施祖荣,王连水,等.外来入侵植物及其生物防治[J].仲恺农业工程学院学报, 2013,26(1):64-71.
[27]BALEKAR N,NAKPHENG T,SRICHANA T.Wound-healing potential of grandiflorenic acid isolated fromWedeliatrilobata(L.) leaves [J].SongklanakarinJSciTechnol,2013,35(5):537-546.
[28]COE F G,ANDERSON G J.Screening of medicinal plants used by the Garifuna of Eastern Nicaragua for bioactive compounds [J].JEthnopharmacol,1996,53(1):29-50.
[29]MA B J,WEN C N,GAO Y,et al.Ent-kaurane diterpenoids from the plantWedeliatrilobata[J].NatProdBiopros,2013,3(3):107-111.
[30]杨永利,郭守军,马瑞君.乌榄叶挥发油化学成分分析[J].广西植物,2007,27(4):662-664.
[31]刘亚,李茂昌,张承聪,等.香樟树叶挥发油的化学成分研究[J].分析试验室,2008,27(1):88-92.
[32]王恒山,欧尚瑶,潘英明,等.毛两面针挥发油化学成分[J].广西植物,2006,26(1):105-106.
