SO2在氧化物颗粒表面非均相反应研究
2018-06-28张婉婷叶芝祥袁小燕
张婉婷,叶芝祥,袁小燕
( 1. 成都信息工程大学,成都 610225;2. 四川省环境保护科学研究院,成都 610041 )
1 前 言

目前关于SO2在颗粒物上的非均相反应主要是单一氧化物颗粒,因此,本文选取多种氧化物颗粒,在同一条件下比较分析不同氧化物颗粒对大气中硫酸盐的贡献量,更具有实际意义。同时,大气颗粒物组成类型又与土壤的背景值等因素密切相关[12],土壤中矿物颗粒物Si和Al氧化物总量占矿物组分的63%以上,其余包括Fe、Mg、Ca、Zn、Mn、Ti等金属氧化物,因此,选取了SiO2、γ-Al2O3、Fe2O3、CaO、MnO2、CuO、MgO、TiO2和ZnO九种颗粒物,使用比表面积分析仪对九种氧化物颗粒进行表征,利用傅里叶变换红外光谱仪(DRIFTS)监测了氧化物颗粒表面硫酸盐生成量,测定了反应摄取系数,同时探讨了反应机理。
2 实验部分
实验所用试剂均为分析纯,SiO2和ZnO颗粒购自天津市科密欧化学试剂有限公司,其余氧化物颗粒均购自成都市科龙化工试剂厂,SO2(标准气体,摩尔浓度为100.4×10-6)、N2和O2(体积分数 ≥ 99.999%)均购自西南化工研究设计院。
使用漫反射傅里叶变换红外光谱仪(Thermo Scientific Nicolet iS50)动态监测,仪器采用MCT-A检测器;ZnSe窗口;150光阑;64次扫描;分辨率为4cm-1,原位DRFTIS反应器示意图见文献[3]。漫反射红外光谱图中,样品表面生成物浓度与K-M函数具有更好的线性关系,因此本实验最终使用K-M格式[13]。
使用质量流量控制器(MFCS)配制30 ppm SO2和21% O2混合气(N2做稀释气)。反应在常温常压、无光照条件下进行,放样品前用N2吹扫管路及反应器0.5h,放入样品后再用N2吹扫0.5h,除去反应器内的空气和样品表面的吸附水,采集背景光谱,通入混合气体后开始反应。
3 结果与讨论
3.1 SO2在氧化物颗粒表面非均相反应
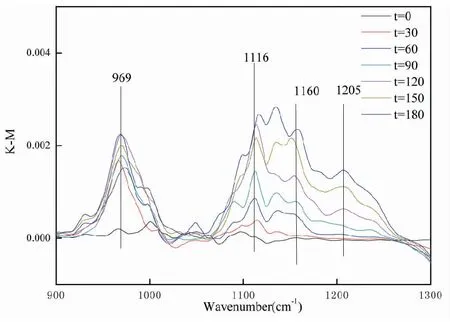
图1 SO2在γ-Al2O3颗粒表面反应的DRIFTS光谱Fig.1 DRIFTS spectra of SO2 reaction on the surface of γ-Al2O3 particles
图2所示为SO2在MgO颗粒表面反应的光谱图,图中出现1 165cm-1、1 196cm-1两个吸收峰,是Mg与硫酸盐形成的单齿配位,954cm-1为游离的亚硫酸盐吸收峰,此时954cm-1吸收峰强于1 165cm-1吸收峰,包含硫酸盐的v1振动对954cm-1吸收峰的贡献。
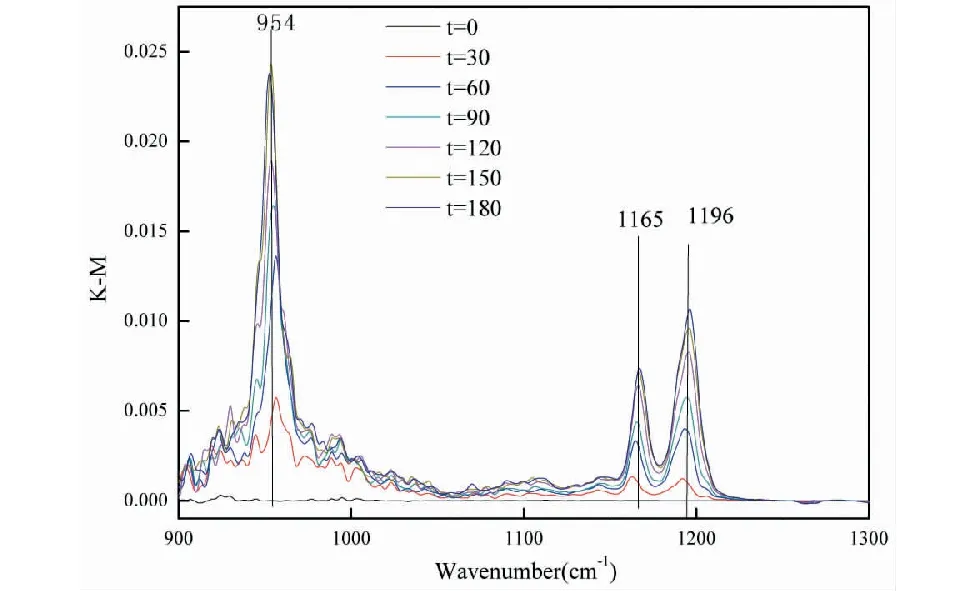
图2 SO2在MgO颗粒表面反应的DRIFTS光谱Fig.2 DRIFTS spectra of SO2 reaction on the surface of MgO particles
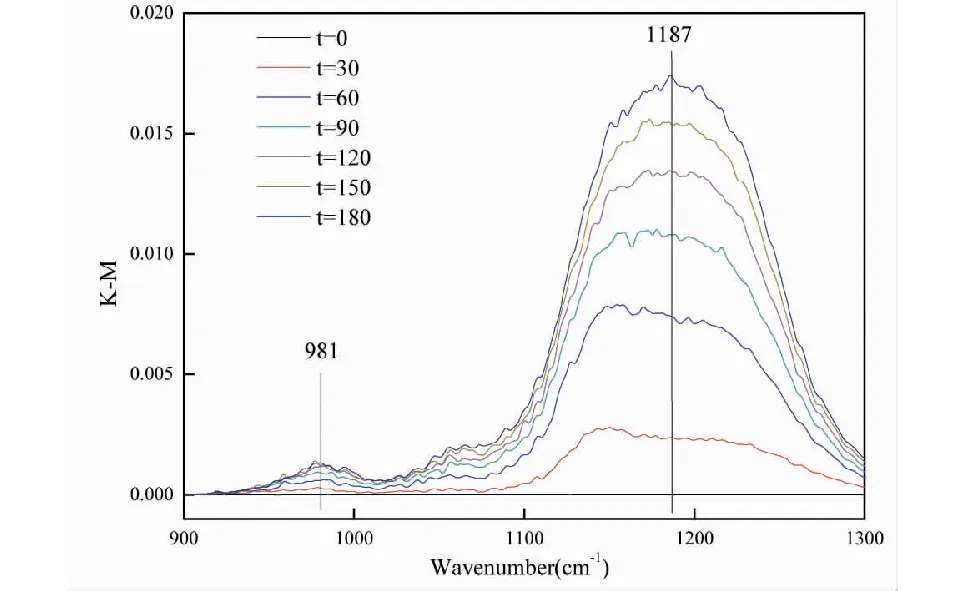
图3 SO2在MnO2颗粒表面反应的DRIFTS光谱Fig.3 DRIFTS spectra of SO2 reaction on the surface of MnO2 particles
图4为SO2在Fe2O3颗粒表面反应的光谱图,图中在1 271cm-1、1 161cm-1、1 026cm-1生成硫酸盐双齿配位,归属于硫酸盐的v3振动。
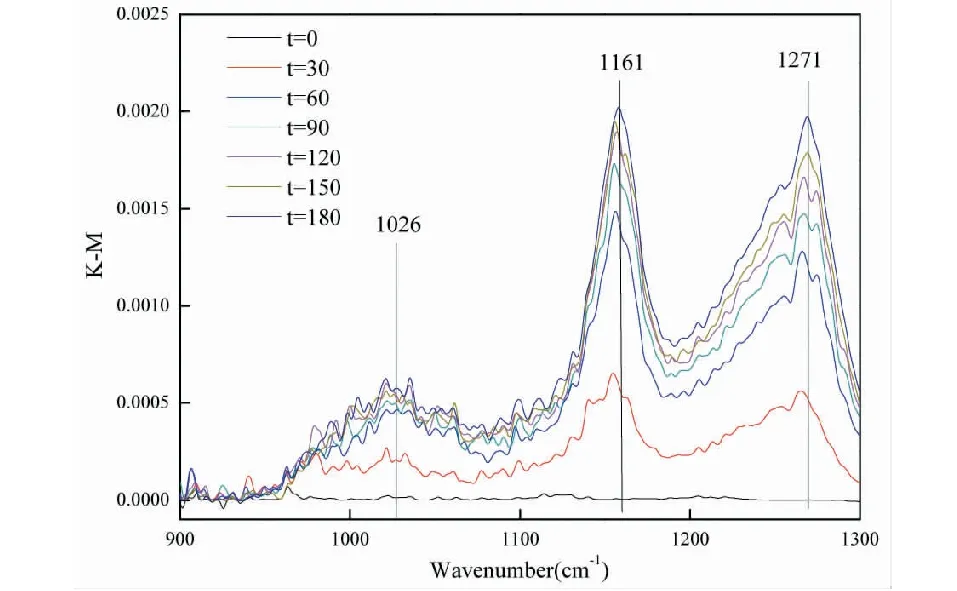
图4 SO2在Fe2O3颗粒表面反应的DRIFTS光谱Fig.4 DRIFTS spectra of SO2 reaction on the surface of Fe2O3 particles

图5 SO2在TiO2颗粒表面反应的DRIFTS光谱Fig.5 DRIFTS spectra of SO2 reaction on the surface of TiO2 particles
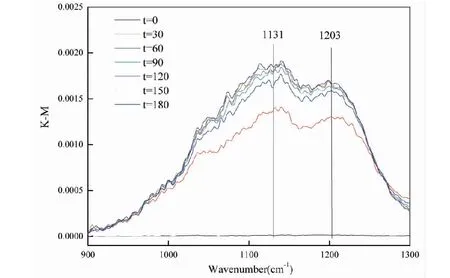
图6 SO2在CuO颗粒表面反应的DRIFTS光谱Fig.6 DRIFTS spectra of SO2 reaction on the surface of CuO particles
3.2 亚硫酸盐生成



图7 SO2在CaO颗粒表面反应的DRIFTS光谱Fig.7 DRIFTS spectra of SO2 reaction on the surface of CaO particles
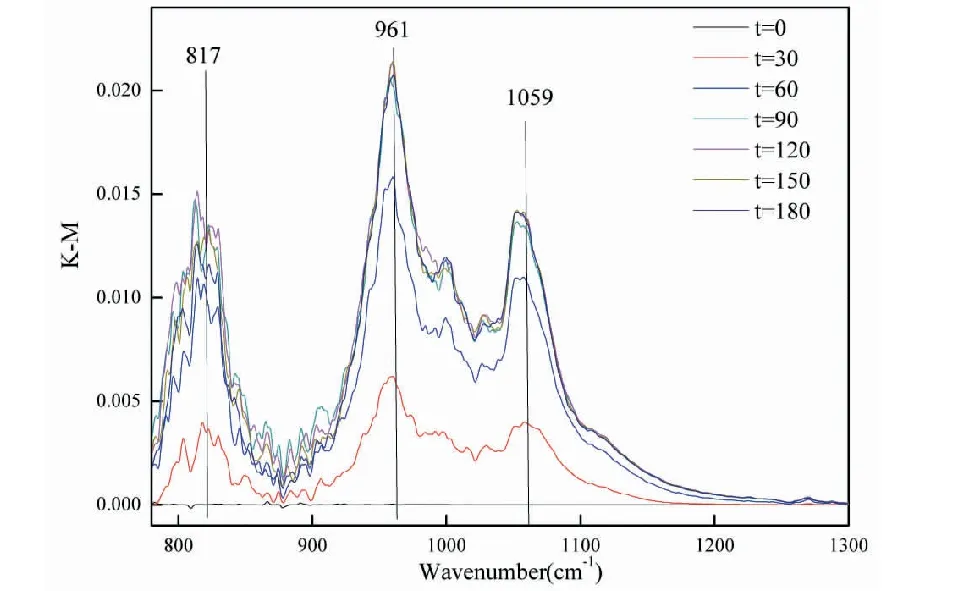
图8 SO2在ZnO颗粒表面反应的DRIFTS光谱Fig.8 DRIFTS spectra of SO2 reaction on the surface of ZnO particles
3.3 硫酸盐生成量
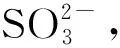
SO2在CuO颗粒表面初始阶段生成硫酸盐的速率最快,并在30min左右达到平衡。Fe2O3颗粒
在80min左右达到平衡,在TiO2颗粒表面生成硫酸盐的量最少,在MnO2颗粒表面15min前反应速率较慢,随后速率迅速加快,而且在MnO2颗粒表面硫酸盐生成量远大于其他氧化物颗粒,因为MnO2颗粒表面活性点位较多,以催化剂形式存在,可以使反应持续性进行,3h内没有达到饱和。

图9 硫酸盐生成量随时间变化趋势Fig.9 Variations of the sulfate production with time
4 摄取系数的测定

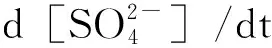
使用BET(SSA-4200孔径及比表面积分析仪)测得氧化物颗粒比表面积,作为计算反应摄取系数的基础,其大小如表1所示。

表1 样品比表面积Tab.1 The specific surface area of samples (m2/g)


表2 氧化物颗粒反应摄取系数Tab.2 Oxide particles reaction obsorb coefficient
由表2可知,摄取系数大小为:MnO2> MgO > γ-Al2O3> Fe2O3> CuO > TiO2,由于非均相反应的复杂性,γrxn反应摄取系数仅代表SO2在颗粒物表面生成硫酸盐的速率,不考虑它影响因素。
5 SO2在氧化物颗粒表面反应机理初探
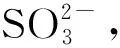

(1)
(2)
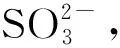
(3)
(4)


(5)

6 结 论
本实验选择了9种氧化物颗粒,在同一条件下比较分析不同氧化物颗粒对大气中硫酸盐贡献量的大小和配位方式,比较颗粒物之间的差异,具有实际意义。得出了以下结论:
6.1 常温、干态无光照条件下,SO2在SiO2颗粒表面没有发生吸附反应现象,其余8种氧化物颗粒表面均有产物生成。
6.2 SO2在γ-Al2O3、MgO、MnO2颗粒表面反应生成亚硫酸盐和硫酸盐,Fe2O3、TiO2和CuO颗粒表面反应生成硫酸盐,CaO、ZnO颗粒表面反应生成亚硫酸盐。其中,γ-Al2O3、Fe2O3、TiO2颗粒表面为硫酸盐双齿配位,MgO、CuO颗粒表面为单齿配位,MnO2颗粒表面仅为游离的硫酸盐。
参考文献:
[1] Usher C R, Michel A E, Grassian V H. Reactions on mineral dust [J]. Chemical Reviews, 2003, 103 (12) : 4883-4940.
[2] Fu H, Wang X, Wu H, et al. Heterogeneous uptake and oxidation of SO2on iron oxides [J]. Journal of Physical Chemistry C, 2007, 111 (16) : 6077-6085.
[3] Li L, Chen Z M, Zhang Y H. Heterogeneous oxidation of sulfur dioxide by ozone on the surface of sodium chloride and its mixtures with other components [J]. Journal of Geophysical Research Atmospheres, 2007, 112 (18) : 2453-2464.
[4] Zhang X Y, Zhuang G S, Chen J M, et al. Heterogeneous reactions of sulfur dioxide on typical mineral particles [J]. Journal of Physical Chemistry B, 2006, 110 (25) : 12588-12596.
[5] Shang Y, Zhu T, Li Y, et al. Size-dependent hydroxyl radicals generation induced by SiO2ultra-fine particles: The role of surface iron [J]. Science in China Series B: Chemistry, 2009, 52 (7) : 1033-1041.
[6] 崔虎雄, 成天涛, 陈建民, 等. SO2在Fe2O3颗粒表面不同温度下非均相反应的实验模拟[J]. 物理化学学报, 2008, 24(12) : 2331-2336.
[7] 尚 静, 李 佳, 朱 彤. SO2在TiO2颗粒物表面的非均相反应[J]. 中国科学:化学, 2010, 40(12) : 1780-1786.
[8] Ullerstam M, Vogt R, Langer S, et al. The kinetics and mechanism of SO2oxidation by O3on mineral dust [J]. Physical Chemistry Chemical Physics, 2002,4 (19) : 4604-4699.
[9] 吴洪波, 陈建民, 薛华欣, 等. 二氧化硫与大气颗粒物的复相反应研究[J]. 过程工程学报, 2004, 4(s1) : 818-822.
[10] José A R, Tomas J, Sanjay C, et al. Reaction of SO2with ZnO(000(1)over-bar-)-O and ZnO powders: Photoemission and XANES studies on the formation of SO3and SO4[J]. Surface Science, 1999, 442(3) : 400-412.
[11] Sanjay C, José A R, Tomas J, et al. Surface chemistry of SO2on Zn and ZnO: Photoemission and molecular orbital studies [J]. Journal of Physical Chemistry B, 1998, 102(36) : 7033-7043.
[12] 刘永春, 贺 泓. 大气颗粒物化学组成分析[J]. 化学进展, 2007,(10) : 1620-1631.
[13] 翁诗甫. 傅里叶变换红外光谱仪[M]. 北京:化学工业出版社, 2005.
[14] Zhang X, Zhuang G, Chen J, et al. Heterogeneous reactions of sulfur dioxide on typical mineral particles[J]. Journal of Physical Chemistry B, 2006, 110(25) : 12588-12596.
[15] 李 雷. 二氧化硫在颗粒物表面的非均相臭氧氧化[D]. 北京:北京大学, 2004.
[16] T. Visser. Molecular spectroscopy of oxide catalyst surfaces [J]. Vibrational Spectroscopy, 2003, 33(1) : 223-223.
[17] Hug S J. In situ fourier transform infrared measurements of sulfate adsorption on hematite in aqueous solutions [J]. Journal of Colloid and Interface Science, 1997, 188(2) : 415-422.
[18] Derek P, Robert G F, Donald L S. An in situ ATR-FTIR investigation of sulfate bonding mechanisms on goethite [J]. Journal of Colloid and Interface Science, 1999,218(1) : 289-299.
[19] 姬亚芹, 朱 坦, 白志鹏, 等. 大气颗粒物源解析土壤风沙尘成分谱研究进展[J]. 城市环境与城市生态, 2005,(5) : 3-5.
[20] GAO. Heterogeneous reactions of sulfur dioxide on dust [J]. Science in China, 2006, 49(3) : 273-280.
[21] 李宏军, 朱 彤, 李 雷, 等. 大气化学非均相反应摄取系数的测定[J]. 环境化学, 2006, 25(3) : 266-272.
[22] Usher C R. A laboratory study of the heterogeneous uptake and oxidation of sulfur dioxide on mineral dust particles [J]. Journal of Geophysical Research. 2002, 107(D23) : ACH-1-ACH 16-9.
