不同环境条件下联合共生固氮菌对小麦种子生长的影响
2018-06-28邓天天侯宇梦
邓天天,陈 曦,侯宇梦
(河南工程学院,河南 郑州 451191)
不同环境条件下联合共生固氮菌对小麦种子生长的影响
邓天天,陈 曦*,侯宇梦
(河南工程学院,河南 郑州 451191)
摘 要:从13株小麦根际筛选得到3种联合共生固氮菌,通过单因素批次试验确定了不同菌种的培养时间、温度、pH、葡萄糖浓度及氮素浓度的适宜范围,得出单个菌株和组合菌组生长效果最佳的实验条件,并进一步测定单个菌株和组合菌组对小麦种子生长状况的影响。研究显示,在pH7,温度35℃,NaCl浓度5%,葡萄糖浓度10%,氮素浓度3g·L-1的条件下培养36h时,组合菌组作用于小麦种子的效果优于单个菌株的作用效果,相较于空白组,发芽率平均提高了4%,发芽势、发芽指数也均有所提高。组合菌组能更好地适应多变的环境,稳定发挥作用,有利于获得高产。
关键词:联合共生固氮菌;生长曲线;小麦
有些细菌具有直接固定大气中的氮,使气态氮转化为铵态氮以供植物吸收利用,且能改善土壤性能,不产生污染等优势。因此,在土壤环境污染,能源空间减少和农业集约化发展的背景下,生物固氮应用于农业已成为必然的趋势[1]。
生物固氮包括豆科植物固氮和非豆科植物固氮两大类。豆科植物能形成稳定根瘤结构而非豆科植物无法形成稳定结构。自“大气中氮气能够被豆科植物的根瘤固定”在1886年被法国学者Hellriegel首次证实以来[2],人们经过研究基本掌握了豆科植物固氮的机理、基因如何表达等原理。然而,另一种固氮形式,非豆科植物的联合共生固氮的研究则晚于豆科植物,仅有几十年的历史[3]。随着近些年微生物等相关学科的发展,国内外联合共生固氮菌的研究已从筛选、纯化、基本理化性质测定逐渐向分子水平发展[4]。
生物固氮研究过程分为3个阶段[2]。1886—1960年,实验材料为完整细胞的细胞水平阶段;1960年,美国人Carnahan等氮还原氨实验的成功,标志着从细胞水平阶段进入无细胞水平阶段;1970年,Burns等钼铁蛋白制剂的提纯成功,标志着进入分子生物学阶段。我国生物固氮的研究落后于发达国家,但近年来我国也取得了显著的成绩。1983年,Kapulnik等[1]实验证实,接种固氮螺旋菌有利于小麦生长及干质量、子粒产量的增加。宋未等[2]通过一定技术将固氮细菌导入水稻内,并成功获得再生植株,其实验结果表明固氮菌可以在水稻体内进行联合共生固氮。1997年,关秀清等[3]从内蒙古羊草中筛选得到2株联合共生固氮菌,研究显示菌株在好氧条件下固氮效果最好。2004年,姚拓等[3]从燕麦中筛选得到8株根际联合共生固氮菌,菌株分布在根系表面,根系附近的土壤中。2003年,徐兴良等[5]研究小麦幼苗在联合固氮菌与根瘤菌协同作用下的生长情况,为草原地区联合共生固氮菌提供了相关依据。在国家863项目研究背景下,我国对4株根际联合固氮菌进行了基因组测序工作,并成功构建新型工程菌株[4]。
我国是小麦生产大国,小麦在我国农业的地位极其重要,研究小麦与联合共生固氮菌的关系以及联合共生固氮菌对小麦的作用情况,在实际生产中具有重大意义。研究表明,联合共生固氮菌广泛存在于非豆科植物的根际、根表和根皮层中[6]。本实验以从小麦根际筛选出来的3种固氮菌作为研究对象,通过单因素批次实验研究单个菌株和组合菌组的适宜生长范围,确定单个菌株与组合菌组之间差异性及各自最适合生长的条件。进一步研究小麦种子在不同菌株不同条件下的生长势。通过组合菌组的使用,在菌株处理过的种子发芽率、存活率以及提高了种子竞争力方面提供数据,为小麦的增产提供依据。
1 材料与方法
1.1 菌株来源
在郑州市新郑市郭店乡刘庄农田中采集到小麦13株,从13株小麦根际筛选联合共生固氮菌,最终选出3株菌株,根据菌落的大小命名为M、L、S。
1.2 单因素批次实验
1.2.1 不同时间对菌株生长的影响
将M、L、S三种菌株在低氮Doberiner液体培养基中培养36h。单个菌株各取5mL作为组合菌株,单个菌株取10mL,接种到液体培养基中。在35℃,250r·min-1下,恒温摇床振荡培养,以12h为测定时间间隔。测定D600吸光值并绘图。
1.2.2 不同温度对菌株生长的影响
配置低氮Doberiner液体培养基,分装在50mL锥形瓶中。灭菌后,单个菌株取1mL接种,3个菌株各取0.5mL作为组合菌组接种培养,设置3组平行实验。温度分别取:15、20、25、30、35℃。36h后测定D600吸光值并绘图。
1.2.3 不同pH对菌株生长的影响
配置低氮Doberiner液体培养基,用NaOH调节pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0,分装到每瓶50mL的锥形瓶中。灭菌后,单个菌株取1mL接种,3个菌株各取0.5mL作为组合菌组接种培养。每个处理设置3组平行,36h后测定D600吸光值并绘图。
1.2.4 不同浓度NaCl对菌株生长的影响
将不同质量的NaCl加入低氮Doberiner液体培养基,调节浓度分别为0%、3%、6%、9%、12%,分别装入50mL的锥形瓶中。灭菌后,单个菌株取1mL接种,单个菌株各取0.5mL作为组合菌组接种培养。每个处理设置3组平行,36h后测定D600吸光值并绘图。
1.2.5 不同浓度葡萄糖对菌株生长的影响
将不同质量葡萄糖加入低氮Doberiner液体培养基,浓度分别调节为0%、5%、10%、15%、20%,分别装入50mL的锥形瓶中。灭菌后,单个菌株取1mL接种,3个菌株各取0.5mL作为组合菌组接种培养。每个处理设置3组平行,36h后测定D600吸光值并绘图。
1.2.6 不同浓度NH4Cl对菌株生长的影响
向低氮Doberiner液体培养基加入NH4Cl,调节浓度分别为0、2.0、4.0、6.0、8.0、10.0g·L-1,分装到每瓶50mL的锥形瓶中。灭菌后,单个菌株取1mL接种,单个菌株各取0.5mL作为组合菌组接种培养。每个处理设置3组平行,36h后测定D600吸光值并绘图。
1.2.7 菌株对小麦种子的实验
选取小麦种子千粒质量为40~50g,外观丰满的同一批种子。首先用2% NaClO浸泡30min,浸泡后立即用无菌水洗净NaClO残液,然后用10% H2O2浸泡种子20s,立即用无菌水冲洗直到H2O2无残留。
在35℃条件下,将菌株培养36h,在5000r·min-1,4℃高速离心机中离心10min,弃去上清液,在下沉物中加低氮液体培养基制成菌剂,留作备用。
实验组为接种菌株的低氮液体培养基,对照组为不接菌株的低氮液体培养基,将灭菌过的种子接种于培养基培养。测定种子发芽率、发芽势及发芽指数,测量幼苗高以及次生根长度。种子相关实验结果所需的温度、时间、pH等均是在单因素批次实验测定得到的最适条件。
2 结果与讨论
2.1 正交实验结果分析
由图1可知,菌株在36h左右达到峰值,此时细菌处于稳定期。M、L、S三种菌株及其组合菌组皆呈现先上升后下降的趋势,其中,L、S菌在时间的变化下,变化幅度和速率基本一致,二者的最大峰值比M菌大一些。组合菌组中峰值相差无几,但ML菌组在下降阶段变化较慢,比其他两组更具有优势。随后进入衰亡期,培养基中的营养物质,溶解氧等必需的因素含量减少,导致菌株开始死亡,D600值下降。蒋玮等[7]得到的高效固氮菌HY1141在培养36h条件下产生的絮凝剂絮凝率达96.4%。刘轶秋等[8]在菌株支原体世代时间测定中显示,滑液支原体菌株在培养36~54h后达到稳定期,猪鼻支原体菌株在培养18~126h后达到稳定期。陶令霞等[9]研究结果表明,固氮菌NT06在16~20h为稳定期。本实验结果与其相一致,且3种组合菌组均比单个菌株的增长幅度和速率以及峰值大,说明组合菌株之间没有出现相互抑制的作用,均可以相互影响且效果比单个菌株要好。
由图2可知,在较大温度段内菌株均可存活,菌株在低温或高温下的生长受到很大的影响。35℃为菌株最适温度,此时菌株生长达到峰值,随后开始降低。组合菌组与单个菌株相比,没有明显的优势,组合菌组在40℃时比单个菌株D600值大,说明组合菌组比单个菌株耐高温。蒋玮等[7]实验中高效固氮菌HY1141最佳培养温度为35℃。李永兴等[10]在玉米根际得到的日勾维肠杆菌最适生长温度为30℃。刘荣昌等[11]在小麦种子中筛选得到A、C两种菌株在5~40℃都有固氮酶活力,适宜温度分别为36和28℃,45℃不生长。研究表明,一般菌株最佳生长范围在28~37℃,本实验所得结果也在此范围内。大部分生命活动依赖于酶的作用,而温度主要影响菌株体内酶的活性,本实验结果表明,组合菌组在40℃时比单个菌株D600值大,原因可能是组合菌组相互影响,使酶的耐高温能力提高。

图1 不同时间下菌株的生长曲线Fig.1 Growth curves of strains at different time

图2 不同温度下菌株的生长曲线Fig.2 Growth curves of strains at different temperatures
不同pH下菌株生长曲线如图3所示。pH影响细菌中酶的活性,pH对菌株影响的实验很多,张志强等[12]实验培养基最佳条件pH值为6.0~7.0。张丽梅[13]研究结果表明,菌株在pH值为4.5~8.5条件下均有较强的活性,并可调节自身代谢使培养液趋于中性。郭霞等[14]研究结果表明,病菌可以在pH值为3~11内生长,且病菌有利生长条件为偏酸性。汤春梅等[16]研究表明,小麦根际固氮菌在偏碱性条件下生长良好。本实验研究结果与上述实验相符。pH值为3、4时菌株D600值基本不变,说明酸性条件下菌株基本不能生长或生长极其缓慢。单个菌株在pH值为6.3左右达到峰值,组合菌组在pH值为7.0左右达到峰值,说明组合菌组比单个菌株更适应碱性。本实验中,组合菌组和单个菌株在pH值为6.0~8.0生长良好,说明菌株可在弱碱或弱酸的条件下良好生长。本实验结果与上述结果有些偏差,可能原因是菌株自身会产生缓冲物质来实现自动调节、使用的植物种类不同等。
由图4可知,菌株生长曲线先升后降,单个菌株和组合菌组具有相同的变化趋势。在不含NaCl的培养基中,菌株也可以生长,在NaCl浓度为5%左右达到峰值,浓度为9%以后菌株基本停止生长。在NaCl浓度为0~6%范围内组合菌组比单个菌组D600值大,说明组合菌组的耐盐性强于单个菌株。李永兴等[10]实验表明,57-7菌株对NaCl有较强的耐受力,NaCl浓度为2.5%时,能保持83%的固氮酶活性。张丽梅[13]研究结果表明,在较高的渗透压下菌株能存活,NaCl浓度高于2%时,菌株生长受到抑制,不利于菌株生长。刘欣林[15]研究结果表明,小麦固氮菌NaCl浓度6%时为最适NaCl浓度。NaCl可以影响渗透压,渗透压因NaCl浓度改变而改变,从而影响细胞内液。本实验NaCl浓度较大时,生长曲线变化幅度很大,表明NaCl浓度的变化对菌株生长具有极大的影响。

图3 不同pH下菌株的生长曲线Fig.3 Growth curves of strains under different pH
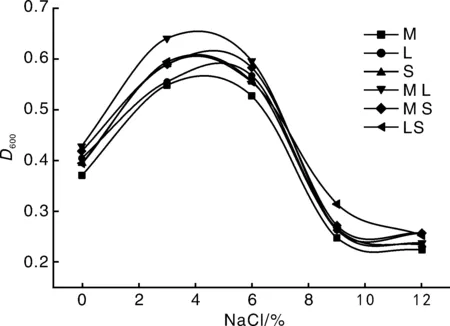
图4 不同NaCl浓度下菌株的生长曲线Fig.4 Growth curves of strains under different NaCl concentrations
由图5可知,在不同葡萄糖浓度下,单个菌株和组合菌组的变化差别不大,在葡萄糖浓度为0条件下,也有菌株存在。葡萄糖作为细菌生长必需的营养物质,其作用不言而喻。随着葡萄糖浓度的增加,菌株的生长量也不断增多,葡萄糖最适生长浓度为10%,之后生长量急剧下降。组合菌组比单个菌株生长量略多,在葡萄糖浓度过低或过高的情况下,菌株的生长受到很大的影响。张丽梅[13]研究表明,菌株在蔗糖、苹果酸、葡萄糖等多种碳源下可以生存。刘欣林[15]研究表明,含糖量10%时,A4生长最旺盛,15%时,H17、A4+H17生长最旺盛。

图5 不同C6H12O6浓度下菌株生长曲线Fig.5 Growth curve of strain under different C6H12O6 concentrations

图6 不同NH4Cl浓度下菌株生长曲线Fig.6 Growth curve of strain under different NH4Cl concentrations
由图6可知,在NH4Cl浓度小于2g·L-1时,不同组合菌组变化趋势相同,浓度超过2g·L-1后差异开始显现。在NH4Cl浓度为3g·L-1左右达到峰值。随后菌株的生长量逐渐下降,说明NH4Cl浓度超过最适浓度后会对菌株的生长繁殖产生抑制作用。张丽梅[13]实验表明,氮源在0.5~1.0mol·L-1浓度下,菌株具有较强的固氮能力。刘欣林[15]实验表明,氮素浓度低于4g·L-1会促进菌株生长,浓度过高反而抑制细菌的生长及繁殖。刑永秀[17]研究表明,氮浓度过大会抑制细菌的生长。本实验结果表明,氮源浓度超过3g·L-1后,菌株生长数量开始下降,随着浓度的不断增大,氮源对菌株的抑制作用越明显。本实验结果与上述研究结果基本一致。
2.2 菌株应用小麦种子的实验分析
2.2.1 菌株对小麦发芽率、发芽势及发芽指数的影响

表1 种子不同发芽指标的比较
由表1可知,单个菌株和组合菌组都能促进种子的生长,M、L、S、ML、MS、LS六组与空白组对照最终发芽率分别提高了4%、3%、1%、6%、5%、6%。对于发芽势及发芽指数来说,实验组比空白组略有提高。王进等[18]研究表明,在不同温度下,种子发芽率可达到90%以上。刘欣林[15]研究结果显示,实验组优于对照组,且发芽率提高5%以上。本实验与其结果相同,使用菌株处理的种子可以提高种子质量及小麦的发芽能力及活力。本实验处理和对照种子发芽率均偏低,可能受到提供的生长条件的影响,实验所选的最适温度、pH、时间等都是在单一变量条件下的最适条件,未确定多因素联合作用下的最佳条件。
2.2.2 菌株对幼苗生长的影响

图7 不同菌株对小麦幼苗株高的影响Fig.7 Effect of different strains on plant height of wheat seedlings

图8 不同菌株对小麦种子次生根生长的影响Fig.8 Effect of different strains on secondary root growth of wheat seedlings
由图7、图8可知,在前期阶段,菌株对幼苗株高和次生根长有一定促进生长的作用。随着时间的推移,作用效果下降,到后期,单个菌株基本上不再起作用,其效果与空白组相当,组合菌组对幼苗的促生长还有一定的作用,但没有前期作用效果好。单个菌株和组合菌组到后期对次生根基本不再起作用。刘荣昌等[11]研究显示,小麦种子接种A、C后,对幼苗株高、干物质量都有促进效果,接种组均要高于空白组。张丽梅[13]研究表明种子接种W12菌株,实验组比对照组提高5%。徐兴良等[5]研究表明,接种不同联合共生固氮菌对小麦幼苗的促进程度不同。田颖[19]实验中使用的菌株H08和菌株H086均对小麦有促进作用,结果显示对幼苗高增加了37.3%和39.2%,对次生根长增加了30.1%和31.9%。本实验结果表明,组合菌组比单个菌株效果好。无论是单个菌株还是组合菌组都对幼苗株高和次生根长有一定的促进效果,说明用菌株处理过的种子可以提高种子的活力和种子的成果率。
3 结论
本实验从小麦根际筛选得到3种根际联合固氮菌,经过多次传代培养,菌株生长并未降低。3种菌株均在36h左右达到稳定期,之后由于环境因子的影响,菌株的生长活力及数量不断下降。3种菌株适应性较强,35℃为菌株最适生长温度,15~40℃均为菌株生长范围;菌株在pH值为7.0左右保持较高的生长速率,且可在pH3.0~9.0生长繁殖;在乳糖、苹果酸、葡萄糖、蔗糖等碳源下菌株均可存活生长;氮素浓度在3g·L-1最宜生长固氮,菌株在氮素浓度为0时,生长缓慢,低氮有助于提高菌株的生长速率;菌株对NaCl耐受性较强,可以在NaCl浓度较高下存活。小麦种子用菌株处理过后,提高了种子的发芽率和相同时间内小麦种子存活率。菌株处理有利于小麦种子发芽、生根等;在发芽势及发芽指数上也显示有利的结果;与菌株结合的种子幼苗高及次生根长度比空白组具有优势,可提高种子的生长能力,竞争能力。
:
[1] LIANG G H,MCHUGHEN A,葛永福.小麦改良的新途径:固氮[J].世界农业,1990(2):20-21.
LIANG G H,MCHUGHEN A,GE Y F.New approaches to wheat improvement:nitrogen fixation[J].WorldAgriculture,1990(2):20-21.(in Chinese)
[2] 陈今朝,向邓云.生物固氮的研究与应用[J].涪陵师专学报,2000,16(2):93-96.
CHEN J Z,XIANG D Y.Study and application of biological nitrogen-fixing[J].JournalofFulingTeachersCollege,2000,16(2):93-96.(in Chinese with English abstract)
[3] 王慧敏,孙海莲,刘亚红,等.牧草联合固氮研究概况[J].畜牧与饲料科学,2014,35(5):40-43.
WANG H M,SUN H L,LIU Y H,et al.Research survey of forages associative nitrogen-fixing[J].AnimalHusbandryandFeedScience,2014,35(5):40-43.(in Chinese with English abstract)
[4] 燕永亮,李力,李俊.根际固氮微生物功能基因组及微生物肥料研究进展[J].中国农业科技导报,2011,13(5):93-101.
YAN Y L,LI L,LI J.Research progress on functional genomics of nitrogen-fixing microorganisms and industrial development of bio-fertilizer[J].JournalofAgriculturalScienceandTechnology,2011,13(5):93-101.(in Chinese with English abstract)
[5] 徐兴良,关秀清,刘公社.联合固氮菌与根瘤菌协同作用对小麦幼苗的影响[J].中国生态农业学报,2003,11(3):66-68.
XU X L,GUAN X Q,LIU G S.Effects of cooperation between associative azotobacteria and rhizobia on wheat seedlings[J].ChineseJournalofEco-Agriculture,2003,11(3):66-68.(in Chinese with English abstract)
[6] 程萍.联合固氮微生物的研究进展[J].湖北民族学院学报(自然科学版),1994,12(2):60-61.
CHENG P.Research progress of the combined nitrogen fixation microorgainism[J].JournalofHubeiInstituteforNationalities(NaturalScienceEdition),1994,12(2):60-61.(in Chinese)
[7] 蒋玮,陈强,肖宁,等.产生物絮凝剂自生固氮菌HY1141的筛选及培养[J].四川农业大学学报,2008,26(1):20-23.
JIANG W,CHEN Q,XIAO N,et al.Screening of bioflocculant-producing Azotobacter HY1141 and optimizing of its culture condition[J].JournalofSichuanAgriculturalUniversity,2008,26(1):20-23.(in Chinese with English abstract)
[8] 刘轶秋,丁家波,李蓓蓓,等.支原体检验用培养基质控菌株的生长曲线与世代时间测定[J].中国兽药杂志,2012,46(12):13-15.
LIU Y Q,DING J B,LI B B,et al.Growth curve and generation time determination of the quality-control strains for mycoplasma detecting medium[J].ChineseJournalofVeterinaryDrug,2012,46(12):13-15.(in Chinese with English abstract)
[9] 陶令霞,夏铁骑,常慧萍.两种测定固氮菌NT06菌株生长曲线方法的比较[J].生物学杂志,2007,10(12):13-15.
TAO L X,XIA T J,CHANG H P.Comparing with two different methods of measuring Azotobacter NT06 growth[J].JournalofBiology,2007,10(12):13-15.(in Chinese with English abstract)
[10] 李永兴,王继文,李永蒂,等.玉米根际联合固氮菌57-7菌株基本特性的研究[J].微生物学报,1993,33(6):454-458.
LI Y X,WANG J W,LI Y D,et al.The study of basic characterization on maize rhizosphere associative nitrogen fixation bacteria 57-7[J].ActaMicrobiologicaSinica,1993,33(6):454-458.(in Chinese with English abstract)
[11] 刘荣昌,李凤汀,郝正然,等.小麦种子固氮菌的筛选与鉴定[J].河北省科学院学报,1984(1):115-121.
LIU R C,LI F T,HAO Z R,et al.The isolation and identification of nitrogen-fixing bacillus[J].JournaloftheHebeiAcademyofSciences,1984(1):115-121.(in Chinese with English abstract)
[12] 张志强,程智慧,沈永杰.大蒜叶枯病菌毒素产生条件的研究[J].西北农林科技大学学报,2007,35(12):186-190.
ZHANG Z Q,CHENG Z H,SHEN Y J.Conditions of toxin production ofStemphyliumvesicarium(Wallr) Simmons in garlic[J].JournalofNorthwestA&FUniversity,2007,35(12):186-190.(in Chinese with English abstract)
[13] 张丽梅.高效联合固氮菌的筛选、鉴定及其生理生化特征和接种效应研究[D].杭州:浙江大学,2002.
ZHANG L M.Selection and identification of an associative nitrogen-fixing bacterium strain with high efficiency and investigation of its physiological characteristics and of its inoculaiton effects [D].Hangzhou:Zhejiang University,2002.(in Chinese with English abstract)
[14] 郭霞,黄晓亚,李瑞华,等.红豆草黑腐病菌菌丝生长和产毒培养条件的优化[J].草地学报,2009,17(2):255-258.
GUO X,HUANG X Y,LI R H,et al.Optimization of culture condition for hyphae growth and toxin production ofAlternariatenuisofOnobrychisviciaefoliaScop[J].ActaAgrestiaSinica,2009,17(2):255-258.(in Chinese with English abstract)
[15] 刘欣林.小麦内生固氮菌的筛选与鉴定[D].成都:四川师范大学,2013:34-38.
LIU X L.Isolation and identification of endophytic nitrogen-fixing bacteria from wheat[D].Chengdu:Sichuan Normal University,2013:34-38.(in Chinese with English abstract)
[16] 汤春梅,陈秀蓉,姚拓,等.九种根际促生菌最适培养条件初探[J].草原与草坪,2005(3):27-30.
TANG C M,CHEN X R,YAO T,et al.Determination of the optimum cultural condition for nine PGPR strains[J].GrasslandandTurf,2005(3):27-30.(in Chinese with English abstract)
[17] 刑永秀.甘蔗内生固氮菌的分离、鉴定和生长特性[D].南宁:广西大学,2006.
XING Y X.Isolation and identification of endophytic nitrogen fixation in sugarcane and growth characteristics[D].Nanning:Guangxi University,2006.(in Chinese with English abstract)
[18] 王进,韩多红.环境因子对苦豆子种子的萌发和幼苗生长的影响[J].草地学报,2007,15(3):259-262.
WANG J,HAN D H.Influence of environmental factors on the seed germination and seedling growth ofSophoraalopecuroides[J].ActaAgrestiaSinica,2007,15(3):259-262.(in Chinese with English abstract)
[19] 田颖.关中地区小麦根际联合固氮菌的分离、鉴定及诱变研究[D].杨凌:西北农林科技大学,2005:17-18.
TIAN Y.The study of isolating,indentifing and mutagenesis on associative-nitrogen-fixing bacterium from wheat rhizoesphere in Guanzhong region[D].Yangling:Northwest A&F University,2005:17-18.(in Chinese with English abstract)
Effectsofcombinedsymbioticnitrogen-fixingbacteriaongrowthofwheatseedunderdifferentenvironmentalfactors
DENG Tiantian,CHEN Xi*,HOU Yumeng
(HenanInstituteofEngineering,Zhengzhou451191,China)
Abstract:Three species of co-symbiotic nitrogen fixation bacteria were obtained from 13 strains of wheat.Different strains were determined by the single factor batch experiments to obtain the optimal culture time,temperature,pH,glucose concentration,NaCl concentration and nitrogen concentration;furthermore,to investigate the effects of the single strain and combination groups on the growth of wheat seeds.The results showed that under the conditions of pH7,the temperature of 35℃,NaCl concentration of 5%,glucose concentration of 10%,nitrogen concentration of 3g·L-1,culture time of 36h,the combination of group action showed better effect than the single strain,and compared with the control,the germination rate was increased by 4% on average,the germination potential,germination index also increased.To some extent,the combinatorial bacteria group can better adapt to the changeable environment,playing a stable role in promoting the yield.
Key words:symbiotic nitrogen fixing bacteria;growth curve;wheat
中图分类号:S512.1
A
文章编号:1004-1524(2018)06-0886-07
收稿日期:2017-10-10
基金项目:河南省教育厅项目(16A610016)
作者简介:邓天天(1987—),女,河南洛阳人,讲师,博士研究生,主要从事农田土壤污染治理工作。E-mail:280233394@qq.com
,陈曦,E-mail:962967834@qq.com
10.3969/j.issn.1004-1524.2018.06.02
(责任编辑张 韵)
