Nek2对肝癌细胞凋亡的影响及其分子机制的研究
2018-06-27
广州医科大学附属广州市第一人民医院消化疾病中心,广东 广州 510180
【Abstract】ObjectiveTo investigate the expression and function of nima-related kinase2 (Nek2) in hepatocellular carcinoma tissues and cell lines, and to study the apoptosis and mechanism of Nek2 in hepatocellular carcinoma.Methods
The expression of Nek2 was detected by Western blotting in 27 hepatocellular carcinoma and 6 human hepatocellular carcinoma cell lines (HepG2, PLC/PRF/5, Hep3B, BEL-7402, SMMC-7721 and QGY-7701 cells), to select the HepG2 cell lines for further experiments. HepG2 cells with Nek2-siRNA inhibitor or the negative control (NC) were transfected, and the biological influence of Nek2-siRNA on HepG2 cells was analyzed in detection of apoptosis by flow cytometry and transfected by Nek2-siRNA for 48 hours, the expressions of apoptosis related factors P53, Caspase3, Bad and Bcl-2 were examined by Western blotting.ResultsNek2 was upregulated in hepatocellular carcinoma tissues and cell lines. Knock down Nek2 lead to promotion of apoptosis. After knock down Nek2 in HepG2 cell, the expressions of apoptosis related factors P53, Caspase3 and Bad were increased, Bcl-2 was reduced.ConclusionInhibiting expression of Nek2 can significantly influence the factors of cell apoptosis signal pathways by increasing P53, Caspase3, Bad, and reducing Bcl-2.
【Keywords】 Nima-related kinase 2; Hepatocellular carcinoma; Apoptosis
近年来,原发性肝细胞癌的发病率有明显上升的趋势,全球每年肝细胞癌发病人数为100~150万人,每年超过60万人死于肝细胞癌,其在肿瘤死因顺位中排名第三位。原发性肝细胞癌患者自诊断之日起中位生存时间少于12个月[1-2]。肝细胞癌的发病机制是一个多因素、多阶段、多基因共同积累的过程,其发生、发展涉及多基因调控和多信号通路参与。因此,在肿瘤组织癌变过程中相关基因及基因组的变化研究显得非常重要。Nek2[never in mitosis A (NIMA)related kinase 2]是一种细胞周期有丝分裂关键原件—中心体相关蛋白激酶,Nek2的高表达可导致中心体异常,进而导致肿瘤的发生。目前已经证实在乳腺癌、卵巢癌、宫颈癌、前列腺癌、胃癌、胆管细胞癌和白血病等的人类肿瘤中广泛存在着Nek2表达升高[3-4]。国内也有报道通过肿瘤组织芯片的免疫组织化学检测发现,Nek2在消化道肿瘤组织胞浆和胞核中均有高表达,以胞核内高表达为多,所涉及的肿瘤包括食管癌、胃癌、肝癌、小肠癌、结直肠癌及胆管细胞癌。近期有统计[6]指出,高Nek2表达是肝癌患者术后复发的原因之一。
本研究通过检测Nek2在原发性肝细胞癌组织和肝癌细胞系中的表达和功能,使用小干扰RNA技术,沉默肝癌细胞中的Nek2基因,研究在此前后肝癌细胞凋亡的改变,并初步探索其机制。
1 材料与方法
1.1组织标本及临床资料新鲜原发性肝细胞癌组织及相应癌旁组织(距离瘤体边缘>2 cm)共52对,均于液氮速冻后置于-80 ℃冰箱长期保存。其中11对和41对组织标本分别来自2010-2012年中山大学肿瘤医院及广州市第一人民医院行手术切除的原发性肝细胞癌患者。所有患者均经组织病理切片检查证实为原发性肝细胞癌,且术前均未接受过其他各种旨在缩小肿瘤体积、控制肿瘤进展的治疗(如放化疗、介入治疗、生物治疗、超声聚焦治疗等)。手术标本离体后30 min内于液氮速冻,置于-80 ℃冰箱保存。
1.2细胞系正常肝细胞株HL-7702,肝癌细胞株HepG2、PLC/PRF/5、Hep3B、BEL-7402、SMMC-7721、QGY-7701均购自中山大学细胞库。
1.3试剂抗Nek2单克隆抗体(Santa Cruz,Sc55601,美国),羊抗鼠Ig-G-HRP(Santa Cruz,Sc2025美国),β-actin单克隆抗体(Sigma,美国),ECL化学发光液(GE美国),蛋白分子量预染Marker(Bio-Rad,美国)。siRNA Transfection Reagent转染试剂盒(Roche,美国),siNek2(Origene,美国,Cat No.SR303138;Santa Cruz,Cat No.Sc43960,美国),Control siRNA(Santa Cruz,Cat No.Sc37007,美国)。Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物公司,中国)。Western blotting抗体Bcl2、Bad、P53、Nek2、Caspase-3、β-Catenin、Gapdh一抗均购自Santa Cruz公司。
1.4实验方法siRNA序列的构建,针对Nek2基因序列,从美国Santa Cruz公司购买siNek2及阴性对照序列,于转染前1天将肝细胞癌HepG2细胞接种到6孔板中,待第2天细胞密度为30%~50%时转染细胞,PBS冲洗细胞3次,加入200 μl稀释浓度为4 μmol/L的siRNA,每孔加入2 ml的无抗培养基,轻轻水平震荡,混匀后放入培养箱培养。72 h后提取蛋白进行下一步的实验。Western blotting制备SDS-PAGE电泳凝胶后,电泳槽中加入20 μl样品,70 V恒压20 min,120 V恒压电泳至溴酚蓝刚出胶底部止;转膜后封闭1 h,一抗稀释(1∶1 000)浓度4 ℃过夜,洗膜后二抗稀释液(1∶2 000)37 ℃孵育1 h,洗膜后用化学发光法显影。细胞凋亡检测以流式细胞仪检测分析。
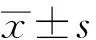
2 结果
2.1 肝癌及癌旁组织、肝癌细胞株的Nek2蛋白表达
取肝癌及癌旁组织,提取组织蛋白后以Western blotting方法检测,结果显示,在47 kD处有2条非常接近的特异性条带,分别为Nek2a及Nek2b(见图1A)。癌旁组织中Nek2平均表达量的灰度值为0.73±0.058;肝癌组织Nek2平均表达量的灰度值为1.068±0.122。肝癌组织中Nek2的表达水平明显高于癌旁组织,差异有统计学意义(t=2.465,P<0.05)(见图1B)。同样以Western blotting方法检测人肝癌细胞系和正常肝细胞HL-7702中Nek2的蛋白表达,通过QuantityOne软件包计算灰度值,得出每株细胞的Nek2蛋白的表达量。以One-wayANOVA检验对所有组间进行比较分析,得出F值为115.9,差异有统计学意义(P<0.0001)。并通过配对样本t检验统计各肝癌细胞系Nek2的蛋白表达量与正常肝细胞HL-7702比较。结果除QGY-7701细胞株以外的所有肝癌细胞株的蛋白表达量与正常肝细胞HL-7702相比,差异均有统计学意义(P<0.05),其中细胞系PLC/PRF/5和HepG2的Nek2蛋白表达量最大(见图2)。选取HepG2细胞进行下一步实验。
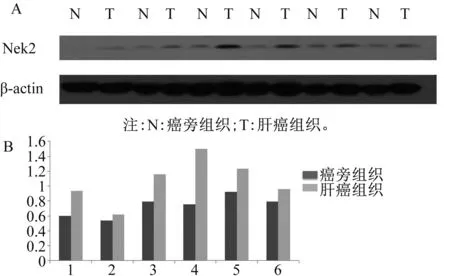
图1肝癌及癌旁组织标本Nek2蛋白的表达
A: Western blotting检测;B: Nek2蛋白表达量
Fig1ExpressionofNek2inhepatocellularcarcinomatissuesandadjacentnon-canceroustissues
A: Western blotting;
B: expression of Nek2
2.2siNek2干扰对HepG2细胞凋亡的影响将实验细胞分为转染组、空白对照组及阴性对照组,通过对转染后各组细胞Annexin V-FITC染色后的流式细胞分析,用流式细胞仪检测,激发波长Ex=488 nm;发射波长Em=578 nm,Annexin V-FITC的绿色荧光使用FL2通道检测;激发波长Ex=546 nm;发射波长Em=647 nm,PI红色荧光使用FL3通道检测。荧光补偿调节:使用未经凋亡诱导处理的正常细胞,作为对照进行荧光补偿调节,去除光谱重叠和设定十字门的位置。发现siNek2转染细胞48 h后,正常细胞比例(LL)较空白对照组明显减少[(74.5±0.02)%vs(96.5±0.06)%)],细胞早期凋亡(LR)、晚期凋亡(UR)和总凋亡(LR+UR)均明显增加,与阴性对照组相比,差异有统计学意义(见表1、图3,P<0.01)。
2.3siNek2干扰对HepG2细胞凋亡通路的影响Nek2-siRNA转染肝细胞癌HepG2细胞48 h后,抑癌基因P53表达上调,促凋亡蛋白Bad和凋亡效应分子Caspase-3表达上调,抗凋亡蛋白Bcl-2表达下调(P<0.05)(见图4)。
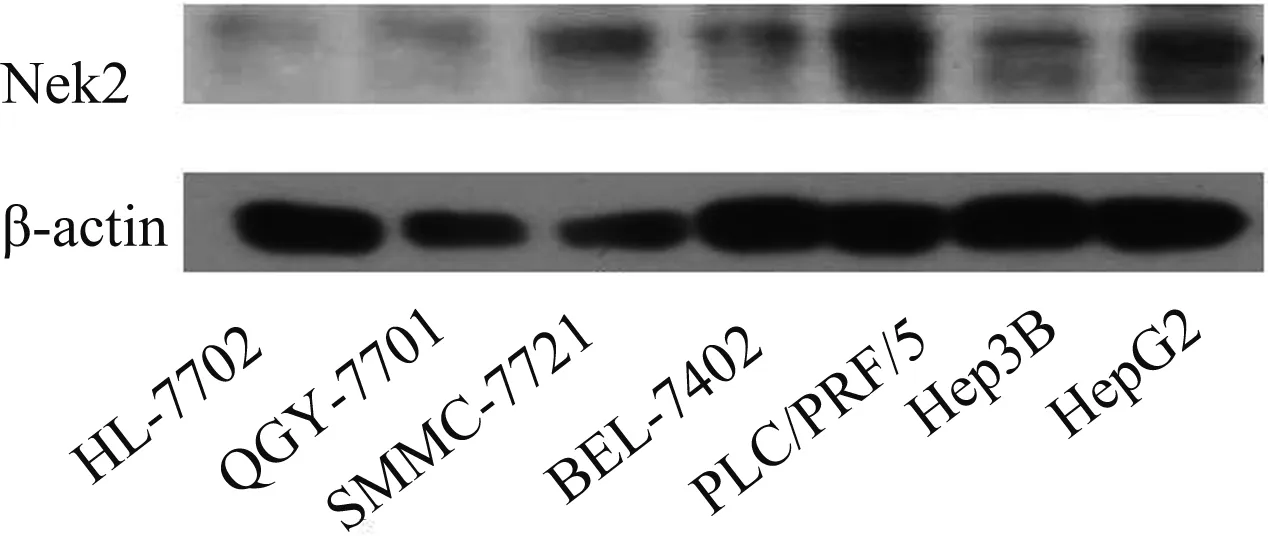
图2 肝癌细胞系和正常肝细胞系Nek2蛋白表达Fig 2 Protein expression of Nek2 in HCC cell lines and normal liver cell lines
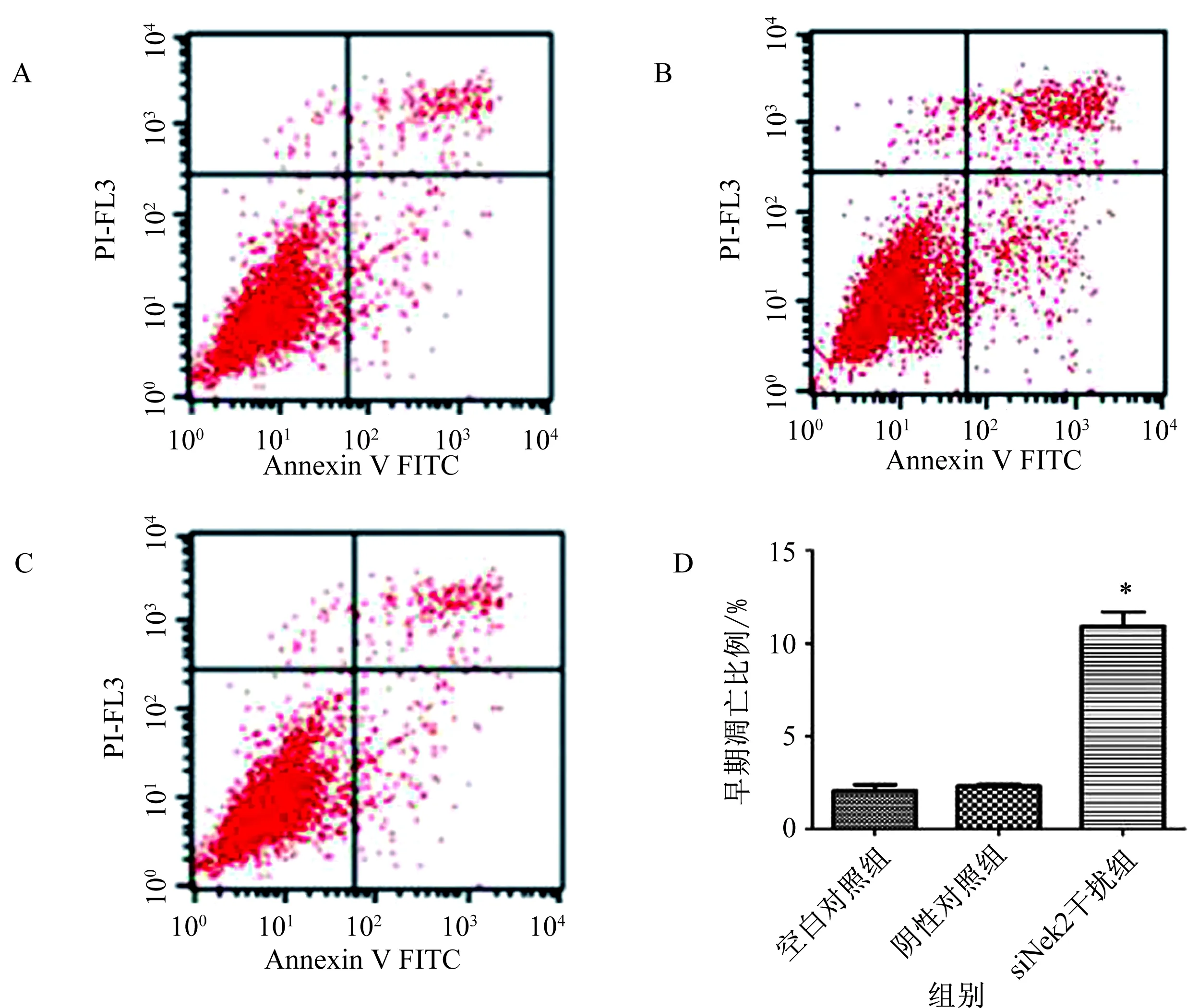
注:与空白对照组、阴性对照组相比,*P<0.05。图3 siNek2干扰对HepG2细胞凋亡的影响
A:空白对照组;B:阴性对照组;C:siNek2干扰组;D:细胞早期凋亡百分比(LR+UR)
Fig3ApoptosisassayofHepG2cellstreatedbysiNek2interference
A: blank control group; B: negative control group; C: siNek2 interference group; D: apoptosis rate (LR+UR)
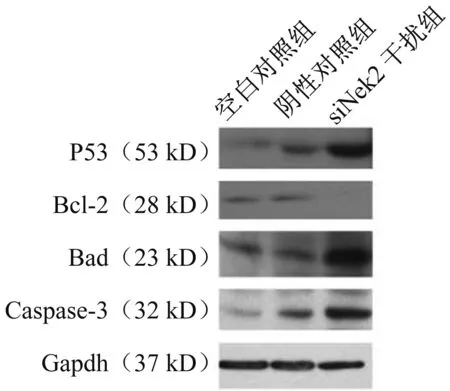
图4 Western blotting检测Nek2-siRNA转染前后肝癌细胞凋亡相关因子表达Fig 4 Apoptosis factors of cells for Nek2-siRNA by Western blotting
3 讨论
Nek2主要在细胞有丝分裂的G2/M期发挥调节作用,能使细胞正常地进入分裂期,人类Nek2蛋白有着激酶区域的氨基末端和未催化的调节区域的羧基末端。有活性的Nek2过表达会导致不成熟的中心体的分离,而无活性的Nek2过表达会导致异常中心体、单极纺锤体和非整倍体的形成[7]。而这些都是造成肿瘤发生的相关因素。Nek2表达的增高可能是由于抑癌基因的失活导致Nek2转录的失控而造成的。而Nek2表达增高可导致中心体异常进而导致肿瘤的发生。乳腺癌、卵巢癌、宫颈癌、前列腺癌、胃癌、胆管细胞癌和白血病等的人类肿瘤中广泛存在着Nek2表达增高[8]。本研究结果显示,Nek2蛋白的表达水平在肝细胞癌中明显升高,提示Nek2的高表达可能与肝细胞癌的发生、发展有着重要的联系。且在6种肝癌细胞系中,Nek2的蛋白表达均高于正常肝细胞HL-7702,除肝癌细胞系QGY-7701外,均有显著差异,尤其表达最显著的是肝癌细胞系PLC/PRF/5和HepG2。在癌细胞中Nek2表达明显升高,可能是由于该基因转录控制失衡所造成的。虽然在肿瘤细胞中观察到了Nek2的增量调节和基因不稳定性,但Nek2的增量调节到底是肿瘤发生的原因还是结果仍不明确。研究[8]显示,Nek2的增量调节促进了肿瘤的发生、发展;而肿瘤的发生又推动了Nek2的增量调节,而Nek2活性的丢失可以抑制细胞增殖并启动由于有丝分裂错误造成的细胞死亡机制。目前有关Nek2参与肿瘤发生、发展的具体机制还没有完全明确,有研究[9]认为,Nek2的过表达可以聚集中心体,从而加快有丝分裂的进程,甚至可以直接诱发染色体分离,或是产生额外的中心体造成多核细胞增殖[10]。也有研究[7]认为,突变的Nek2与染色体着丝点蛋白癌症高表达蛋白(highly expressed in cancer,Hec1)结合,造成染色体的错误分离,但以上观点有待进一步研究来证实。
范婷婷等[11]在针对卵巢癌与Nek2基因沉默的相关研究中发现,将siNek2-RNA序列转染入卵巢癌SKOV3细胞后,肿瘤细胞的增殖、迁移和侵袭能力与对照组比较明显受到抑制,凋亡显著增加,同时细胞进入G2/M期受阻。我们前期的研究[12]中,证实Nek2通过调节Wnt/β-catenin信号传导通路参与肝癌细胞的增殖,以及干扰肝癌细胞从G2/M期进入S期。本研究中Nek2基因沉默48 h后,HepG2细胞的早期凋亡、晚期凋亡和总凋亡较阴性对照组和空白对照组明显增加,证实沉默Nek2基因可以促进其凋亡。本研究选取凋亡调节因子P53、Caspase3、Bcl-2、Bad为研究对象,检测经过Nek2-siRNA转染后48 h其蛋白的表达情况。结果发现,在抑制Nek2的表达后,P53、Caspase3和Bad的蛋白表达增加,而抗凋亡因子Bcl-2的蛋白表达下降。可以推测在肝细胞癌的发生和发展中,Nek2可以通过影响凋亡信号传导通路中的重要因子来抑制细胞的凋亡,从而导致肿瘤的发生和发展。目前有研究[13]显示,抑制肝癌细胞中的Nek2表达后,可使肝癌细胞对5-FU的耐药性下降,增强对该药物的敏感性,该现象可能是通过PPI/Ark通路诱导肝癌细胞的凋亡产生的。
本研究仅仅针对肝癌HepG2细胞进行初步研究,在今后的研究中,研究对象会增加到其他的肝癌细胞,以及一些动物模型的建立和对于沉默Nek2或过表达该基因后对肿瘤耐药性的相关研究,以能够对Nek2基因的功能机制和作用做出更深入和全面的探索。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017 [J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI: 10.3322/caac.21387.
[2] BALOGH J, VICTOR D 3rd, ASHAM EH, et al. Hepatocellular carcinoma: a review [J]. J Hepatocell Carcinoma, 2016, 3: 41-53. DOI: 10.2147/JHC.S61146.
[3] BOWERS A J, BOYLAN J F. Nek8, a NIMA family kinase member, is overexpressed in primary human breast tumors [J]. Gene, 2004, 328: 135-142. DOI: 10.1016/j.gene.2003.12.002.
[4] KOKURYO T, SENGA T, YOKOYAMA Y, et al. Nek2 as an effective target for inhibition of tumorigenic growth and peritoneal dissemination of cholangiocarcinoma [J]. Cancer Res, 2007, 67(20): 9637-9642. DOI: 10.1158/0008-5472.CAN-07-1489.
[5] 梁基韵, 曹传辉, 刘莉, 等. Nek2在消化系统肿瘤中的表达[J]. 广东医学, 2013, 37(14): 2160-2162. DOI: 10.3969/j.issn.1001-9448.2013.14.015.
LIANG J Y, CAO C H, LIU L, et al. Expression of Nek2 in the neoplasms of digestive system [J]. Guangdong Medical Journal, 2013, 37(14): 2160-2162. DOI: 10.3969/j.issn.1001-9448.2013.14.015.
[6] WUBETU G Y, MORINE Y, TERAOKU H, et al. High NEK2 expression is a predictor of tumor recurrence in hepatocellular carcinoma patients after hepatectomy [J]. Anticancer Res, 2016, 36(2): 757-762.
[7] ANDRÉASSON U, DICTOR M, JERKEMAN M, et al. Identification of molecular targets associated with transformed diffuse large B cell lymphoma using highly purified tumor cells [J]. Am J Hematol, 2009, 84(12): 803-808. DOI: 10.1002/ajh.21549.
[8] CHEN Y, RILEY D J, ZHENG L, et al. Phosphorylation of the mitotic regulator protein Hec1 by Nek2 kinase is essential for faithful chromosome segregation [J]. J Biol Chem, 2002, 277(51): 49408-49416. DOI: 10.1074/jbc.M207069200.
[9] ZHUANG Y, YIN H T, YIN X L, et al. High p27 expression is associated with a better prognosis in East Asian non-small cell lung cancer patients [J]. Clin Chim Acta, 2011, 412(23-24): 2228-2231. DOI: 10.1016/j.cca.2011.08.018.
[10] NICKLAS R B. How cells get the right chromosomes [J]. Science, 1997, 275(5300): 632-637.
[11] 范婷婷, 唐良萏. Nek2基因沉默对卵巢癌SKOV3细胞侵袭能力的影响[J]. 第三军医大学学报, 2012, 34(15): 1514-1517.
FAN T T, TANG L D. Silencing Nek2 via RNAi suppresses in invasiveness in ovarian cancer SKOV3 cells [J]. Acta Academiae Medicinae Militaris Tertiae, 2012, 34(15): 1514-1517.
[12] LAI X B, NIE Y Q, HUANG H L, et al. NIMA-related kinase 2 regulates hepatocellular carcinoma cell growth and proliferation [J]. Oncol Lett, 2017, 13(3): 1587-1594. DOI: 10.3892/ol.2017.5618.
[13] WEN S, LIN Y, YANG M, et al. Increased NEK2 in hepatocellular carcinoma promotes cancer progression and drug resistance by promoting PP1/Akt and Wnt activation [J]. Oncol Rep, 2016, 36(4): 2193-2199. DOI: 10.3892/or.2016.5009.
