Correlation of intraoperative ultrasonography and immunohistochemical markers expression in glioma
2018-06-25CNG
, *, CNG , , , ,
(1.Department of Ultrasound, Beijing Tiantan Hospital, Capital Medical University,Beijing 100050, China; 2.Department of Ultrasound, Beijing Haidian Section of Peking University Third Hospital, Beijing 100080, China)

图1 患者男,49岁,胶质母细胞瘤(WHO Ⅳ级),术后免疫组化:Ki-67 LI>50%(+++),IDH1未突变(-) 术中声像图示肿瘤边界清晰,瘤周水肿>3 cm (A),CDFI血流分级3级(B)
胶质瘤是神经上皮组织来源肿瘤,也是最常见的原发性颅内肿瘤[1]。手术切除是治疗胶质瘤最主要的方法[2]。术中超声方便灵活、实时诊断、可重复性好,可清晰显示颅内占位的位置、大小及其与正常脑组织的分界,成为术中不可或缺的工具,术前可准确定位,术后可显示肿瘤残余[3],且二维超声结合CDFI可对胶质瘤进行初步分级[4]。目前已知不同分子表达与肿瘤多样化的预后和生物学行为密切相关。本研究旨在探讨胶质瘤术中超声表现与Ki-67、异柠檬酸脱氢酶1(isocitrate dehydrogenase, IDH1)等分子标记物表达的关系。
1 资料与方法
1.1 一般资料 回顾性分析2016年5月—2017年6月我院经手术病理证实且术中超声和免疫组化资料完整的116例胶质瘤患者的资料,男72例,女44例,年龄28~75岁,平均(49.2±14.9)岁;主要临床症状为头晕、头痛、视力减退、肢体活动障碍、记忆力下降等。
1.2 仪器与方法 术中超声检查采用日立Aloka α7和α10超声诊断仪,扇形凸阵探头,频率3~ 6 MHz。术中将探头表面消毒并覆以耦合剂置于无菌套中,经硬脑膜外或直接置于脑组织表面,多切面多方位扫查,记录肿瘤主要部位(病变主体所在部位)、大小、边界、瘤周水肿、囊变、钙化及CDFI血流情况。根据肿瘤最大切面上的最大径,将肿瘤分为<3 cm、3~5 cm及>5 cm。以肿瘤最大切面上肿瘤边缘距水肿边缘的最远距离为标准,参考Schoenegger等[5]的方法评价瘤周水肿程度:≤2 cm为轻度水肿,>2 cm为重度水肿。以肿瘤内部无回声为有囊变,将强回声判定为钙化。依照Adler血流分级法,将血流分为0~3级[6]。
1.3 免疫组化 于有代表性的肿瘤区域取样切片。将细胞核染为棕黄或棕褐色定义为Ki-67阳性细胞。在高倍镜下随机选取5个视野,计数阳性细胞数,并据此对Ki-67标记指数(labeling index, LI)进行分级:LI<10%为阴性(-),LI≥10%为阳性,其中10%≤LI<25%为弱阳性(+),25%≤LI<50%为阳性(++),LI≥50%为强阳性(+++)。
IDH1测序结果显示,突变者132号密码子中间碱基由G变为A,突变型为阳性(+),未突变者为阴性(-)。
1.4 统计学分析 采用SPSS 20.0统计分析软件,两组间计数资料比较采用Pearsonχ2检验,相关性分析采用Spearman等级相关分析;将有统计学意义的因素采用二元Logistic回归处理,计算比值比(odds ratio, OR),以确定影响Ki-67、IDH1表达的预测因子。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 116例胶质瘤均位于幕上,其中额叶38例,颞叶31例,顶叶22例,枕叶12例,岛叶10例,脑室内3例。其中胶质母细胞瘤40例,少突胶质细胞瘤18例,星形细胞瘤23例,少突星形细胞瘤30例,节细胞胶质瘤5例;WHO分级Ⅰ级4例,Ⅱ级50例,Ⅲ级22例,Ⅳ级40例。
2.2 免疫组化 116例患者中,103例接受Ki-67分析,其中阳性65例(Ki-67阳性组),阴性38例(Ki-67阴性组);95例接受IDH1分析,其中阳性51例(IDH1阳性组),阴性44例(IDH1阴性组)。见图1、2。
2.3Logistic回归分析 单因素分析显示,肿瘤边界、瘤周水肿及CDFI血流分级在Ki-67阴性与阳性患者间差异均有统计学意义(P均<0.01,表1);Logistic回归分析结果显示,肿瘤边界(P<0.01)、瘤周水肿程度(P=0.01)和CDFI血流(P<0.01)均是Ki-67表达分级有意义的预测因子(表2)。相关分析显示,Ki-67表达程度与瘤周水肿程度(r=0.497,P<0.01)和CDFI血流分级(r=0.439,P<0.01)均呈正相关。

表1 影响Ki-67、IDH1表达的单因素分析结果(例)
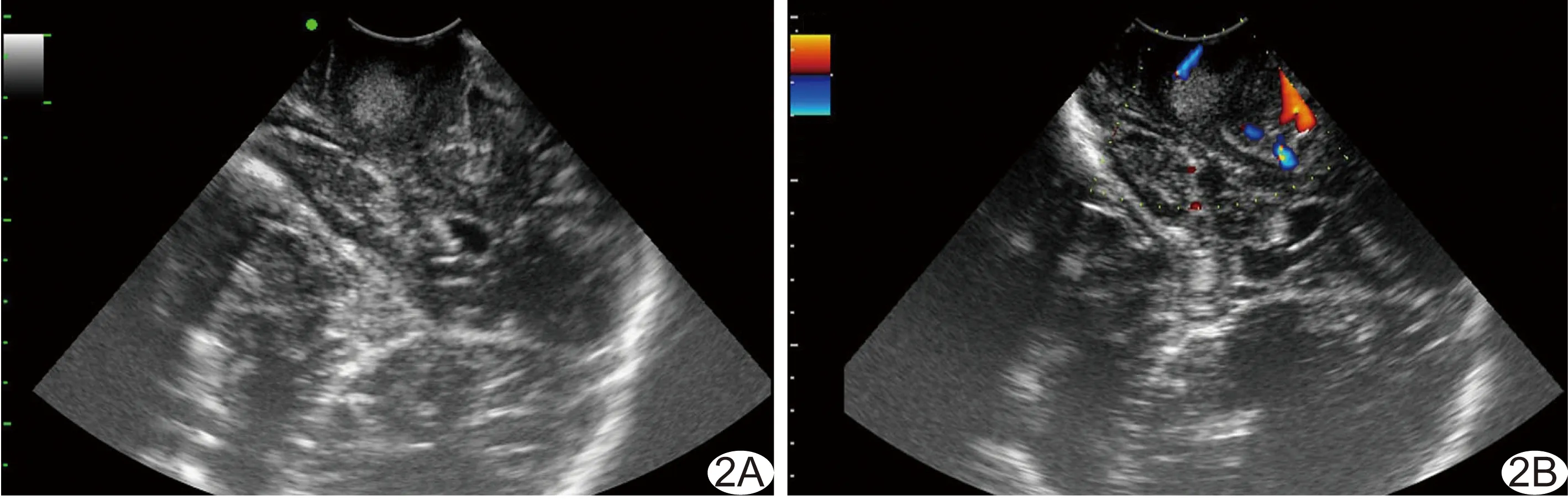
图2 患者女,66岁,胶质母细胞瘤(WHO Ⅳ级),术后免疫组化:Ki-67 LI 10%(+),IDH1突变(+) 术中声像图示肿瘤边界不清,瘤周水肿<1 cm (A),CDFI血流分级0级(B)
单因素分析显示,与IDH1表达有关的因素为边界、囊变和瘤周水肿程度(P均<0.01,表1);Logistic回归分析结果显示,肿瘤边界(P<0.01)、瘤周水肿程度(P<0.01)均为IDH1阳性有意义的预测因子(表3)。
3 讨论
本研究结果显示,肿瘤边界、瘤周水肿程度、CDFI血流分级在Ki-67阴性与阳性患者间及肿瘤边界、瘤周水肿程度在IDH1阴性与阳性患者间差异均有统计学意义(P均<0.01),且Ki-67表达程度与瘤周水肿程度和CDFI血流分级均呈正相关(P<0.05),提示边界、瘤周水肿程度、CDFI血流分级等征象可能对胶质瘤Ki-67、IDH1表达有一定预测意义。
即使是同级别同病理类型的肿瘤,患者预后也存在很大差异[7]。目前判断胶质瘤的预后已不再单独依据组织病理学,而不同亚型之间临床治疗方案及预后差异较大[8]。Ki-67增殖指数与肿瘤的分化程度、浸润或转移及预后关系密切,是判断肿瘤预后的重要参考指标之一(Ⅰ级证据)。Ki-67是一种细胞增殖核抗原[9],在细胞增殖的各期(G1、S,G2和M)中均有表达,反映细胞增殖活跃程度,是影响患者预后的独立危险因素[10];其高表达反映肿瘤浸润性强、病理级别高、恶性程度大及预后较差、生存期较短[9,11]。IDH1基因突变对于胶质瘤病理诊断、治疗选择和预后评估有重要意义(Ⅰ级证据)[1]。IDH1突变后的功能类似于肿瘤抑制基因[12]。Chen等[13]分析近年24组定量随机对照试验、前瞻性及回顾性研究,发现在胶质瘤、尤其是高级别肿瘤患者中,无论手术治疗还是非手术治疗(放、化疗),IDH1突变均预示着较长的总生存期和无进展生存期。IDH1突变患者对化疗也比未突变者更敏感。术中预测Ki-67、IDH1表达,对于评估肿瘤分化程度、生物学行为和预后以及完善手术策略具有重要意义。
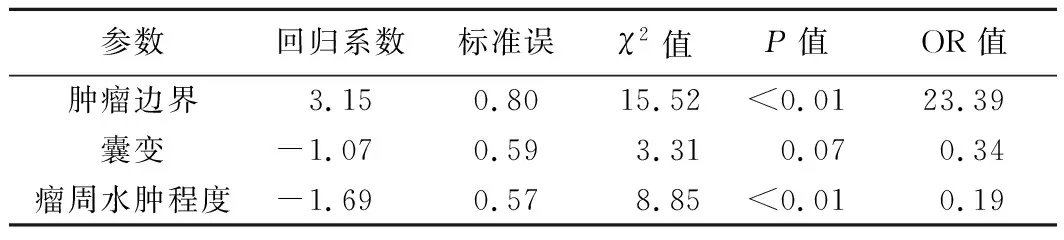
表2 Ki-67阳性的多因素Logistic回归分析结果
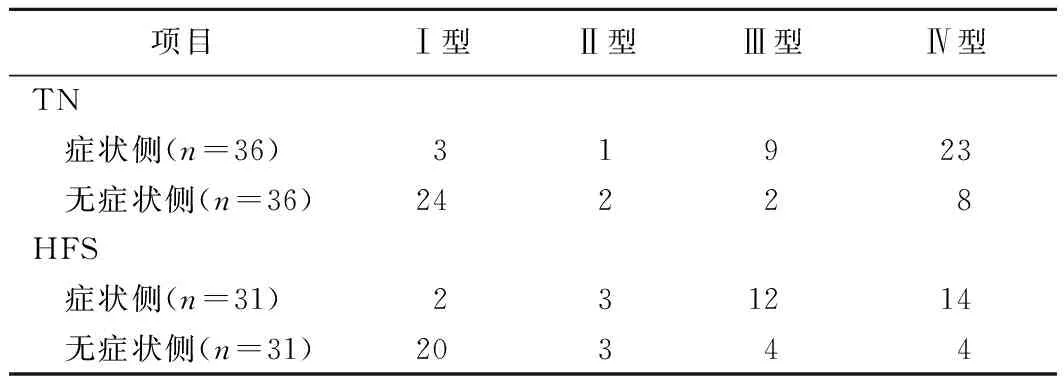
表3 IDH1阳性的多因素Logistic回归分析结果
MRI上瘤周水肿、增强程度等特征与分子标记物的表达有关。严宁[14]观察42 例幕上单发胶质瘤MRI特点及免疫组化检测肿瘤标本Ki-67、MGMT表达情况,结果表明,Ki-67表达水平与肿瘤囊变或坏死、高增强以及存在占位效应呈正相关。本研究中关于Ki-67阳性与CDFI血流分级呈正相关的结果与之相符,表明血流丰富程度可能是Ki-67表达较可靠的预测因子。本组结果提示,肿瘤边界、瘤周水肿分度也是有意义的预测因子,瘤周水肿>1 cm者Ki-67阳性率82.26%(51/62),而瘤周水肿>2 cm者Ki-67阳性率高达88.89%(24/27),且Ki-67表达程度与瘤周水肿分级也呈正相关,与洪宇等[15]对74例胶质瘤患者PTBE和Ki-67表达相关性的研究结果相符。Schoenegger等[5]也认为有可能根据MRI上瘤周水肿程度独立预测高级别胶质瘤的预后。
由于开颅后脑脊液的释放和颅内压改变,术中超声对肿瘤占位效应尚无法评估,因而未能观察占位效应与Ki-67 的相关性。本研究中肿瘤囊变在Ki-67表达阳性与阴性患者间差异无统计学意义,提示对于肿瘤囊变的预测价值有待进一步观察。另外,二维超声声像图对于非液化性坏死的判断效能有限,仅能准确识别囊变类坏死,对于坏死的预测价值还需借助CEUS等增强检查。
陈加贝等[16]分析198例原发胶质母细胞瘤MRI特点及免疫组化检测肿瘤标本IDH1、MGMT表达情况,认为与胶质瘤IDH1阳性表达有关的因素为瘤周水肿分度、主要侵袭部位、肿瘤最大直径和MRI増强方式,且轻度瘤周水肿与IDH1阳性呈正相关。本研究中瘤周水肿至肿瘤边界最大距离<1 cm的胶质瘤IDH1阳性率高达78.95%(30/38),提示瘤周水肿程度可能是IDH1表达较可靠的预测因素。
本研究结果显示,CDFI血流分级(P=0.14)、肿瘤主要侵袭部位(P=0.81)、最大径(P=0.24)在IDH1阳性与阴性患者间差异无统计学意义,提示上述特征可能与IDH1表达无明显相关。CEUS中的增强模式可能更准确地反映肿瘤血供程度及模式,从而提供更多信息。造成上述结果的原因也有可能在于样本量不足等因素引起偏倚,有待进一步观察。
综上所述,术中超声声像图中瘤周水肿程度、边界和CDFI血流分级等征象与KI-67、IDH1的表达具有相关性,对于术前初步判断肿瘤生物学行为、选择术中对策实施个性化治疗以及判断远期预后等具有重要辅助意义。
本研究不足:样本量较小,声像图特征不够全面,在今后的研究中可进一步引入CEUS,联合应用多种影像学手段,加强对肿瘤坏死及微血流灌注的显示。
[参考文献]
[1] 《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断和治疗指南(2012).中华医学杂志,2013,93(31):2418-2449.
[2] Yasargil MG, Kadri PA, Yasargil DC. Microsurgery for malignant gliomas. J NeuroOncol, 2004,69(1):67-81.
[3] 王立淑,何文,刘会昭,等.术中超声与病理评价颅脑胶质瘤切除程度的对照研究.中华医学超声杂志(电子版),2009,6(3):43-46.
[4] 杨红,黄晓玲.彩色多普勒超声在颅内胶质瘤分级及切除术中的价值研究.中国超声医学杂志,2009,25(9):838-841.
[5] Schoenegger K, Oberndorfer S, Wuschitz B, et al. Peritumoral edema on MRI at initial diagnosis: An independent prognostic factor for glioblastoma? Eur J Neurol, 2009,16(7):874-878.
[6] 李宏,李德华,胡波.乳腺癌超声征象与Ki67、p53表达的相关性及临床意义.中国临床医学影像杂志,2015,26(5):321-324.
[7] Michaelis M, Baumgarten P, Mittelbronn M, et al.Oncomodulation by human cytomegalovirus: Novel clinical findings open new roads. Med Microbiol Immunol, 2011,200(1):1-5.
[8] Gupta K, Salunke P. Molecular markers of glioma: An update on recent progress and perspectives. J Cancer Res Clin Oncol, 2012,138(12):1971-1981.
[9] Hu X, Miao W, Zou Y, et al. Expression of p53, epidermal growth factor receptor, Ki-67 and O(6)-methylguanine-DNA methyltransferase in human gliomas. Oncol Lett, 2013,6(1):130-134.
[10] Jin Q, Zhang W, Qiu XG, et al. Gene expression profiling reveals Ki-67 associated proliferation signature in human glioblastoma. Chin Med J (Engl), 2011,124(17):2584-2588.
[11] Zeng A, Hu Q, Liu Y, et al. IDH1/2 mutation status combined with Ki-67 labeling index defines distinct prognostic groups in glioma. Oncotarget, 2015,6(30):30232-30238.
[12] Zhao S, Lin Y, Xu W, et al. Glioma-derived mutations in IDH1 dominantly inhibit IDH1 catalytic activity and induce HIF-1alpha. Science, 2009,324(5924):261-265.
[13] Chen JR, Yu Y, Xu HZ, et al. Isocitrate dehydrogenase (IDH)1/2 mutations as prognostic markers in patients with glioblastomas. Medicine (Baltimore), 2016,95(9):e2583.
[14] 严宁.幕上单发胶质瘤磁共振影像学特点与Ki-67、MGMT的相关性研究.福州:福建医科大学,2016:19-21.
[15] 洪宇,郑勇,吴永刚,等.胶质瘤瘤周水肿、病理级别、Ki-67表达三者相关性研究.国际肿瘤学杂志,2015,42(3):165-168.
[16] 陈加贝.GBM个体化手术切除及分子标记物与磁共振影像的相关性研究.广州:南方医科大学,2015:23-25.
猜你喜欢
杂志排行
中国医学影像技术的其它文章
- Intraoperative ultrasonographic features of craniopharyngioma:Case report
- Three-dimensional sampling perfection with application optimized contrasts using different flip angle evolutions sequence in preoperative evaluation of acoustic neuroma
- 3.0T MR three-dimensional time-of-flight and fast imaging employing steady state acquisition sequences in pre-operative evaluation on spatial relationship among trigeminal nerve, facial nerve and peripheral vessels
- Portal venous velocity ratios in different degrees of portal vein stenosis following 70% partial hepatectomy of rats
- CT morphological characteristics of plantar nerves and their significances in diabetic foot
- 《中国医学影像技术》杂志2018年征订启事
