猪伪狂犬病毒贵州分离株gE基因的克隆及遗传信息分析
2018-06-22敖清莹曾智勇何祥艳何小莉张爱琼叶百川
敖清莹,曾智勇,徐 国,杨 霞,何祥艳,何小莉,张爱琼,咸 文,叶百川
(贵州大学 动物科学学院,贵州 贵阳 550025)
猪伪狂犬病是由伪狂犬病毒(Pseudorabies virus,PRV)引起的以发热、奇痒(猪除外)、脑脊髓炎为主要特征的一种急性传染病[1]。伪狂犬病毒能感染多种宿主,其中猪是该病毒的主要宿主,各年龄段的猪均可感染,新生仔猪主要表现为神经症状,还可出现腹泻等消化系统症状;成年猪通常为隐性感染,主要引起妊娠母猪死胎、木乃伊胎,哺乳仔猪高死亡率、流产及种猪不育[2]。我国20世纪40年代末在猫中首次发现了伪狂犬病毒,60年代初在猪群中也出现了该病毒的流行。至今伪狂犬病毒仍在我国广泛流行,严重威胁着我国养殖业的安全[3]。PRV属于疱疹病毒(Herpesuiri-dae)、α-疱疹病毒亚科,基因组为线状双股DNA,长约150 kb,编码70~100种蛋白质,其基因组中G+C含量最高达73%[4]。PRV的毒力由多种基因共同控制,主要有编码胸苷激酶(TK)、糖蛋白gI、gD、gE和核苷酸还原酶(RR)等基因[5-6],其中gE基因是该病毒复制非必需的糖蛋白[7]。此外gE基因还是PRV的病毒复制和主要毒力决定基因的非必需独立基因,是一种能够促进细胞融合的糖蛋白,该特性能介导病毒在细胞间的扩散[8-9],研究表明去除糖蛋白gE可导致PRV毒力减弱[10],所以目前市面上流通的伪狂犬疫苗大部分为gE基因缺失疫苗。自2011年开始,全国各地已免疫猪伪狂犬病病毒疫苗免疫的猪场开始频繁发生猪伪狂犬病,对我国猪群及养猪行业造成了严重的经济损失。行宇等[11]于2012~2014年对河南省猪场进行gE抗体的调查,结果表明3年来gE阳性率呈持续上升趋势。李峰等[12]于2012~2013年对滨州及周边地区开展猪病毒性疾病的流行现状调查,发现2012年和2013年PRV野毒的检出率与2011年相比显著升高。自2012年后,我国多个省市报道PRV新流行株的分离与鉴定,但是贵州省PRV病毒分离的报道相对较少。本研究对2017年所分离的一株PRVgE基因进行TA克隆后测序,并进行序列分析,以期为猪伪狂犬病的防控以及开发新型猪伪狂犬病疫苗提供科学和理论依据。
1 材料与方法
1.1 主要试剂
MiniBEST Viral RNA/DNA Extraciton Kit Ver.5.0核酸提取试剂盒、限制性内切酶、LA Taq聚合酶、DNA DL2 000 Marker等购自宝生物工程(大连)有限公司;E.Z.N.A.TM Gel Extraction Kit (100) 胶回收试剂盒购自美国Omega公司;普通质量微量提取试剂盒购自生工生物工程(上海)股份有限公司。
1.2 毒株
病毒液为实验室早先将某规模化养猪场疑似感染PRV的猪脑组织、淋巴结及脏器混合样本经处理后接种Vero细胞,经病毒鉴定所获得的PRV GZJS2017毒株。
1.3 PCR引物设计
参照文献[11]的引物序列并委托生工生物工程(上海)股份有限公司合成。
1.4 PRV gE基因的PCR扩增
用核酸提取试剂盒提取将接种Vero细胞的3代病毒液的核酸作为模板,进行PRVgE基因的PCR扩增,PCR反应体系总体积为25.0 μL:核酸模板4.25 μL,dNTP 4.0 μL,2×GC Buffer Ⅱ12.5 μL,LA Taq酶0.25 μL,上、下游引物各2.0 μL。PCR反应条件为95℃预变性5 min;94℃变性45 sec;63℃退火45 sec;72℃延伸2 min;35个循环;72℃终延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测。
1.5 gE基因的克隆与序列分析
将目的基因经凝胶回收纯化后克隆至pMD19-T载体,重组阳性质粒送往生工生物工程(上海)股份有限公司测序。利用生物学分析软件DNAStar、MEGA6.0软件对测序所得序列并分别与GenBank上登录的其他PRV毒株的gE基因序列(表1)进行比对、分析。
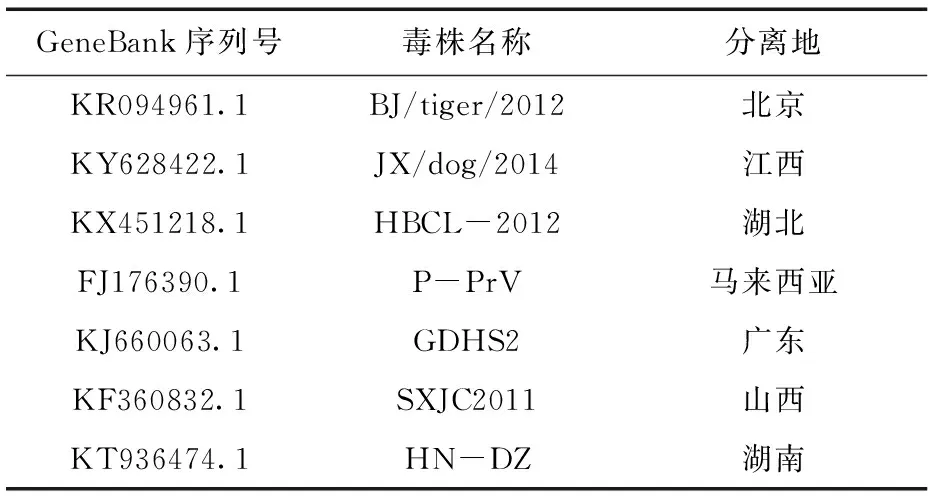
表1 本研究中所收集的国内外PRV毒株的gE基因Tab.1 The gE genes of domestic and foreign PRV strains
2 结果与分析
2.1 PRV GZ-JS2017株gE基因的PCR扩增及其TA克隆
提取病毒液核酸进行PCR扩增,经电泳凝胶检测见有1700 bp左右的目的条带,结果与预期相符(图1)。

M:DNA DL 2 000Marker 1:PRVgE基因PCR扩增
图1 PRVgE基因的PCR产物电泳检测结果
Fig.1 PCR product ofgEgene of PRV
将PCR产物纯化回收后TA克隆至pMD19-T载体,经过氨苄抗性和双酶切等鉴定后的阳性重组质粒送生工生物工程(上海)股份有限公司进行测序,将测序结果与NCBI上的相关RRVgE基因进行比对,结果相似度均在95%以上,表明构建成功且所获得序列为PRVgE基因序列。其序列如下:
5'-ATGCGGCCCTTTCTGCTGCGCGCCGCGC AGCTCCTGGCGCTGCTGGCCCTGGCGCTCTCCACC GAGGCCCCGAGCCTCTCCGCCGAGACGACCCCGG GCCCCGTCACCGAGGTCCCGAGTCCCTCGGCCGA GGTCTGGGACGACCTCTCCACCGAGGCCGACGAC GATGACCTCAACGGCGACCTCGACGGCGACGACC GCCGCGCGGGCTTCGGCTCGGCCCTCGCATCCCTG AGGGAGGCGCCCCCGGCCCATCTGGTGAACGTGTC CGAGGGCGCCAACTTCACCCTCGACGCGCGCGGCG ACGGCGCCGTGCCGGCCGGGATCTGGACGTTCCTG CCCGTCCGCGGCTGCGACGCCGTGTCGGTGACCAC GGTGTGCTTCGAGACCGCGTGCCACCCGGACCTGG TGCTGGGCCGCGCCTGCGTCCCCGAGGCCCCGGAG ATGGGCATCGGCGACTACCTGCCGCCCGAGGTGCC GCGGCTCCGGCGCGAGCCGCCCATCGTCACCCCG GAGCGGTGGTCGCCGCACCTGAGCGTCCTGCGGGC CACGCCCAACGACACGGGCCTCTACACGCTGCACG ACGCCTCGGGGCCGCGGGCCGTGTTCTTTGTGGCGG TGGGCGACCGGCCGCCCGCGCCGGCGGACCCGGT GGGCCCCGCGCGCCACGAGCCCCGCTTCCACGCG CTCGGCTTCCACTCGCAGCTCTTCTCGCCCGGGGAC ACGTTCGACCTGATGCCGCGCGTGGTCTCGGACATG GGCGACTCGCGCGAGAACTTTACCGCCACGCTGGA CTGGTACTACGCGCGCGCGCCCCCGCGGTGCCTGC TGTACTACGTGTACGAGCCCTGCATCTACCACCCGC GCGCGCCCGAGTGCCTGCGCCCGGTGGACCCGGC GTGCAGCTTCACCTCGCCGGCGCGCGCGCGGCTGG TGGCGCGCCGCGCGTACGCCTCGTGCAGCCCGCTG CTCGGGGACCGGTGGCTGACCGCCTGCCCCTTCGA CGCCTTCGGCGAGGAGGTGCACACGAACGCCACCG CGGACGAGTCGGGGCTGTACGTGCTCGTGATGACC CACAACGGCCACGTCGCCACCTGGGACTACACGCT CGTCGCCACCGCGGCCGAGTACGTCACGGTCATCA AGGAGCTGACGGCCCCGGCCCGGGCCCCGGGCAC CCCGTGGGGCCCCGGCGGCGGCGACGACGCGATC TACGTGGACGGCGTCACGACGCCGGCGCCGCCCGC GCACCCGTGGAACCCGTACGGCCGGACGACGCCCG GGCGGCTGTTTGTGCTGGCGCTGGGCTCCTTCGTG ATGACGTGCGTCGTCGGGGGGGCCATCTGGCTCTG CGTGCTGTGCTCCCGGCGCCGGGCGGCCTCGCGG CCGTTCCGGGTGCCGACGCGGGCGCGGACGCACA TGCTCTCTCCGGTGTACACCAGCCTGCCCACGCAC GAGGACTACTACGACGGCGACGACGACGACGACG AGGAGGCGGGCGTCATCCGCCGGCGGCCCGCCTC CCCCAGCGGAGACAGCGGCTACGAGGGGCCGTAC GCGAGCCTGGACCCCGAGGACGAGTTCAGCAGCG ACGAGGACGACGGGCTGTACGTGCGCCCCGAGGA GGCGCCCCGCTCCGGCTTCGACGTCTGGTTCCGCG ATCCGGAGAAACCGGAAGTGACGAATGGACCCAA CTATGGCGTGACCGCCAACCGCCTGTTGATGTCCC GCCCCGCTTAA-3'
将所获得的核苷酸序列所编码的氨基酸进行推导,结果如下:
MRPFLLRAAQLLALLALALSTEAPSLSAETTPG PVTEVPSPSAEVWDDLSTEADDDDLNGDLDGDDRR AGFGSALASLREAPPAHLVNVSEGANFTLDARGDGA VPAGIWTFLPVRGCDAVSVTTVCFETACHPDLVLGR ACVPEAPEMGIGDYLPPEVPRLRREPPIVTPERWSP HLSVLRATPNDTGLYTLHDASGPRAVFFVAVGDRPP APADPVGPARHEPRFHALGFHSQLFSPGDTFDLMP RVVSDMGDSRENFTATLDWYYARAPPRCLLYYVYE PCIYHPRAPECLRPVDPACSFTSPARARLVARRAYA SCSPLLGDRWLTACPFDAFGEEVHTNATADESGLY VLVMTHNGHVATWDYTLVATAAEYVTVIKELTAPA RAPGTPWGPGGGDDAIYVDGVTTPAPPAHPWNPY GRTTPGRLFVLALGSFVMTCVVGGAIWLCVLCSRRR AASRPFRVPTRARTHMLSPVYTSLPTHEDYYDGDD DDDEEAGVIRRRPASPSGDSGYEGPYASLDPEDE FSSDEDDGLYVRPEEAPRSGFDVWFRDPEKPEV TNGPNYGVTANRLLMSRPA.
2.2 PRV GZ-JS2017株gE基因的遗传特征分析
测序结果表明,GZ-JS2017株gE基因完整编码区长1740 bp,可编码579个氨基酸残基,其中A+T = 26.03%,C+G = 73.97%。根据gE基因的核苷酸序列分析结果显示:所收集的株序列中,变异区主要集中于140 bp~142 bp,国内毒株均在其间插入ACG,1489 bp~1491 bp国内毒株大部分插入了GAC;与所有毒株比对GZ-JS2017株在1250 bp出现了G→A(图2)。由此推导,本次所分离毒株GZ-JS2017株经gE基因序列分析发现在gE的aa 48和gE的aa 496均有1个天冬氨酸的插入。

图2 PRV gE变异点比对Fig.2 Mutation loci alignment of gE gene of PRV
gE基因的核苷酸分析结果显示PRV不同地域毒株之间同源率达98.8%~99.9%,而推导氨基酸序列同源率达98.3%~99.7%。其中,核苷酸同源性和氨基酸相似性均最高的是GZJS2017株与BJ-tiger-2012株、GDHS2株gE基因,核苷酸同源性为99.9%,氨基酸相似性为99.7%。结果见图3、图4。

图3 PRV gEI基因的核苷酸同源性比对Fig.3 Nucleotide homology alignment of gE gene of PRV

图4 PRV gE基因所推导的氨基酸序列相似性比对Fig.4 Amino acid sequence alignment deduced from gE gene of PRV
将GZ-JS2017株与表1中所收集的序列应用生物学信息软件进行系统发育进化树构建(图5)。基于gE基因氨基酸序列的遗传进化分析得知:GZJS2017株与GDHS2株、HN-DZ株处于同一较小分支上,形成单独的1个小亚群,推测这3株PRV具有较近血缘关系;与GZ-JS2017株遗传关系较远的是SXJC2011株,且SXJC2011株单独处于一个支系。

图5 PRV gE基因系统发育进化树Fig.5 phylogenetic tree of gE gene of PRV
3 讨论与结论
在研究过程中,有研究人员将PRV变异毒株与经典毒株相比较发现,在gE蛋白的第48位和第492位中各存在一个天冬氨酸(Asp)的插入,尤其是在第492位的一个天冬氨酸的插入可视作鉴定PRV变异株的分子特征[14]。在本研究中,作者选取GenBank中来源不同的毒株进行对比,发现在这两个位点的天冬氨酸插入与PRV毒株的分离年代和分离地区均无显著的变化规律。此外,疫苗株(Bartha-K61)可对经典株(PRV S株)提供完整的免疫保护,但对变异株(PRV-HeNI )则无法完全保护,这揭示了PRV经典株和变异株之间存在着抗原性差异[15]。文中所研究的基因是从贵州省金沙县某规模化养猪场疑似感染PRV的猪脑组织、淋巴结及脏器混合样本所分离出的毒株。经gE基因序列分析发现在gE48位和gE496位均有1个天冬氨酸的插入,符合变异毒株基本特征。通过分析,GZ-JS2017株的gE基因与不同地域毒株之间的同源性达98.8%~99.9%,而推导氨基酸序列同源性达98.3%~99.7%。其中,核苷酸同源性和氨基酸相似性均最高的是BJ-tiger-2012株、GDHS2株gE基因,核苷酸同源性为99.9%,氨基酸相似性为99.7%。结果可为贵州地区的PRV的分子流行病学提供一定参考。
综上,从文中gE基因结果可推测该毒株为变异毒株。在后续研究中,课题组将从gE基因遗传变异规律和作用机理方面进行研究,为进一步预防、控制和根除猪伪狂犬病的发生和流行提供一定的参考依据。
参 考 文 献:
[1] 殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997:998-1856.
[2] B·E·斯特劳,S·D·阿莱尔,W·L·蒙加林,等.猪病学[M].8版.北京:中国农业大学出版社,2000:195-196.
[3] 陈溥言.兽医传染病学[M].6版.北京:中国农业出版社,1979:221-223.
[4] Fuchs W, Backovic M, Klupp B G,etal.Structure-based mutational analysis of the highly conserved domain IV of glycoprotein H of pseudorabies virus[J].JournalofVirology, 2012, 86(15):8002.
[5] Wills E, Mou F, Baines J D.The UL31 and UL34 Gene Products of Herpes Simplex Virus 1 Are Required for Optimal Localization of Viral Glycoproteins D and M to the Inner Nuclear Membranes of Infected Cells[J].JournalofVirology, 2009, 83(10):4800-4809.
[6] 余秋颖,常洪涛,陈文定.2012-2013年新流行猪伪狂犬病病毒的分离鉴定及其gE、TK、gD基因序列分析[J].中国兽医学报,2014,34(10):1573-1583.
[7] Prieto J,Martin Hennandez A M,Tabares E.Loss of pseudorabies virus thymidine kinase activity due to a single base mutation and amino acid substitution[J].JGenVirol,1991,72(5):35-39.
[8] 陈华良,王和兴,李小鹏,等.广东地区猪伪狂犬病流行病学调查与gE、TK基因遗传进化分析[J].广东畜牧兽医科技,2016,41(2):5-9.
[9] 马兴杰.鉴别猪伪狂犬病病毒gE、gB、gG的纳米PCR及荧光定量PCR方法的建立及评价[D].哈尔滨:哈尔滨兽医研究所.
[10] 杨汉春.猪伪狂犬病的流行现状与特点[J].猪业科学, 2016, 33(1):38-38.
[11] 行 宇.河南部分地区猪伪狂犬病流行病学调查[D].郑州:河南农业大学,2014.
[12] 刘吉山,李 峰,姚春阳,等.猪伪狂犬病的流行特点与防控误区[J].北方牧业,2015(15):18-19.
[13] 李 宁,吴志明,闫若潜,等.2012-2014年河南省猪伪狂犬病病毒gE基因和TK基因的遗传变异分析[J].中国兽医学报,2016,36(10):1653-1657.
[14] 赵鸿远, 彭金美, 安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE基因的分子特征[J].中国预防兽医学报,2014,36(07):506-509.
[15] AN T Q, PENG J M, TIAN Z J,etal.Pseudorabies virus variabp in Bartha-K61-vaccinated pigs, China, 2012[J].EmergingInfectiousDiseases, 2013, 19(11):1749.
