胰岛素强化治疗成人重型颅脑损伤后高血糖症
2018-06-15王建伟刘宇梁伏光辉
王建伟 文 学* 刘宇梁 康 新 伏光辉 袁 涛
(连云港市东方医院神经外科,江苏 连云港 222042)
颅脑创伤后发生的高血糖症与患者的预后有直接关联[1-2],干预颅脑创伤后的高血糖症研究具有重要的临床意义。部分研究表明严格控制患者血糖水平可以明显降低病死率和改善预后,但对TBI后高血糖进行过度严格的控制将对患者带来很多损害,严重低血糖会对患者的预后造成威胁,因此采取科学合理的胰岛素控制方案[3]是临床迫切需要的。本课题不仅研究不同的血糖控制方案与患者预后的关系,同时也着力研究与患者严重低血糖事件、机械通气时长、ICU住院天数等指标之间的关系。
1 资料与方法
1.1 一般资料:本临床研究纳入2014年1月至2017年6月于连云港市东方医院接受神经重症治疗的共计188例重型TBI患者,信封法将患者随机分为胰岛素强化治疗组和非强化治疗组(对照组)。
1.2 纳入及排除标准。纳入标准:①年龄≥18岁;②临床诊断为重型TBI;③ICU住院时间预计>72 h。排除标准:①合并除TBI外其他器官的严重损伤;②入院时生命体征难以维系的濒死患者。
1.3 治疗方案
1.3.1 TBI的管理:所有患者均行重症监护治疗。GCS≤8患者行机械通气,必要时行气管切开。应用咪达唑仑或丙泊酚适度镇静,芬太尼或舒芬太尼行适度镇痛。依据颅脑损伤的指南进行管理。GCS≤8或者颅脑CT显示有进行性脑积水患者行侧脑室穿刺(EVD)及颅内压监测,颅内压>20 mm Hg时适当释放脑脊液或加强镇静或给予甘露醇等脱水药物或行短时程亚低温治疗,均不能奏效时行去骨瓣减压术。脑灌注压维持在60~70 mm Hg,必要时使用去甲肾上腺素等血管活性药物。同时为预防继发性脑损伤,需要尽量维持以下指标:PaO2≥80 mm Hg、35≤PCO2≤45 mm Hg、体温维持在36~38 ℃、血浆渗透压维持280~320 mmol/L。
1.3.2 血糖管理:强化治疗组将目标血糖控制在4.4~6.1 mmol/L、对照组将目标血糖控制在5.5~10.0 mmol/L。胰岛素剂量参照美国耶鲁胰岛素输注方案,胰岛素剂量(U)=[空腹血糖(mmol/L)×18-100]×10×体质量(kg)×0.6/1000/2。胰岛素注射液规格:10 mL∶400 U。
有动脉置管者优先取动脉血,否则采末梢血行快速血糖监测。统一采用50 mL 0.9%生理盐水配50 U普通胰岛素静脉泵入。所有患者均早期经鼻胃管或鼻肠管经输液泵行肠内营养,肠内营养剂型根据患者的胃肠功能情况选用,逐渐增多并达到20~30 kcal/(kg·d)。
1.3.3 资料收集及预后评估:收集两组患者的年龄等基本临床资料、血糖值、入院后5 d内每日平均胰岛素用量颅内压等指标。将血糖低于2.2 mmol/L界定为严重低血糖。应用格拉斯哥预后分级(Glasgow outcome scale,GOS)评估两组患者第90天神经功能作为中期预后指标,将GOS1(死亡),GOS2(植物生存),GOS3(重度残疾)归为预后不良,将GOS4(轻度残疾),GOS5(恢复良好)归为预后良好;另外还就两组患者严重低血糖事件、第28天GOS、28 d内机械通气时长、ICU住院天数、ICU病死率等指标进行比较。
1.4 统计学方法:所有统计学数据用SPSS13.0软件进行数据处理。计数资料用“频数(百分比)”表示,通过卡方检验进行组间比较;计量资料需先进行正态性检验,符合正态分布的定量资料用“均数±标准差”表示,组间比较用方差分析;不符合正态分布的用“中位数(第25及第75百分位数)”描述,通过非参数Kruskal-Wallis H检验进行比较。以转归作为结局,进行logistic单因素和多因素回归分析,探索各因素对死亡的影响。P≤0.05为差异有统计学意义。
2 结 果
2.1 基线分析:符合纳入及排除标准的共188例,强化治疗组90例(48%),对照组98例(52%)。178例(95%)接受了机械通气时间>2 d。强化治疗组47例(52.2%)应用了颅内压监测,对照组34例(34.6%)应用了颅内压监测,差异有统计学意义(P=0.01)。基线分析两组有可比性,见表1。
2.2 血糖控制:入院后前5 dIIT组使用胰岛素总量大于对照组(P=0.01),IIT组空腹血糖低于对照组(P<0.01);IIT组较对照组有更多患者需接受胰岛素治疗(P<0.01);两组患者发生严重低血糖的例数差异无统计学意义(P=0.50),见表2。
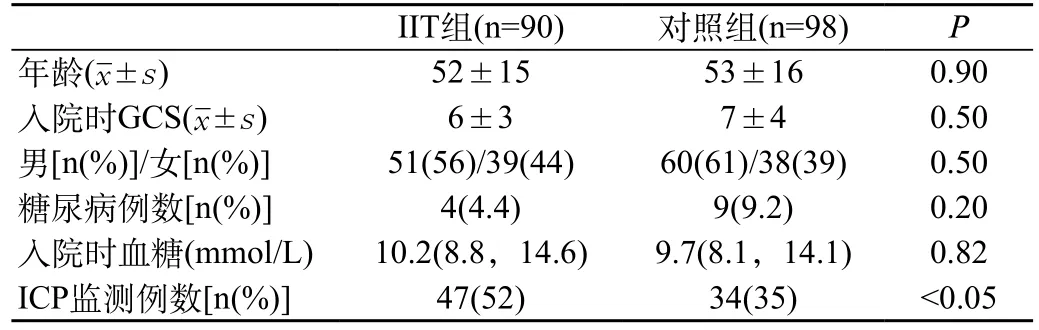
表1 两组患者的基本资料

表2 两组患者血糖控制情况
2.3 预后情况:第90天,IIT组恢复良好(GOS 4,5)26例(28.9%),对照组恢复良好34例(34.7%),两组差异无统计学意义。第28天神经功能、病死率、ICU住院天数及机械通气天数差异均无统计学意义,见表3。

表3 两组患者的预后指标比较[n(%)]
2.4 预后回归分析:以第90天预后作为应变量,其中预后良好(GOS4,5)取值为1,预后不良(GOS1,2,3)取值为0,进行二项分类logistic回归显示影响预后良好的因素有未实施去骨瓣减压(OR=1.70,95%CI=1.25~2.3,P<0.01)、无ICU内院内获得性肺炎(OR=2.44,95%CI=1.82~3.27,P<0.01)、较低的血糖水平(OR=1.93,95%CI=1.36~2.76,P<0.01)、应用抗癫痫药(OR=2.98,95%CI=1.14~8.98,P<0.05)、较短的机械通气时长(OR=1.03,95%CI=0.95~1.13,P<0.01)。
3 讨 论
重型TBI的高致残率、高病死率带来沉重的经济负担及社会负担,且严重影响存活者的生存质量。重型TBI后继发性高血糖将会加剧脑损伤,与预后密切相关[1-2]。已经证实控制高血糖可改善ICU患者的预后[4],且越来越多的研究显示控制高血糖同样可改善脑损伤患者的预后[5],但胰岛素的强化治疗方案以及血糖控制的强度等尚需要更多的临床研究证实。
Graffignano等发现IIT将会导致严重低血糖的概率增加,延长住院时间及升高病死率,但该研究未对脑损伤患者的严重程度分组,颅内压也未常规监测,有一定的缺陷,因此未能提出合理的血糖控制方案。一项关于神经重症患者的Meta分析显示IIT组(3.9~7.8 mmol/L)较对照组(8.0~16.7 mmol/L)未降低病死率,但可改善神经功能预后,但该分析缺陷在于对照组血糖控制过度宽松,未能得出血糖控制最佳范围的结论。2015年NICE-SUGAR临床研究将TBI患者分为IIT组(4.5~6.0 mmol/L)及传统治疗组(<10 mmol/L),同样发现IIT将会导致严重低血糖的概率增加,但并未证实IIT可明显患者的预后[6]。一项针对重型TBI后高血糖症的临床研究IIT将目标血糖控制在4.4~6.1 mmol/L,结果表明可降低患者感染风险、缩短ICU住院时间、改善6个月GOS,但该研究缺陷在于对照组在血糖高出11.1 mmol/L时方才加以干预并且未提及胰岛素的给药方案。本研究结合以往的研究结果将IIT组目标血糖定为4.4~6.1 mmol/L、对照组将目标血糖控制在5.5~10.0 mmol/L更加合理。
目前公认继发性高糖与重症患者预后密切相关[7-8],但本研究发现IIT未能明显改善重型TBI的第90天预后,进一步研究将延长随访时间。Magnoni等对ICU的急性TBI患者进行脑及皮下微透析监测证明TBI患者全身和大脑葡萄糖之间存在线性关系,故而过度严格地控制全身血糖水平将导致脑组织葡萄糖含量明显下降,从而加剧脑组织有氧代谢障碍,加重脑损伤,Meierhans R等发现当认为将重型TBI后高血糖患者血糖控制在低于6 mmol/L时脑代谢将会受损,因而对重型TBI后血糖水平进行动态监测并行适当干预方可减轻神经细胞损伤以及改善预后。显然胰岛素强化治疗会提高低血糖的风险,许多研究提出低血糖是ICU患者病死率的独立影响因素,但又有研究不支持此观点[9-10],本研究也表明IIT组会使得严重低血糖概率增加,但未明显影响患者病死率。
早期高血糖是脑损伤应激反应的一个重要组成部分,是其严重程度的一个重要指标,故而本研究中采用前5 d血糖值及胰岛素用量等指标进行分析,5 d后各组胰岛素使用剂量逐日下降的情况下,各组血糖变化趋于正常水平,说明TBI后高血糖症是一种暂时的应激反应。
本研究为单中心临床研究,依据TBI指南同质化管理,防止偏倚。脑损伤患者易出现呼吸系统并发症且会影响患者的预后,该研究也发现机械通气时长较短的患者预后较好,针对如何尽早脱机的策略对研究者采取了统一的培训。
[1] Khajavikhan J,Vasigh A,Kokhazade T,et al.Association between Hyperglycaemia with Neurological Outcomes Following Severe Head Trauma[J].J Clin Diagn Res,2016,10(4):PC11-13.
[2] 邢梦杨,陈岩,李奕锋,等.急性颅脑损伤病人血糖水平与病情及预后关系[J].青岛大学医学院学报,2015,51(1):83-84.
[3] Cinotti R,Ichai C,Orban JC,et al.Effects of tight computerized glucose control on neurological outcome in severely brain injured patients:a multicenter sub-group analysis of the randomized-controlled open-label CGAO-REA study[J].Crit Care,2014,18(5):498.
[4] Mahmoodpoor A,Hamishehkar H,Shadvar K,et al.Relationship between glycated hemoglobin, Intensive Care Unit admission blood sugar and glucose control with ICU mortality in critically ill patients[J].Indian J Crit Care Med,2016,20(2):67-71.
[5] Godoy DA,Behrouz R,Di NM.Glucose control in acute brain injury:does it matter?[J].Curr Opin Crit Care,2016,22(2):120-127.
[6] Finfer S,Chittock D,Li Y,et al.Intensive versus conventional glucose control in critically ill patients with traumatic brain injury: longterm follow-up of a subgroup of patients from the NICE-SUGAR study[J].Intensive Care Med,2015,41(6):1037-1047.
[7] Sai SPV,Mishra SB,Ghosh PS,et al.Relationship between glycated hemoglobin, Intensive Care Unit admission blood sugar and glucose control with Intensive Care Unit mortality in critically ill[J].Indian J Crit Care Med, 2016,20(4):254-255.
[8] 庄伟,谢培,周建梁.强化胰岛素治疗重度颅脑损伤并发高血糖的疗效观察[J].神经损伤与功能重建,2017,12(3):272+280.
[9] Kalfon P,Giraudeau B,Ichai C,et al.Tight computerized versus conventional glucose control in the ICU: a randomized controlled trial[J].Intensive Care Med,2014,40(2):171-181.
[10] Wolahan SM,Prins ML,McArthur DL,et al.Influence of Glycemic Control on Endogenous Circulating Ketone Concentrations in Adults Following Traumatic Brain Injury[J].Neurocrit Care,2017,26(2):239-246.
