时间-平均血尿酸水平与新发慢性肾脏病的关系研究
2018-06-14叶美玉胡康金娟胡培英何强
叶美玉 胡康 金娟 胡培英 何强
近年来,随着国民生活水平的提高,日常饮食中高嘌呤含量的食物摄入量不断增加,高尿酸血症(HUA)患病人数日益增多。HUA不仅会导致痛风,还与高血压、心血管疾病、代谢综合征以及肾脏疾病等发生相关。同时,由于慢性肾脏病(CKD)发病率居高不下,随之而来的终末期肾病(ESRD)、心血管疾病和过早死亡等风险的增加[1],CKD已逐渐成为全球性的健康问题。已有动物实验研究发现,血尿酸水平升高与CKD的发生、发展密切相关[2-4]。大部分流行病学研究结果表明,HUA在CKD的发生、发展中起重要作用[5-7];然而,也有部分学者提出,HUA并不一定是CKD的独立危险因素,尤其是在调整混杂因素后,原因是HUA患者往往同时伴随着糖尿病、高血压、代谢紊乱等导致CKD的易感因素[8-10]。因此,关于血尿酸水平升高是否为CKD的危险因素,目前尚存在争议。本研究通过对大样本健康成人进行血尿酸值检测与肾功能评估,分析并探讨普通成人时间-平均血尿酸水平与CKD的关系,现报道如下。
1 对象和方法
1.1 对象 选取2011年1月1日至2016年12月31日在浙江省人民医院体检中心每年健康体检的非CKD普通成人5 701例为研究对象,年龄25~85岁,其中男3 493例,女2 208例。纳入标准:初始肾功能正常,即基线估算的肾小球滤过率(eGFR)>60 ml/min/1.73m2,且尿蛋白阴性;无尿路感染、原发性和继发性肾小球疾病;无精神病史,语言表达能力正常。排除标准:既往患有心血管系统疾病(心绞痛或心肌梗死等)、脑血管疾病(脑中风、脑出血或脑梗死等)、肝功能明显异常、感染性疾病及恶性肿瘤等患者,有肾脏手术史、曾行肾脏替代治疗的患者。
1.2 数据采集 记录所有研究对象的生理检查和生化指标结果,包括体检者2011年初次体检的个人信息(姓名、性别、年龄),晨起空腹体重、净身高,计算BMI,测量平静状态下收缩压(SBP)、舒张压(DBP)。空腹抽取静脉血标本并利用自动生化酶谱分析仪检测相关实验室指标:血尿酸、血肌酐(Scr)、血尿素氮、空腹血糖、TC、TG、HDL-C、LDL-C。取晨尿标本利用散射比浊法测量尿蛋白(定性)。询问既往史。根据肾脏疾病饮食控制(MDRD)公式计算eGFR=186×Scr-1.154×年龄-0.203(女性×0.742)ml/(min·1.73m2)[11];2011至2016年期间每年记录血尿酸值并评估eGFR,利用每年检测的血尿酸值计算时间-平均血尿酸水平。
1.3 分组方法 将该人群2011年初次体检的结果作为基线特征,根据初始血尿酸的四分位数分为4组,第1组为血尿酸≤297.5μmol/L,第2组为血尿酸297.6~333.2μmol/L,第 3 组为血尿酸 333.3~368.9μmol/L,第 4组为血尿酸>368.9μmol/L。经过6年的随访后,将所有研究对象按时间-平均血尿酸的四分位数分为4组,第1组为时间-平均血尿酸≤273.7μmol/L,第2组为时间-平均血尿酸 273.8~333.2μmol/L,第3组为时间-平均血尿酸 333.3~392.7μmol/L,第4组为时间-平均血尿酸>392.7μmol/L。以尿酸4分组为自变量,有无新发CKD为因变量,采用二分类logistic回归分析和Cox比例风险模型来调整各混杂因素的影响,并计算出各组新发CKD的相对危险度(OR)和风险比(HRs)。
1.4 评价标准 超重诊断标准:24<BMI<28。肥胖诊断标准:BMI≥28。高血压诊断标准:非同日3次测量血压,SBP>140mmHg或DBP>90mmHg,或自诉既往有高血压史。糖尿病诊断标准:空腹血糖≥7.0mmol/L(126mg/dl),或自诉既往有糖尿病史。HUA诊断标准:男性血尿酸>420μmol/L(7mg/dl),女性血尿酸>360μmol/L(6 mg/dl)。CKD 诊断标准:参照2012年改善全球肾脏病预后组织(KDIGO)制定的临床实践指南中对CKD的定义,肾脏结构或功能异常,如肾脏损伤指标(如蛋白尿、血尿或解剖学异常)或肾小球滤过率(GFR)<60ml/(min·1.73m2),任一指标异常持续时间>3个月,且这种结构或功能的异常对健康有影响。
1.5 观察指标 (1)比较不同血尿酸水平组体检者基线特征;(2)比较新发CKD组与非CKD组体检者基线特征:经过6年的随访,筛选新发CKD与非CKD体检者;(3)比较不同血尿酸水平组体检者、不同时间-平均血尿酸水平组体检者发生CKD的OR值;(4)比较不同血尿酸水平组体检者、不同时间-平均血尿酸水平组体检者发生CKD的HRs值。
1.6 统计学处理 应用SPSS 20.0统计软件;正态分布的计量资料以表示,多组间比较采用单因素方差分析;非正态分布的计量资料以 M(P25,P75)表示,多组比较采用Wilcoxon秩和检验;计数资料以频数和构成比表示,组间比较采用χ2检验;采用多因素校正的二分类logistic回归分析和Cox比例风险模型来调整混杂因素的影响并进行危险因素分析;P<0.05为差异有统计学意义。
2 结果
2.1 不同血尿酸水平组体检者基线特征比较 见表1。
由表1可见,4组体检者性别、年龄、BMI、超重率、肥胖率、血压、血脂指标、血尿素氮、空腹血糖、eGFR、高血压、CKD患病率等方面比较差异均有统计学意义(均P<0.05),而糖尿病患病率比较差异无统计学意义(P >0.05)。
2.2 新发CKD组与非CKD组体检者基线特征比较见表2。
由表2可见,新发CKD组体检者的年龄、BMI、超重率、肥胖率、血压、血脂指标、血尿素氮、空腹血糖、初始血尿酸、时间-平均血尿酸及HUA、高血压、糖尿病患病率均高于非CKD组(均P<0.05),而肾功能(eGFR)低于非CKD组(P<0.05)。

表1 不同血尿酸水平组体检者基线特征比较
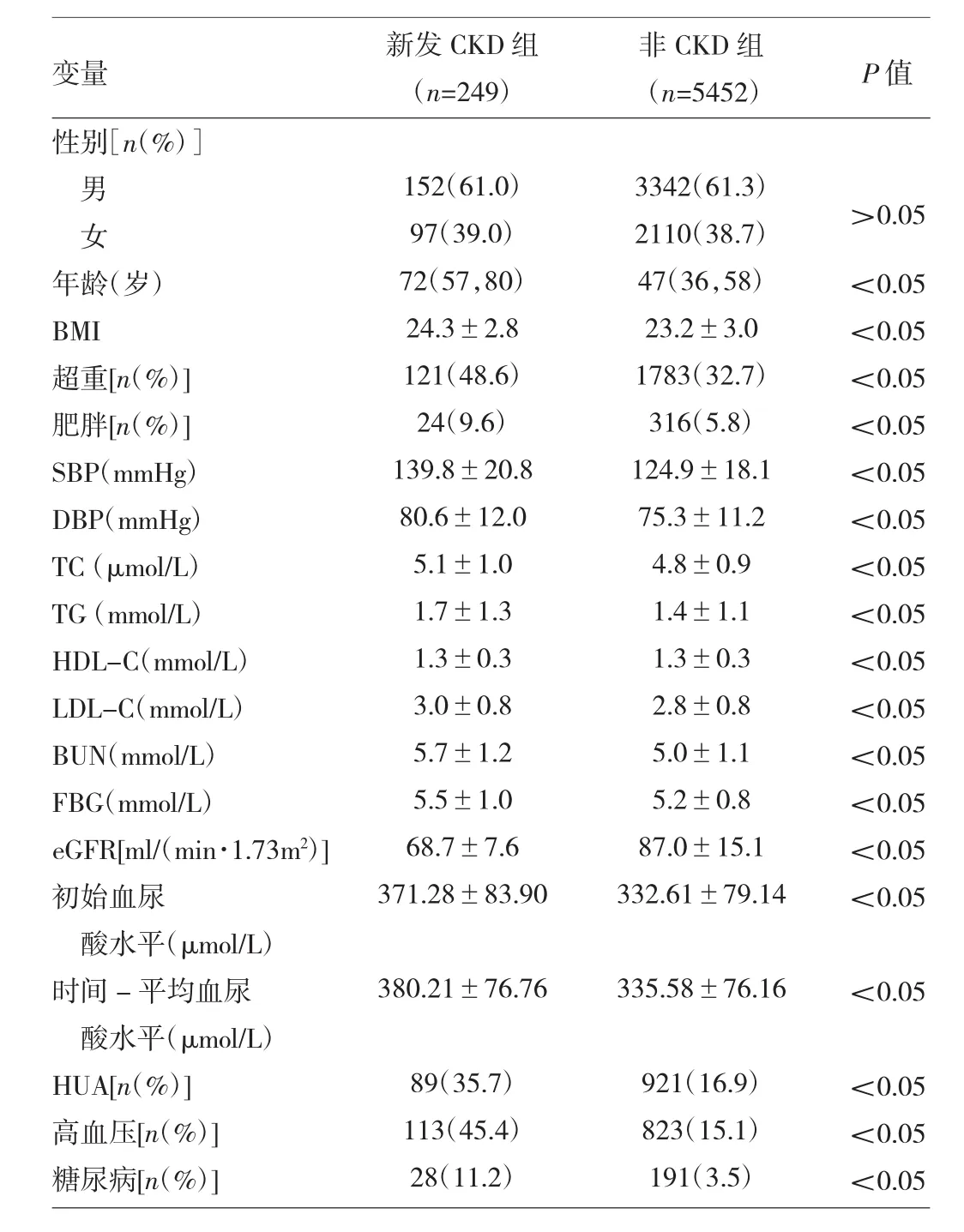
表2 新发CKD组与非CKD组体检者基线特征比较
2.3 不同血尿酸水平组体检者、不同时间-平均血尿酸水平组体检者发生CKD的OR值比较 见图1。
由图1可见,对基线血尿酸值各组变量进行二分类logistic回归分析,发现在校正性别和年龄后,各组发生CKD的OR值随基线尿酸水平升高而升高。第1组OR=1.00,第 2 组 OR=1.981(95%CI:1.195~3.283,P<0.05),第 3 组 OR=2.177(95%CI:1.277~3.712,P<0.05),第 4组 OR=3.864(95%CI:2.240~6.668,P<0.05)。当进一步调整相关混杂因素后,仍然可见新发CKD风险增加的趋势,第2~4组OR值分别为1.726(95%CI:1.017~2.930,P<0.05)、1.455(95%CI:0.831~2.547,P >0.05)、2.162(95%CI:1.208~3.870,P<0.05)。而相比之下,随着年龄和性别校正后时间-平均血尿酸水平的升高,各组发生CKD的OR值增加趋势比基线尿酸更加明显,第2~4组 OR 值分别为 3.004(1.567~5.756,P<0.05)、4.794(2.473 ~9.291,P <0.05)、11.718 (5.971 ~22.993,P <0.05)。同样地,在调整所有混杂因素后,尽管时间-平均血尿酸水平各组新发CKD的OR值均有所下降,但差异仍较基线尿酸显著 [第2~4组OR值分别为2.709(95%CI:1.386~5.293)、3.754(95%CI:1.898~7.428)、7.462(95%CI:3.694~15.073),均P<0.05]。
2.4 不同血尿酸水平组体检者、不同时间-平均血尿酸水平组体检者发生CKD的HRs值比较 见图2。

图1 不同组间性别与年龄校正模型和多因素校正模型logistic分析结果

图2 不同组间性别与年龄校正模型和多因素校正模型Cox生存分析结果
由图2可见,以新发CKD作为终点事件,将初次出现终点事件的时间加入Cox比例风险模型中进行分析。结果显示,在校正性别和年龄后,最高基线尿酸组发生CKD的风险率是最低基线尿酸组的4倍(HRs=4.053,95%CI:2.469~6.652,P<0.05);最高时间-平均血尿酸组发生CKD的风险是最低时间-平均血尿酸组的 10 倍 (HRs=10.134,95%CI:5.327~19.279,P<0.05)。进一步调整所有混杂因素后,基线尿酸各组间的风险率均有所减弱,第2~4组HRs值分别为1.532(95%CI:0.947~2.478)、1.316(95%CI:0.809~2.139)、1.689(95%CI:1.058~2.696)。相比之下,时间-平均血尿酸水平各组间发生CKD的风险差异仍较显著[第2~4 组 HRs值分别为 2.491(95%CI:1.324~4.687)、3.268 (95%CI:1.728~6.180)、6.320 (95%CI:3.285~12.159),均P<0.05]。
3 讨论
尿酸是人类嘌呤化合物的代谢终产物,正常人体尿液中的产物主要为尿素氮,含少量尿酸。人类的正常血尿酸浓度为200~450μmol/L,健康男性血尿酸水平是女性的1.2倍左右。尿酸在肾脏排泄的经典模型是由以下4步组成的:肾小球的滤过(100%),肾小管的重吸收(98%~100%)、肾小管的再分泌(50%)、分泌后的再次重吸收(40%)。因此,当尿酸产生过多、肾脏清除尿酸过少或者两种因素同时存在时,易导致尿酸在人体血液中过度累积。近年来,相关动物实验及临床观察研究表明,HUA易导致肾脏发生肾小球动脉硬化和间质纤维化[12],在纠正高尿酸症状后可以显著改善肾脏血管病变程度,从而减少尿蛋白,进而改善肾功能。目前认为,HUA引起肾脏疾病的机制包括介导肾脏炎症反应、肾小球入球小动脉病变、趋化因子和细胞因子表达增强、肾素-血管紧张素-醛固酮系统(RAAS)激活和细胞环氧化酶-2(COX-2)活化、介导氧化应激等[13-16]。
流行病学研究不断证实,HUA与心血管事件及病死率的关联不仅易发生于慢性肾脏病,高血压或者基础心血管疾病的患者身上,且也在存在于正常人群中。在韩国、日本及欧美国家的横断面研究中发现,HUA水平与CKD患病风险之间存在相关性[17-19]。一项对日本健康人群和肾功能轻度下降人群血尿酸和CKD进展之间关系的研究显示,血尿酸水平≥360μmol/L的受试者人群较240~294μmol/L的受试者人群其肾脏损害的风险大大提高[18]。Domrongkitchaiporn等[19]研究者通过对普通人群长达12年的队列研究证明,血尿酸水平升高是肾功能减退和CKD发病的危险因素。但是,在部分早期的观察性研究中一些学者持相反的观点,他们指出CKD患者出现HUA是由患者肾血管阻力增加所致,因此不认为HUA是CKD发病的独立危险因素[8-10]。Sturm等[9]研究者提出,HUA只在混杂因素校正前具有预示CKD发生的作用,在调整肾功能相关参数例如基线eGFR和蛋白尿后,HUA不再作为CKD发生和进展的危险因素。然而,近期一项包括15个队列研究在内的Meta分析显示,在调整代谢相关风险因素后,中年人群血尿酸水平升高和CKD风险增加之间呈正相关[20],这与本研究结果相一致。
本研究采用的是时间-平均血尿酸水平,与单次检测的血尿酸水平相比,更能准确地反应研究对象体内血尿酸水平维持状态与其肾功能进展之间的关系,进而强调了定期检测并有效管理血尿酸水平的重要性,对延缓肾功能进展具有很大的帮助意义。本研究尚存在一些不足之处及局限性。首先,本研究选取的是关注自身健康进而每年定期参与体检的人群,因此在研究对象的选择上难以做到绝对的完全随机。其次,由于是回顾性的横断面研究,本研究未能完整地收集研究对象的生活方式,例如饮食习惯、吸烟史、饮酒史、日常锻炼情况等资料,从而无法排除所有可能对血尿酸水平产生影响的潜在因素,因此,还有待进一步的大样本前瞻性研究来证实。
综上所述,本研究探讨了普通成人时间-平均血尿酸水平与CKD的关系。首先,研究发现除了HUA,正常范围内的稍高血尿酸水平同样与eGFR下降具有相关性,而未发现较低血尿酸水平对肾功能减退的影响。其次,多元回归分析表明单次高血尿酸水平与时间-平均高血尿酸水平两者都可作为新发CKD风险增加的独立危险因素,而时间-平均高血尿酸水平更具有预测意义,并且这种关系独立于其他可能的混杂因素,例如性别、年龄、高血压、糖尿病、肥胖等。
[1]Tonelli M,Wiebe N,Culleton B,et al.Chronic kidney disease and mortality risk:a systematic review[J].J Am Soc Nephrol,2006,7(7):2034-2047.
[2]Kang DH,Nakagawa T,Feng L,et al.A role for uric acid in the progression of renal disease[J].J Am Soc Nephrol,2002,13(12):2888-2897.
[3]Sanchez-Lozada LG,Tapia E,Santamaria J,et al.Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats[J].Kidney Int,2005,67(1):237-247.
[4]Sanchez-Lozada LG,Lanaspa MA,Cristobal-Garcia M,et al.Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Exp Nephrol,2012,121(3-4):e71-78.
[5]Obermayr RP,Temml C,Knechtelsdorfer M,et al.Predictors of new-onset decline in kidney function in a general middle-european population[J].Nephrol Dial Transplant,2008,23(4):1265-1273.
[6]Weiner DE,Tighiouart H,Elsayed EF,et al.Uric acid and incident kidney disease in the community[J].J Am Soc Nephrol,2008,19(6):1204-1211.
[7]Obermayr RP,Temml C,Gutjahr G,et al.Elevated uric acid increases the risk for kidney disease[J].J Am Soc Nephrol,2008,19(12):2407-2413.
[8]Madero M,Sarnak MJ,Wang X,et al.Uric acid and long-term outcomes in CKD[J].Am J KidneyDis,2009,53(5):796-803.
[9]Sturm G,Kollerits B,Neyer U,et al.Uric acid as a risk factor for progression of non-diabetic chronic kidney disease?The Mild to Moderate KidneyDisease(MMKD)Study[J].Exp Gerontol,2008,43(4):347-352.
[10]Kuriyama S,Maruyama Y,Nishio S,et al.Serum uric acid and the incidence of CKD and hypertension[J].Clin Exp Nephrol,2015,19(6):1127-1134.
[11]Ma YC,Zuo L,Chen JH,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937-2944.
[12]Filiopoulos V,Hadjiyannakos D,Vlassopoulos D.New insights into uric acid effects on the progression and prognosis of chronic kidney disease[J].Ren Fail,2012,34(4):510-520.
[13]Zhou Y,Fang L,Jiang L,et al.Uric acid induces renal inflammation via activating tubular NF-κB signaling pathway[J].PLoS One,2012,7(6):e39738
[14]Sanchez-Lozada LG,Lanaspa MA,Cristobal-Garcia M,et al.Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Exp Nephrol,2012,121(3-4):e71-78.
[15]Rabadi MM,Kuo MC,Ghaly T,et al.Interaction between uric acid and HMGB1 translocation and release from endothelial cells[J].Am J Physiol Renal Physiol,2012,302(6):F730-741.
[16]Corry DB,Eslami P,Yamamoto K,et al.Uric acid stimulates vascular smooth muscle cell proliferation and oxidative stress via the vascular renin-angiotensin system[J].J Hypertens,2008,26(2):269-275.
[17]Mok Y,Lee SJ,Kim MS,et al.Serum uric acid and chronic kidney disease:the Severance cohort study [J].Nephrol Dial Transplant,2012,27(5):1831-1835.
[18]Toyama T,Furuichi K,Shimizu M,et al.Relationship between Serum Uric Acid Levels and Chronic Kidney Disease in a Japanese Cohort with Normal or Mildly Reduced Kidney Function[J].PLoS One,2015,10(9):e0137449.
[19]Domrongkitchaiporn S,Sritara P,Kitiyakara C,et al.Risk factors for development of decreased kidney function in a southeast Asian population:a 12-year cohort study[J].J Am Soc Nephrol,2005,16(3):791-799.
[20]Zhu P,Liu Y,Han L,et al.Serum uric acid is associated with incident chronic kidney disease in middle-aged populations:a meta-analysis of 15 cohort studies[J].PloS One,2014,9(6):e100801.
