乳腺癌新辅助化疗前后采用DCE-MRI进行疗效评估的临床价值
2018-06-13王巍巍李颖张迎周马祥敏杨素君
王巍巍,李颖,张迎周,马祥敏,杨素君
邯郸市中心医院CT室,河北 邯郸056001
乳腺癌是临床上女性常见的恶性肿瘤之一,具有高发病率和病死率,并且近年来其发病率呈逐年增高的趋势,严重威胁女性的生活质量和生命健康[1-2]。新辅助化疗(neoadjuvant chemotherapy,NAC)是非转移性肿瘤在局部治疗前进行的全身性治疗,可向心性或弥散性缩小肿瘤,并降低乳腺癌级别,提高对肿瘤的治疗效果,目前该方法在临床上应用广泛,但仍有一部分患者对NAC不敏感,因此对其疗效的评价至关重要[3-6]。动态增强磁共振(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRⅠ)检查在磁共振成像的基础上,可以了解瘤体的功能信息,包括供血状况、血管通透性以及细胞构成等,尤其是最大强化率、最大强化速率、最大强化斜率和达峰时间等峰值强化参数与肿瘤微血管密度密切相关,现已成为临床上评估NAC对乳腺癌治疗效果的有效方法[7-10];因此,本研究采用DCE-MRⅠ检查对乳腺癌患者实施NAC治疗前后的疗效进行评估,以探讨该方法的临床价值。
1 资料与方法
1.1 一般资料
选取2013年2月至2016年4月在邯郸市中心医院实施NAC的82例乳腺癌患者的临床资料。纳入标准:①患者均为首次确诊、首次接受NAC治疗;②NAC前患者经乳腺钼靶检查、超声检查及空心针穿刺活检确诊;③患者Karnofsky评分≥70分;④患者能坚持完成至少4个周期的NAC方案治疗;⑤患者具有影像学可测定的实体病灶。排除标准:①对NAC方案严重不耐受;②心、肺、肝、肾功能严重障碍;③转移性乳腺癌;④既往具有乳腺癌放化疗史或手术史;⑤病历资料不完整的患者。82例患者年龄37~66岁,平均(52.3±8.9)岁;病理学类型:浸润性导管癌70例,其他类型12例;月经状态:绝经29例,未绝经53例;肿瘤直径:≥2 cm 55例,<2 cm 27例;分化程度:高分化23例,中分化40例,低分化19例;临床分期标准参考美国癌症联合委员会(AJCC)标准:Ⅰ期21例,Ⅱ期61例;淋巴结转移49例。
1.2 化疗方案
所有患者的NAC治疗从穿刺活检病理检查确诊1~2 d后开始。82例患者均采用环磷酰胺800 mg/m2+表柔比星110 mg/m2+紫杉醇270 ng/m(2CET方案)治疗,分别于化疗前、患者完成4~6个疗程后采用DCE-MRⅠ进行检测,根据化疗效果将患者分为有效组和无效组,对比DCE-MRⅠ检测参数。
1.3 DEC-MRI检测及相关参数
比较两组患者化疗前后的早期强化参数、峰值强化参数:首过强化率、首过强化速率、早期强化率、早期强化速率、最大强化率、最大强化速率、最大强化斜率、达峰时间;比较两组化疗前后的肿瘤表观扩散系数(apparent diffusion coefficient,ADC)、定量参数容量转移常数(quantitative parameter capacity transfer constant,Ktrans)、细胞外血管外间隙容积比(volume ratio of extracellular space to extracellular space,Ve)、肿瘤直径的变化。将上述指标化疗前后差值的绝对值作为变化量进行组间比较。
MRⅠ检查方案及扫描参数:患者在化疗及穿刺前进行基线扫描,在化疗结束后行第2次MRⅠ扫描,穿刺时间与化疗后乳腺MRⅠ检查间隔1~7 d,平均3.4 d。
采用GE Signal 1.5 T双梯度MRⅠ扫描,患者呈俯卧位,为防止患者移动,使用机器自带绑带将患者固定,双侧乳腺自然下垂放置于4通道相控阵乳腺表面线圈。扫描包括:常规横断面FSE T1WⅠ(TR 675 ms,TE 11.5 ms,视野34 cm,激励次数2次,层厚4 mm,间隔1 mm),矢状面压脂T2W(ⅠTR 3800 ms,TE 85 ms,视野23 cm,激励次数2次,层厚4 mm,间隔1 mm),横轴面 STⅠR(TR 5000 ms,TE 42 ms,视野34 cm,激励次数2次,层厚4 mm,间隔1 mm),最后动态增强3D FSE序列扫描(TR 5.4 ms,TE 2.8 ms,视野34 cm,激励次数0.8次,层厚3 mm,间隔0 mm),每个动态时相采集52 s,共采集9个时相。动态增强前先扫描蒙片,然后用高压注射器通过肘静脉团注钆喷酸葡胺,0.2 mmol/kg,随后团注20 ml 0.9%氯化钠溶液,流率3 ml/s,注射结束后立即动态增强扫描。
采用GE Signa 750 3.0 T MRⅠ扫描仪,8通道乳腺专用相控阵表面线圈,患者取俯卧位,双乳自然下垂。扫描序列和参数:①脂肪抑制轴位T1WⅠ、T2WⅠ,TR 5985 ms,TE 86.5 ms,层厚4.0 mm,间隔1.0 mm,视野32 cm,矩阵320×256,激励次数3次;②扩散加权成像(diffusion weighted imaging,DWⅠ)采用单次激发 SE-EPⅠ,TR 300 ms,TE 80.6 ms,层厚4.0 mm,间隔1.0 mm,视野34 cm,激励次数6次,b值分别取0、1000 s/mm2,计算ADC;③DCE-MRⅠ应用针对乳腺优化的并行采集3D快速梯度回波序列双侧乳腺横断面及矢状面成像技术,扫描参数为 TR 3.9 ms,TE 1.7 ms,层厚 1.4 mm,无间隔扫描,矩阵320×320,FOV36,NEX 0.7。先行平扫,注射对比剂后开始行动态增强扫描,共扫描10期。采用高压注射器经静脉以2.0 ml/s流率团注对比剂Gd-DTPA,剂量0.2 mmol/kg,其后以同样的流率注入15 ml 0.9%氯化钠溶液冲洗导管内残留的Gd-DTPA。
图像处理与分析:影像图像由两名经验丰富的放射科医师分析,医师未知病理结果。图像的后处理通过AW43工作站,将动态增强图像及蒙片放入Functool SER软件处理。
1.4 疗效评估
参照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECⅠST)[3]分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。CR:可见病灶完全消失,维持1个月以上;PR:肿瘤最大直径及最大垂直直径的乘积缩小≥50%;SD:肿瘤最大直径及最大垂直直径的乘积缩小<50%,增大<25%;PD:患者出现1个或多个病灶的肿瘤最大直径及最大垂直直径的乘积增大≥25%。CR+PR为化疗有效,SD+PD为化疗无效。
1.5 统计学方法
采用SPSS 16.0统-计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 早期强化参数比较
有效患者共54例,无效患者28例。化疗结束后,有效组患者的首过强化率、首过强化速率、早期强化率、早期强化速率变化值均明显高于无效组,差异均有统计学意义(P<0.01)。(表1)
表1 不同疗效患者化疗前后早期强化参数变化值的比较(±s)
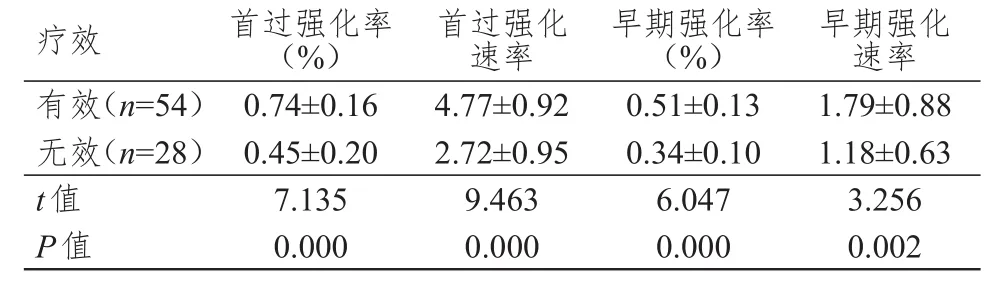
表1 不同疗效患者化疗前后早期强化参数变化值的比较(±s)
疗效有效(n=54)无效(n=28)t值P值首过强化率(%)0.74±0.16 0.45±0.20 7.135 0.000首过强化速率4.77±0.92 2.72±0.95 9.463 0.000早期强化率(%)0.51±0.13 0.34±0.10 6.047 0.000早期强化速率1.79±0.88 1.18±0.63 3.256 0.002
2.2 峰值强化参数比较
化疗结束后,有效组患者的最大强化率、最大强化速率、最大强化斜率、达峰时间变化值均明显高于无效组,差异均有统计学意义(P<0.01)。(表2)
表2 不同疗效患者化疗前后峰值强化参数变化值的比较(±s)
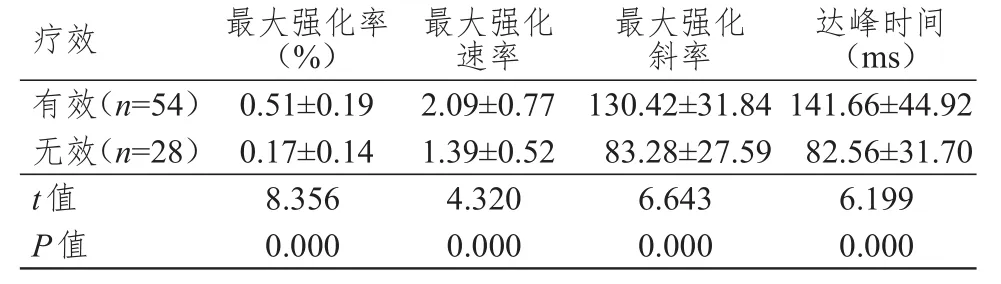
表2 不同疗效患者化疗前后峰值强化参数变化值的比较(±s)
疗效有效(n=54)无效(n=28)t值P值最大强化率(%)0.51±0.19 0.17±0.14 8.356 0.000最大强化速率2.09±0.77 1.39±0.52 4.320 0.000最大强化斜率130.42±31.84 83.28±27.59 6.643 0.000达峰时间(ms)141.66±44.92 82.56±31.70 6.199 0.000
2.3 ADC值、Ktrans、Ve、肿瘤直径比较
化疗结束后,有效组患者的ADC值、Ktrans、Ve、肿瘤直径变化值均明显高于无效组,差异均有统计学意义(P<0.01)。(表3)
表3 不同疗效患者治疗前后ADC值、Ktrans、Ve、肿瘤直径变化值的比较(±s)
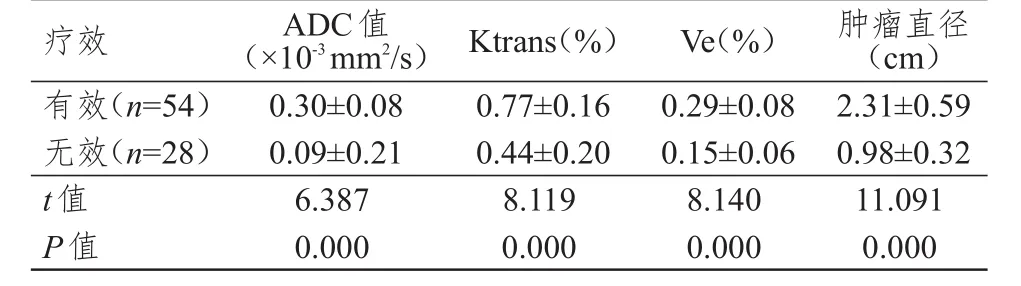
表3 不同疗效患者治疗前后ADC值、Ktrans、Ve、肿瘤直径变化值的比较(±s)
疗效有效(n=54)无效(n=28)t值P值ADC值(×10-3mm2/s)0.30±0.08 0.09±0.21 6.387 0.000 Ktrans(%)0.77±0.16 0.44±0.20 8.119 0.000 Ve(%)0.29±0.08 0.15±0.06 8.140 0.000肿瘤直径(cm)2.31±0.59 0.98±0.32 11.091 0.000
2.4 典型病例
某女性患者,病理学检查确诊为乳腺癌,在邯郸市中心医院接受NAC治疗,治疗后病灶明显减小,且化疗后患者的最大强化斜率明显减小。(图1)
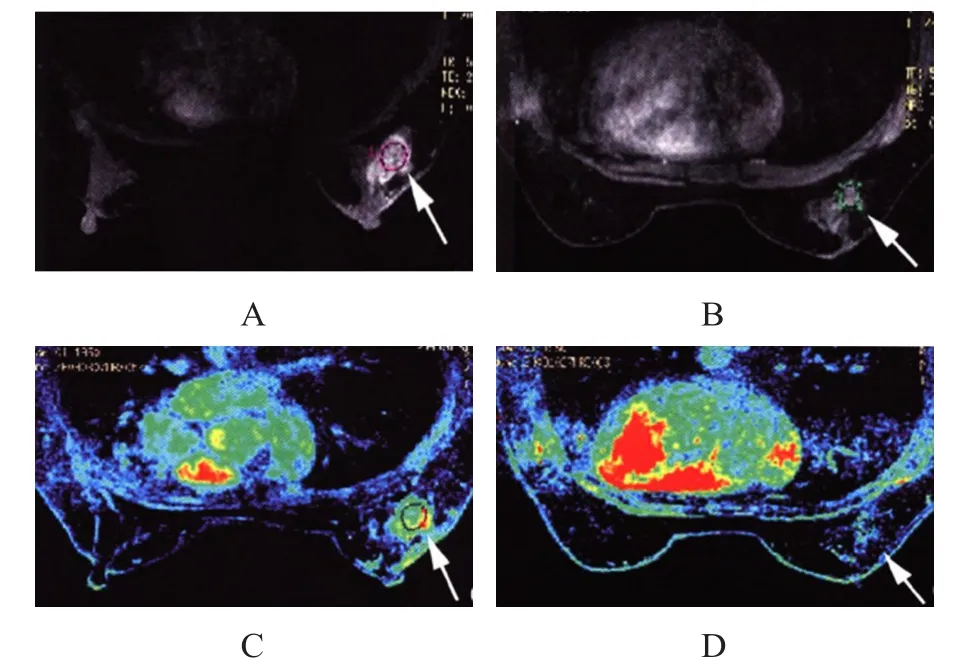
图1 乳腺癌患者NAC治疗前后DEⅠC-MR检查图像
3 讨论
乳腺癌是临床上高发的一种女性恶性肿瘤,由于其较高的病死率,严重影响患者的正常生活,近年来其发病率也呈逐年上升及年轻化的趋势,因此乳腺癌的治疗受到了临床的广泛关注。乳腺癌是一种全身性疾病,容易发生浸润转移和血行扩散,半数以上的乳腺癌患者早期就发生了微小转移,因此早期筛查和辅助治疗依然是治疗乳腺癌的关键。NAC是综合治疗乳腺癌的手段,是公认的治疗局部晚期乳腺癌的标准方法,有效率高达60%~90%。NAC可降低乳腺癌的级别,以方便手术或变不能手术为可手术治疗,并且可以提高保乳率;具有较好的远期效果,反映病灶对化疗的反应,指导临床治疗;可控制早期原发灶,还可以抑制微小转移灶,但仍有部分患者对NAC不敏感,甚至在治疗期间出现病情加重[11-12]。因此对NAC疗效进行早期而准确的预测和评估至关重要。目前预测评估NAC疗效传统的方法主要有超声和钼靶等,是公认的乳腺癌普查首选检测手段,但由于乳房是由高密度腺体构成,严重干扰以上方法对病灶区域的成像质量,肿瘤的残存病灶与病理的符合率均较低,而据相关研究报道磁共振的符合率高达97%[13]。DCE-MRⅠ对浸润性乳腺癌和微小病灶具有高敏感度,可同时进行双侧乳腺成像,判断乳腺囊性和实性肿物,并无辐射性[14-15]。采用序列成像时,可准确的对肿瘤进行定位,并可显示乳房的高位和深位肿块以及多中心多肿块的病灶;采用动态扫描可以明确血流灌注的变化情况,并且无致敏性,在对NAC疗效的评价方面,具有重大的临床价值[16]。
半定量血流早期强化参数包括首过强化率、首过强化速率、早期强率和早期强化速率,与肿瘤微血管密度和血管内皮生长因子具有明显的相关性。化疗结束后,有效组患者的首过强化率、首过强化速率、早期强化率、早期强化速率变化值均高于无效组,这表明有效组肿瘤内微血管密度下降明显,NAC有效抑制肿瘤微血管增生,也证明DCE-MRⅠ可以准确预测NAC对肿瘤微血管的抑制作用。峰值强化参数包括最大强化率、最大强化速率、最大强化斜率和达峰时间,其值与肿瘤微血管密度密切相关。化疗结束后,有效组患者的最大强化率、最大强化速率、最大强化斜率、达峰时间变化值明显高于无效组,这表明NAC有效抑制肿瘤微血管增生,证明DCE-MRⅠ可以准确预测NAC对乳腺癌组织处血管的抑制作用。
ADC值可表征水分子在体内的扩散量,治疗前后的差异可反映肿瘤内环境的变化,其值的升高可代表癌细胞的死亡,Ktrans和Ve反映局部血流量和血管通透性,因此本研究考察NAC对乳腺癌患者ADC值、Ktrans、Ve和肿瘤直径的影响,结果显示,化疗结束后,有效组患者的ADC值、Ktrans、Ve、肿瘤直径变化值均明显高于无效组,这表明NAC可以有效抑制肿瘤的转移,更明显降低血流量和血管通透性,促进癌细胞的死亡,从而缩小肿瘤体积,抑制肿瘤生长,证明DCE-MRⅠ可以准确地预测NAC的治疗效果。
通过分析接受NAC的某女性患者的DCE-MRⅠ图像,发现化疗后患者的可见病灶明显减小,最大强化斜率明显减小,说明NAC明显控制了肿瘤的生长与血管的增生,而DCE-MRⅠ图像清晰地显示了这一结果,准确评估了NAC的治疗效果。
综上所述,本研究采用DCE-MRⅠ对NAC治疗乳腺癌的治疗效果进行评价,证明DCE-MRⅠ可以准确预测NAC可以抑制乳腺癌细胞的增生,降低血流量和血管通透性,抑制肿瘤血管增生,从而控制肿瘤的生长。因此DCE-MRⅠ在临床评估NAC对乳腺癌的治疗效果中具有指导意义,可在临床进行推广应用。
[1]张保宁.国际乳腺癌筛查指南的争议引发的思考[J].癌症进展,2016,14(2):109-111.
[2]Anampa J,Makower D,Sparano JA.Progress in adjuvant chemotherapy for breast cancer:an overview[J].BMC Med,2015,13:195.
[3]胡庆龙,武彪,付莹,等.乳腺癌含靶向药物新辅助化疗疗效观察[J].中华内分泌外科杂志,2015,9(5):435-436.
[4]戴猛,李锐,刘贵庭,等.新辅助化疗后保留乳房手术治疗进展期乳腺癌可行性分析[J].实用肿瘤学杂志,2016,30(2):109-113.
[5]Bovy N,Blomme B,Frères P,et al.Endothelial exosomes contribute to the antitumor response during breast cancer neoadjuvant chemotherapy via microRNA transfer[J].Oncotarget,2015,6(12):10253-10266.
[6]Yang X,Feng X,Wang X.HER2 and PTEN as predictive markers for breast cancer neoadjuvant chemotherapy with anthracycline plus paclitaxel[J].J Biom Tissue Eng,2016,6(2):165-169.
[7]孟欣,任瑞美.动态增强磁共振与乳腺癌分子亚型血管生成的相关性研究[J].中华肿瘤防治杂志,2016,23(12):806-811;815.
[8]张涛涛.乳腺肿瘤血管生成与DCE-MRⅠ参数的相关性研究[J].国际医学放射学杂志,2016,39(2):142-145.
[9]Li L,Wang K,Sun X,et al.Parameters of dynamic contrastenhanced MRⅠas imaging markers for angiogenesis and proliferation in human breast cancer[J].Med Sci Monit,2015,21:376-382.
[10]Merz M,Seyler L,Bretschi M,et al.Diffusion-weighted imaging and dynamic contrast-enhanced MRⅠof experimental breast cancer bone metastases--a correlation study with histology[J].Eur J Radiol,2015,84(4):623-630.
[11]何慧君.新辅助化疗方案治疗三阴性乳腺癌的效果及生存观察[J].北方药学,2016,13(3):60-61.
[12]彭建珩,厉红元.新辅助化疗对乳腺癌肿瘤蛋白的影响[J].重庆医科大学学报,2015,40(5):747-753.
[13]韩敏,刘红,张晟,等.彩色超声与X线钼靶及核磁共振成像对乳腺癌诊断的价值[J].中国妇幼保健,2011,26(16):2543-2545.
[14]李富.磁共振成像在乳腺癌诊断及新辅助化疗中的应用[J].广西医科大学学报,2015,32(4):673-675.
[15]杨涛,刘雁冰,张朝蓬,等.MRⅠ对新辅助化疗后乳腺原发肿瘤退缩模式预测的准确度[J].中国癌症杂志,2016,26(2):168-176.
[16]付举众,范明,Zheng B,等.基于动态增强MRⅠ特征的乳腺癌新辅助化疗疗效预测研究[J].航天医学与医学工程,2016,29(1):39-44.
