EGFR19/21基因突变与NSCLC组织中 p53蛋白表达的关系及对预后的影响
2018-06-13陈焱宋小平
陈焱,宋小平
1北京新里程肿瘤医院外科,北京100081
2清华大学第一附属医院胸外科,北京100081
非小细胞肺癌(non-small cell lung cancer,NSCLC)的发病率维持在443/10万~567/10万,在合并吸烟或者其他高危因素的人群中,其发病率可进一步升高[1-2]。NSCLC患者的5年生存率或者中位生存时间等指标均较低[2],治疗后,其无进展生存期或者无瘤生存期等指标依然不太理想。个体化治疗在NSCLC的治疗过程中占据了重要的地位,在延长NSCLC患者生存时间、缓解NSCLC患者病情方面发挥重要的作用。基因突变能够影响NSCLC治疗的敏感性,导致个体化临床治疗结局出现差异。表皮生长因子受体(epidermal growth factor receptor,EGFR)的基因突变,能够影响EGRF下游信号通路的激活程度,抑制不同肿瘤信号蛋白的上调,抑制肿瘤细胞的增殖、分化等病理过程[3-4]。为了进一步揭示EGFR19/21基因突变与NSCLC的关系,本研究收集了98例NSCLC患者的NSCLC组织标本,旨在探讨EGFR19/21基因突变与NSCLC组织中p53蛋白表达的关系及其对患者预后的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2010年1月至2013年7月北京新里程肿瘤医院和清华大学第一附属医院的98例NSCLC患者的NSCLC组织标本。纳入标准:①NSCLC患者的诊断标准依据《中国原发性肺癌诊疗规范(2015年版)》的标准[1];②采用2010年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)最新分期(第7版)中的标准;③患者年龄<80岁;④所有患者均经病理学检查确诊为NSCLC;④未合并其他系统严重疾病者。排除标准:①患者于采集标本前已经实施过放、化疗;②患者合并其他部位的恶性肿瘤;③患者的各项临床、病理学资料缺失。98例NSCLC患者中,男67例,女31例;年龄41~79岁,平均(58.0±10.0)岁;肿瘤直径:>3 cm者41例,≤3 cm者57例;TNM分期:Ⅰ期25例,Ⅱ期40例,Ⅲ期28例,Ⅳ期5例;发生淋巴结转移者46例,未发生淋巴结转移者52例;分化程度:高分化25例,中分化30例,低分化43例;EGFR19/21基因检测结果:EGFR19/21突变患者44例,EGFR19/21野生型患者54例。
1.2 检测方法
免疫组织化学法检测p53蛋白的表达情况:石蜡切片脱蜡至水,采用离子水进行反复洗涤,加入牛奶液体封闭抗体,封闭时间为5 min,加入p53蛋白抗体(鼠来源,购自Abcam公司),37℃孵育2 h,采用磷酸盐缓冲液洗涤3次,滴加荧光染色标记的二抗抗体(购自Abcam公司),37℃孵育30 min,加入磷酸盐缓冲液进行洗涤,采用南京凯基生物制剂公司生产的显色剂进行显色,封片,镜下观察。采用Taqman-ARMS法检测肿瘤组织中EGFR19/21基因的突变情况。
Taqman-ARMS法检测基因突变:取冻存的血清保存液体,按照10 000 r/min的离心速度进行离心分离,离心时间为5 min,每1 ml的TRⅠZOL试剂裂解的样品中加入0.2 ml的氯仿,进行裂解操作,4℃冰上采用无酶的RNA冲洗液进行洗涤,再次10 000 r/min离心5 min,得到RNA。混合液在加入逆转录酶MMLV之前先70℃干浴3 min,取出后立即冰水浴至管内外温度一致,然后加逆转录酶0.5 μl,37 ℃水浴60 min,室温放置5 min使其完全溶解,使其逆转录为cDNA。以β-actin为模版,在反应体系中加入SYBR Green 1染料、上游引物、下游引物、dNTP,使得总体积达 20 μl,上机,反应条件:93℃ 2 min,93℃ 1 min,55℃ 2 min,共40个循环。PCR产物扩增后进行基因多态性检测:参考MultiplexKit试剂盒(南京凯基生物科技有限公司)使用说明书,加入各位点对应延伸引物进行单碱基测序反应。采用ABⅠ1310(购自美国Life Technologies公司)完成电泳,结果用Gene-Mapper软件(购自美国Life Technologies公司)进行分析。
1.3 评价指标
观察NSCLC患者p53蛋白的阳性表达情况,比较不同临床特征NSCLC患者EGFR19/21基因突变发生率的差异,比较EGRF突变组患者与野生型组患者生存情况的差异,分析NSCLC患者预后的影响因素。免疫组化结果判定:p53蛋白主要表达于细胞核,呈现黄色、棕黄色、褐色颗粒即为阳性表达。根据染色强度评分:若细胞无染色,则计0分;若细胞染色为淡黄色,则计1分;若细胞染色为棕黄色,则计2分;若细胞染色为褐色、黑色,则计3分。根据阳性细胞所占比例评分:阳性细胞数目占总细胞的10%及以下,则计1分;阳性细胞数目占总细胞的11%~50%,则计2分;阳性细胞数目占总细胞的51%~75%,则计3分;阳性细胞数目占总细胞的76%及以上,则计4分。每例患者的总分=染色强度评分×阳性细胞所占比例评分;分值范围为0~12分;总分<3分为阴性,≥3分为阳性。
1.4 统计学方法
采用SPSS 16.0软件对-数据进行统计分析。计量资料以均数±标准差(±s)表示;计数资料以率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,生存时间的比较采用Log-rank检验;多因素分析采用Cox比例风险回归分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 EGFR19/21基因突变与NSCLC患者 p53蛋白表达的关系
EGFR19/21基因突变组NSCLC患者p53蛋白的阳性表达率为38.64%,低于野生型组NSCLC患者的59.26%,差异有统计学意义(χ2=4.125,P<0.05)。(表1)

表1 EGFR19/21基因突变NSCLC患者 p53蛋白表达情况[ n(%)]
2.2 EGFR19/21基因突变与NSCLC患者临床特征的关系
不同年龄、性别、肿瘤直径、分化程度、TNM分期、淋巴结转移情况、病理类型、ECOG评分NSCLC患者EGFR19/21突变的发生率比较,差异均无统计学意义(P>0.05)。(表2)
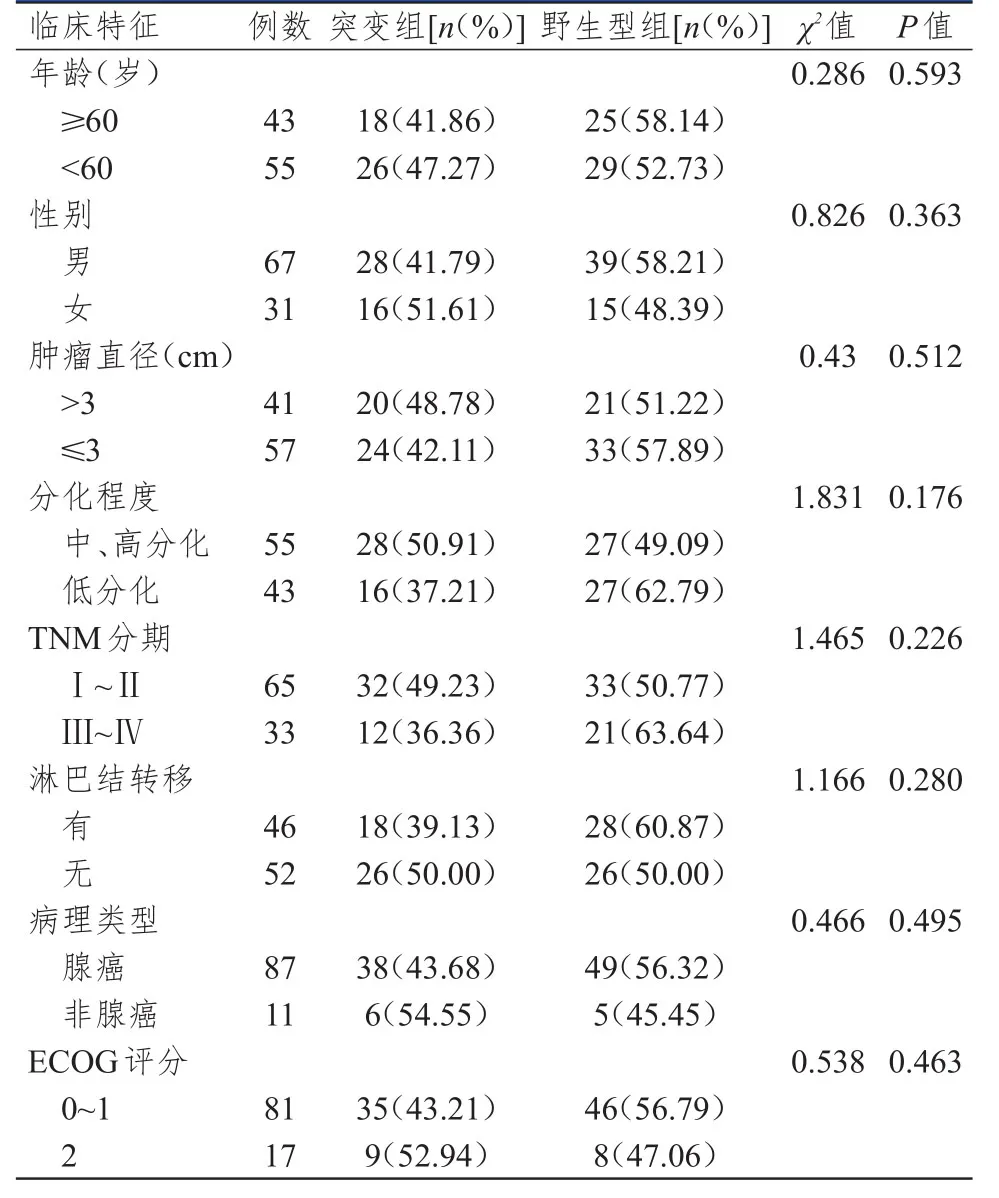
表2 EGFR19/21基因突变与NSCLC患者临床特征的关系
2.3 EGFR19/21基因突变与NSCLC患者生存率的关系
EGFR19/21突变组患者的3年累积生存率为55.80%,高于野生型组的 33.50%(χ2=4.339,P<0.05)。突变组和野生型组各有2例患者失访,突变组患者的生存时间为34.0个月(95%CⅠ:26.5~38.9),长于野生型组的 27.0个月(95%CⅠ:20.86~33.14)[Log Rank(Mantel-Cox)=5.9335,P<0.05]。(图1)
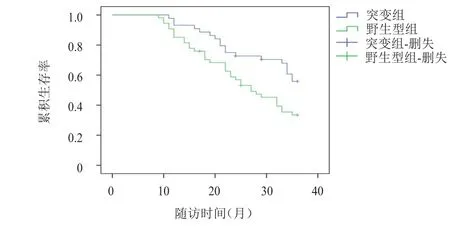
图1 两组患者的生存曲线
2.4 NSCLC患者预后影响因素的多因素分析
以NSCLC患者的3年累积生存率作为因变量,以NSCLC患者的年龄、性别、肿瘤直径、TNM分期、淋巴结转移情况、分化程度、病理类型、ECOG评分及p53蛋白表达作为自变量进行Cox回归分析,结果显示:TNM分期高、有淋巴结转移、分化程度为低分化、p53蛋白阳性表达是影响NSCLC患者预后的独立危险因素(P<0.05),EGFR19/21基因突变是影响NSCLC患者预后的保护因素(P<0.05)。(表3)
3 讨论
NSCLC的病情进展可以导致患者的生存预后的恶化,流行病学研究显示,NSCLC的临床总体治疗效果仍然较差,临床总体治疗敏感性不足35%[5-6]。揭示NSCLC患者治疗敏感性差异的原因,能够为后续临床上NSCLC的治疗、预后评估或者随访等提供参考依据。基因水平的改变可能是影响NSCLC临床治疗结局的重要因素,基因的改变能够通过对效应蛋白表达的影响干预肿瘤细胞的生物学特征[6]。EGFR19/21是重要的血管内皮生长因子受体家族成员,其对于配体的结合作用能够影响AKT或者Notch信号通路的激活,促进下游肿瘤细胞对于邻近正常组织的浸润,增加肿瘤细胞通过淋巴结或者血管内皮细胞进行转移的风险[7-8]。EGFR19/21基因突变的发生能够影响EGFR19/21对于配体结合的生物学效应,导致EGFR蛋白的空间结构的改变,影响其蛋白的生理功能[9]。部分研究认为,EGFR19/21基因突变导致的蛋白水平的变化,在抑制下游信号通路蛋白的激活方面均具有一定的作用[10],p53信号通路是重要的肿瘤细胞信号通路,其表达水平的改变能够在细胞周期的调控、细胞生物学特征的维持或者肿瘤细胞凋亡、调控过程中发挥作用,降低肿瘤细胞的程序性凋亡水平,促进肿瘤细胞的增殖,提高肿瘤细胞分化障碍的发生率。
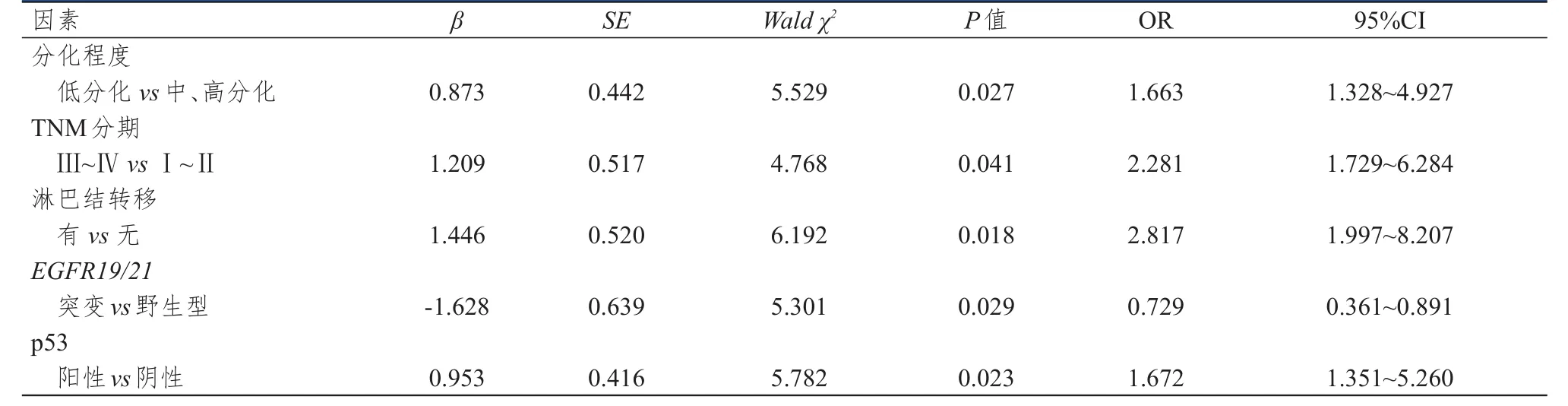
表3 影响NSCLC患者预后的多因素分析
本研究发现,EGFR19/21基因突变组患者p53蛋白的阳性表达率为38.64%,低于野生型组的59.26%,差异有统计学意义(P<0.05),提示基因突变组患者体内的肿瘤相关信号通路蛋白的表达浓度较低,p53蛋白的异常表达能够在下列几个方面影响肿瘤的发生:①EGFR19/21基因突变组患者体内突变的EGFR,能够导致配体结合障碍,促进血管内皮细胞的形成,导致肿瘤细胞血流灌注发生障碍,肿瘤细胞增殖相关信号通路p53蛋白的合成明显减少;②突变的EGFR能够导致患者p53基因转录调控启动子或者增强子的相对沉默,导致p53蛋白的翻译减少[11-12]。王沣等[13]、马玲等[14]通过探讨73例肺癌患者的基因突变水平发现,EGFR的突变程度对于体内不同信号通路蛋白,特别是p53或者P16等蛋白的表达具有重要的影响,EGFR的突变风险越高,抑癌基因蛋白的表达浓度越低。但本研究并未发现不同的临床特征对于EGFR19/21基因突变的影响,细胞分化程度、临床分期或者淋巴结转移等特征的差别,并不会影响到基因水平的改变,其内在并不具有直接的关联,这主要考虑基因水平的改变或者波动可能主要与患者肿瘤相关因子水平或者蛋白翻译转录调控过程中的变化有关。本研究发现,EGRF突变组NSCLC患者的3年累积生存率为55.80%,高于野生型组NSCLC患者的33.50%(χ2=4.339,P<0.05),提示EGRF突变组NSCLC患者的生存预后更好,生存率的改变可能与EGRF突变导致的NSCLC患者肿瘤细胞治疗敏感性的改变、治疗后肿瘤微环境的破坏或者肿瘤干细胞生物学活性的破坏等有关。Cox比例风险回归分析结果也显示,TNM分期高、有淋巴结转移、分化程度为低分化、p53蛋白阳性表达是影响NSCLC患者预后的独立危险因素(P<0.05),EGFR19/21基因突变是影响NSCLC患者预后的保护因素(P<0.05),进一步提示了EGRF突变对于NSCLC患者临床预后的影响。临床分期或者淋巴结转移情况等临床特征与患者生存预后的关系,主要考虑与其对于患者邻近正常组织的直接性浸润过程有关,而关于EGFR19/21基因突变或者p53蛋白的表达与患者生存预后的关系,则提示临床上可以通过针对性沉默相关指标,进而改善治疗结局。
综上所述,本研究的创新性在于探讨了EGFR19/21基因突变对于NSCLC患者生存预后的影响,揭示了EGFR19/21基因突变与NSCLC患者p53蛋白表达的内在关系。EGFR19/21基因突变NSCLC患者的p53蛋白呈高表达,其可能影响到多种生物学机制,进而参与到NSCLC的发病过程中。
[1]支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版)[J].中国肿瘤杂志,2015,37(1):67-78.
[2]Zhang K,Yuan Q.Current mechanism of acquired resistance to epidermal growth factor receptor-tyrosine kinase inhibitors and updated therapy strategies in human nonsmall cell lung cancer[J].J Cancer Res Ther,2016,12(Suppl):C131-C137.
[3]宋宣克,冯怡锟,苏彦河,等.表皮生长因子受体、糖类抗原125、糖类抗原199在非小细胞肺癌术后骨转移中的表达及意义[J].中华实验外科杂志,2016,33(5):1381-1383.
[4]王明芳,张文剑,许继映,等.表皮生长因子受体基因突变对非小细胞肺癌脑转移患者生存期的影响[J].基因组学与应用生物学,2017,36(7):2627-2632.
[5]Naidoo J,Sima CS,Rodriguez K,et al.Epidermal growth factor receptor exon 20 insertions in advanced lung adenocarcinomas:clinical outcomes and response to erlotinib[J].Cancer,2015,121(18):3212-3220.
[6]Sacher AG,Jänne PA,Oxnard GR.Management of acquired resistance to epidermal growth factor receptor kinase inhibitors in patients with advanced non-small cell lung cancer[J].Cancer,2014,120(15):2289-2298.
[7]徐程,陈天羽,李霄,等.表皮生长因子受体在同时性多原发肺癌诊断中的意义[J].中华病理学杂志,2017,46(5):332-333.
[8]陈伟文,郑锦阳,沈冰寒,等.泉州地区非小细胞肺癌人群中表皮生长因子受体基因突变分析[J].中国老年学,2016,36(20):5055-5056.
[9]胡余昌,黄燕华,王明伟,等.人非小细胞肺癌组织中检测表皮生长因子受体突变两种方法的比较[J].武汉大学学报(医学版),2014,35(4):541-545.
[10]Makinoshima H,Takita M,Matsumoto S,et al.Epidermal growth factor receptor(EGFR)signaling regulates global metabolic pathways in EGFR-mutated lung adenocarcinoma[J].J Biol chem,2014,289(30):20813-20823.
[11]李勇,李子明,陆舜.早期非小细胞肺癌表皮生长因子受体基因突变分布[J].上海交通大学学报(医学版),2014,34(4):511-514.
[12]Cortot AB,Jänne PA.Molecular mechanisms of resistance in epidermal growth factor receptor-mutant lung adenocarcinomas[J].Eur Respir Rev,2014,23(133):356-366.
[13]王沣,王继灵,操乐杰,等.晚期非小细胞肺癌患者表皮生长因子受体突变的检测[J].中国老年学,2015(3):657-659.
[14]马玲,张琰,单莉,等.维吾尔族晚期非小细胞肺癌患者EGFR、KRAS基因突变状态及其与TKⅠ靶向治疗效果的关系[J].山东医药,2016,56(31):66-68.
