癌蛋白LRP 6调节FGF 8信号对肺癌细胞增殖的影响研究
2018-06-13范文强姬宇宙刘先本
范文强,姬宇宙,刘先本
1焦作市第二人民医院心胸外科,河南 焦作454001
2河南省肿瘤医院胸部肿瘤一区,郑州450008
肺癌是恶性肿瘤相关死亡的主要危险因素,是全球主要的公共卫生负担之一,仅在中国,每年肺癌相关的发病和病死患者分别约为70万例和60万例[1-2]。目前,大多数肺癌患者就诊时已处于晚期阶段,5年生存率仅为15%,而早期肺癌患者的5年生存率为30%~40%,因此,早期诊断和有效治疗可明显延长肺癌患者的生存期[2]。在功能上,Wnt蛋白可参与肿瘤的发生和胚胎的发育,包括细胞命运和细胞结构[3-4]。低密度脂蛋白受体相关蛋白6(low density lipoprotein receptor related protein 6,LRP6)是LRP超家族成员之一,Wnt的共受体在Wnt信号转导过程中发挥着主要的作用[5-6]。LRP6蛋白可与Frizzled家族成员结合,导致Wnt信号通路被激活,进而导致β-catenin的稳定性和核易位增强,而LRP6的异常表达可影响Wnt配体与LRP和Frizzled家族成员结合,进而影响受体活化以及肿瘤的进展、恶化[2]。采用抑制剂阻断Wnt配体与LRP6中的Wnt结构域结合,可导致Wnt信号通路及其下游基因被抑制[7]。有研究发现,在小鸡和斑马鱼中,Wnt1的异常表达可通过Lmx1b、Pax2和En2途径调控FGF8的表达[8-9],而FGF8可促进结直肠癌细胞的增殖,提高细胞的克隆形成能力,促进肿瘤细胞的侵袭和迁移[10]。因此,在本研究中,猜测LRP6作为一种癌蛋白,其可能通过调节FGF8信号促进肺癌细胞的增殖。为了进一步揭示LRP6在肺癌发生、发展中的分子机制,首先利用Western blot法检测了其在肺癌细胞系中的表达;然后,通过在细胞中沉默LRP6表达检测其对细胞增殖和克隆形成能力的影响;最后,研究其是否通过FGF8信号来发挥癌基因的作用。本研究将阐明LRP6在肺癌发生、发展中的作用机制,为临床将LRP6与FGF8作为诊断、治疗肺癌的靶标奠定研究基础,现报道如下。
1 材料与方法
1.1 细胞
正常肺细胞CCD-19Lu和肺癌细胞A549、H1299、SPCA-1、L78、PCL3、H460均购自中国科学院上海细胞库。
1.2 试剂与仪器
胎牛血清(fetal bovine serum,FBS)、MEM培养基、RPMⅠ-1640培养基均购自美国Hyclone公司;siRNA(small interfering RNA,siRNA)-LRP6和siRNA-control由上海GenePharma公司合成;Lipofectamine 2000转染试剂、Trizol试剂均购自美国Ⅰnvitrogen公司;PrimeScript RT试剂盒和SYBR Premix Ex TaqⅡ试剂盒均购自大连Takara公司;7300实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)系统购自美国Applied Biosystems公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)购自美国Sigma公司;放射免疫沉淀法(radio immunoprecipitation assay,RⅠPA)裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒均购自上海碧云天生物技术有限公司;抗 LRP6(ab118490)、FGF8(ab89550)、β-actin(ab8245)均购自美国Abcam公司。
1.3 实验方法
1.3.1 细胞培养 正常肺细胞CCD-19Lu采用含10%FBS的MEM培养基培养,肺癌细胞A549、H1299、SPCA-1、L78、PCL3、H460采用含10%FBS的RPMⅠ-1640培养基培养。所有细胞均在含5%CO2的细胞培养箱中于37℃下培养。
1.3.2 细胞转染 通过检测发现,LRP6在肺癌细胞A549中的相对表达量最高,因此后续研究将A549作为研究对象。将siRNA-LRP6和siRNA-control按照Lipofectamine 2000转染试剂说明书转染至A549细胞中,分别记为siRNA-LRP6组和siRNA-control组。siRNA-LRP6序列:5'-CCG CAT GGT GAT TGA TGA A-3';siRNA-control序列:5'-UUC UCC GAA CGU GUC CGG A-3'。
1.3.3 qRT-PCR检测 采用Trizol试剂从培养的细胞中提取总RNA,并根据说明书使用Prime-Script RT试剂盒进行逆转录。使用SYBR Premix Ex TaqⅡ试剂盒在7300实时荧光定量PCR分析系统上进行qRT-PCR。LRP6 PCR扩增引物:上游5'-GAG CTG GAC TGT TAT CCA ACT G-3'和下游5'-CTT CAT ACG AGG ACA CAG CAT C-3';β-actin引物:上游5'-CAC GAT GGA GGG GCC GGA CTC ATC-3'和下游5'-TAA AGA CCT CTA TGC CAA CAC AGT-3'。实验至少重复3次。以LRP6/β-actin计算LRP6的相对表达量。
1.3.4 细胞增殖能力检测 MTT实验和克隆形成实验按照先前研究报道的方案进行[11]。将siRNA-LRP6或siRNA-control转染至A549细胞中,于24、48、72 h时分别加入MTT进行测定,在波长490 nm处采用酶标仪测定各组光密度(optical density,OD)值。克隆形成测定按照以下步骤进行:转染48 h后,取500个A549细胞接种于6孔板中,培养10~14 d后,采用结晶紫染色,计数斑点。实验至少重复3次。
1.3.5 蛋白质印迹法(Western blot)检测 按照先前报道所述的方法进行Western blot检测[13],收集细胞,RⅠPA裂解液裂解,离心取上清,BCA法测定蛋白含量,10%SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白并转膜,将膜与抗体(LRP6、FGF8、β-actin)进行室温孵育2 h,最后曝光显影。实验至少重复3次。
1.4 统计学方法
采用SPSS 22.0软件对-数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 LRP 6在肺癌细胞系中的表达情况
LRP6在肺癌细胞L78、A549、H1299、SPCA-1、PCL3和H460中的表达水平均明显高于LRP6在正常肺细胞CCD-19Lu中的表达水平,差异均有统计学意义(P<0.01)。(表1)
表1 LRP 6蛋白在肺癌细胞系中的相对表达量(±s)
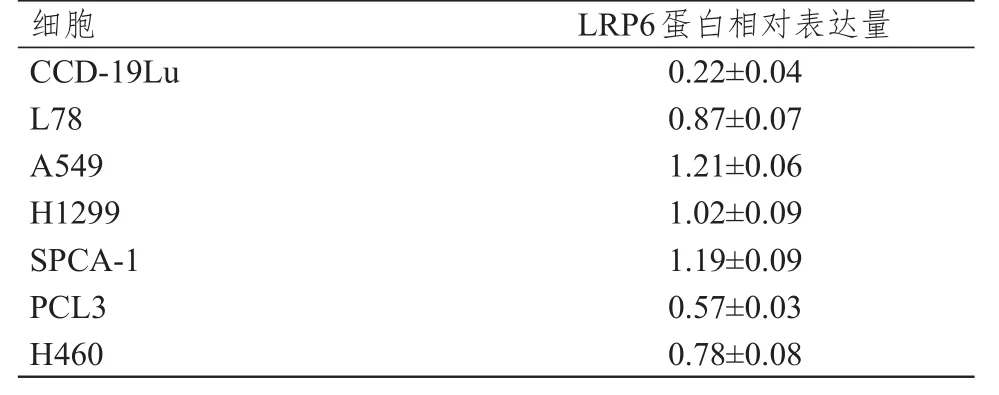
表1 LRP 6蛋白在肺癌细胞系中的相对表达量(±s)
细胞CCD-19Lu L78 A549 H1299 SPCA-1 PCL3 H460 LRP6蛋白相对表达量0.22±0.04 0.87±0.07 1.21±0.06 1.02±0.09 1.19±0.09 0.57±0.03 0.78±0.08
2.2 siRNA沉默LRP 6表达
转染siRNA-LRP6后,A549细胞中LRP6mRNA和LRP6蛋白的相对表达量分别为(0.22±0.04)和(0.14±0.01),均明显低于siRNA-control组的(0.94±0.07)和(0.39±0.03),差异均有统计学意义(t=15.468、13.693,P<0.01)。(图1)
2.3 沉默LRP 6对细胞增殖的影响
转染siRNA-LRP6后,细胞在 24、48、72 h的OD值均低于siRNA-control组,差异均有统计学意义(P<0.05)。(表2)
表2 沉默LRP 6后不同时间点 A549细胞OD值的比较( n= 3,±s)
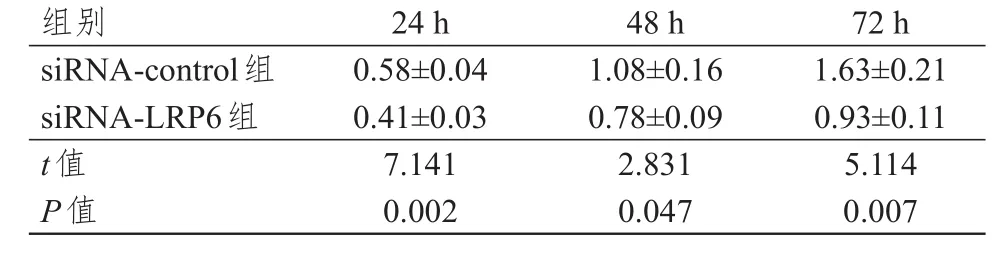
表2 沉默LRP 6后不同时间点 A549细胞OD值的比较( n= 3,±s)
组别siRNA-control组siRNA-LRP6组t值P值24 h 0.58±0.04 0.41±0.03 7.141 0.002 48 h 1.08±0.16 0.78±0.09 2.831 0.047 72 h 1.63±0.21 0.93±0.11 5.114 0.007
2.4 沉默LRP 6对细胞克隆形成能力的影响
结晶紫染色后发现,siRNA-LRP6组细胞的克隆形成数目为(56±13)个,低于siRNA-control组的(119±24)个,差异有统计学意义(t=3.998,P=0.016)。
2.5 沉默LRP 6对FGF 8信号的影响
Western blot法检测结果显示,siRNA-LRP6组A549细胞中FGF8及增殖相关蛋白Cyclin D1、LRP6的表达水平均明显低于siRNA-control组,差异均有统计学意义(P<0.01)。(表3)
表3 A549细胞中FGF 8、Cyclin D 1及LRP 6蛋白相对表达量的比较( n= 3,±s)
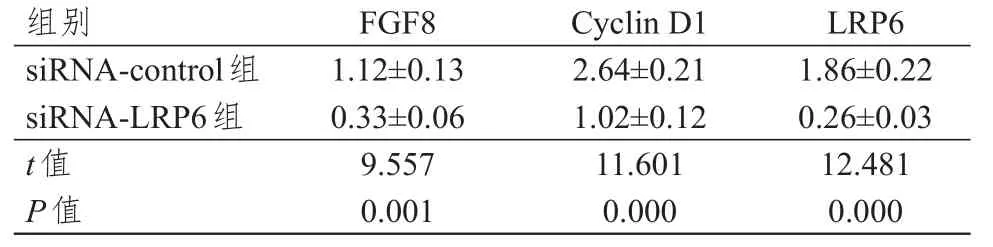
表3 A549细胞中FGF 8、Cyclin D 1及LRP 6蛋白相对表达量的比较( n= 3,±s)
组别siRNA-control组siRNA-LRP6组t值P值FGF8 1.12±0.13 0.33±0.06 9.557 0.001 Cyclin D1 2.64±0.21 1.02±0.12 11.601 0.000 LRP6 1.86±0.22 0.26±0.03 12.481 0.000
3 讨论
肺癌是世界上发病率及病死率最高的恶性肿瘤之一,主要包括两种类型,分别是小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)[12]。SCLC占所有肺癌的15%~20%,其更具侵略性,通常在早期已经发生转移[13];而NSCLC占所有肺癌的80%~85%,并可进一步分为腺癌、鳞状细胞癌、大细胞癌和各种混合型癌,大多数NSCLC患者被诊断时已经处于晚期,仅有约11个月的中位生存期[14-15]。
越来越多的证据表明,Wnt途径是维持肺动态平衡的主要信号途径之一,其异常激活可能与多种衰弱性肺疾病有关[12]。类似于其他恶性肿瘤,Wnt信号在肺癌的发生中发挥着重要的作用。以往研究表明,LRP6参与了肿瘤细胞的调控,在口腔癌中,LRP6是一个潜在的预测靶标[10]。此外,LRP6也可通过改变β-catenin亚细胞的分布来促进人纤维肉瘤HT1080细胞的增殖[16]。有研究已证实,LRP6是Wnt/β-catenin信号通路的重要共激活因子,LRP6可与Wnt配体结合,进而促进Wnt/β-catenin信号转导[17-18],其机制是LRP6可募集axin至细胞膜上,进而增加β-catenin的稳定性,并促进其核易位,通过与LEF-1/TCF转录因子作用,从而促进Wnt/β-catenin通路下游基因转录[19]。有研究显示,临床样本中,FGF8高表达与肿瘤的进展有关,并预示着某些恶性肿瘤(包括前列腺癌和乳腺癌)预后较差[12]。LRP6是Wnt/β-catenin通路的重要共激活因子,而Wnt/β-catenin 通路又可调节 FGF8的表达[10],猜测在肺癌中,LRP6也可能通过FGF8信号促进肿瘤的发生、发展。
在口腔癌细胞中,LRP6是Wnt/β-catenin通路的重要共激活因子,而Wnt/β-catenin通路也可调控FGF8的表达,FGF8是Wnt通路的下游基因[10]。研究发现,FGF8在正常成人组织中表达较低,但在胚胎发育期间及包括乳腺癌、卵巢癌、前列腺癌在内的几种激素恶性肿瘤中广泛表达,FGF8可在胚胎发育过程中介导胚胎上皮细胞向间质细胞方向转化,进而参与原肠胚形成、早期分化和脑、四肢和肾脏的形成[20-21]。在细胞培养和转基因动物模型中,FGF8能够促进乳腺癌、前列腺癌和卵巢癌肿瘤的发生,其可通过自分泌和旁分泌循环促进肿瘤的生长和血管的生成,赋予多种肿瘤细胞恶性表型[22]。FGF-8可以增强体外前列腺癌细胞的侵袭和迁移能力,并促进体内骨转移[23];在小鼠乳腺肿瘤细胞中,过表达FGF8可诱导细胞上皮间质转化(epithelial interstitial transformation,EMT)和贴壁自主生长,并加速体内肿瘤的生长[24]。然而,FGF8在肺癌中的作用机制仍未完全阐明,猜测在肺癌中,LRP6也可能通过FGF8信号发挥促进肿瘤发生、发展的作用。
本研究发现,LRP6在正常肺细胞CCD-19Lu中呈低表达,而在肺癌细胞株中普遍呈高表达;且沉默LRP6可明显抑制肿瘤细胞的增殖和克隆形成能力,作用机制可能与FGF8信号及其下游增殖相关蛋白的表达有关。本研究首次报道了LRP6通过调节FGF8信号对肺癌细胞增殖的影响,LRP6可能是诊断治疗肺癌的潜在分子靶标。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CACancer J Clin,2011,61(2):69-90.
[2]Deng D,Zhang Y,Bao W,et al.Low-density lipoprotein receptor-related protein 6(lrp6)rs10845498 polymorphism is associated with a decreased risk of non-small cell lung cancer[J].Ⅰnt J Med Sci,2014,11(7):685.
[3]Pacheco-Pinedo EC,Durham AC,Stewart KM,et al.Wnt/β-catenin signaling accelerates mouse lung tumorigenesis by imposing an embryonic distal progenitor phenotype on lung epithelium[J].J ClinⅠnvest,2011,121(5):1935-1945.
[4]左慧敏,曾林祥.Wnt信号通路与非小细胞肺癌的研究进展[J].基础医学与临床,2015,35(2):266-269.
[5]Macdonald BT,Tamai K,He X.Wnt/beta-catenin signaling:components,mechanisms,and diseases[J].Dev Cell,2009,17(1):9-26.
[6]林翠鸿,柯蒙,黄品芳,等.LRP6受体胞内区赖氨酸位点突变和经典Wnt信号通路相关性分析[J].中国医院药学杂志,2015,35(16):1461-1464.
[7]Lee JS,Hur MW,Lee SK,et al.A novel slrp6e1e2 inhibits canonical wnt signaling,epithelial-to-mesenchymal transition,and induces mitochondria-dependent apoptosis in lung cancer[J].PLoS One,2012,7(5):e36520.
[8]Matsunaga E,Katahira T,Nakamura H.Role of Lmx1b and Wnt1 in mesencephalon and metencephalon development[J].Development,2002,129(22):5269-5277.
[9]Canning CA,Lee L,Ⅰrving C,et al.Sustained interactive Wnt and FGF signaling is required to maintain isthmic identity[J].Dev Bio,2007,305(1):276-286.
[10]Yuan Y,Xie X,Jiang Y,et al.LRP6 is identified as a potential prognostic marker for oral squamous cell carcinoma via MALDⅠ-ⅠMS[J].Cell Death Dis,2017,8(9):e3035.
[11]Yao Y,Hou X,Hui F,et al.Proteomic identification of cyclophilin A as a potential biomarker and therapeutic target in oral submucous fibrosis[J].Oncotarget,2016,7(37):60348-60365.
[12]Rapp J,Jaromi L,Kvell K,et al.WNT signaling-lung cancer is no exception[J].Respir Res,2017,18(1):167.
[13]Molina JR,Yang P,Cassivi SD,et al.Non-small cell lung cancer:epidemiology,risk factors,treatment,and survivorship[J].Mayo Clin Proc,2008,83(5):584-594.
[14]D’Addario G,Früh M,Reck M,et al.Metastatic nonsmall-cell lung cancer:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2010,21 Suppl 5:v116.
[15]刘新,沈世林,王玉萍,等.中晚期非小细胞肺癌的综合介入治疗现状[J].中华肺部疾病杂志(电子版),2017,10(4):486-489.
[16]Li Y,Lu W,He X,et al.LRP6 expression promotes cancer cell proliferation and tumorigenesis by altering betacatenin subcellular distribution[J].Oncogene,2004,23(56):9129-9135.
[17]Bryja V,Andersson ER,Schambony A,et al.The extracellular domain of Lrp5/6 inhibits noncanonical Wnt signaling in vivo[J].Mol Biol Cell,2009,20(3):924-936.
[18]Lu W,Liu CC,Thottassery JV,et al.Mesd is a universal inhibitor of Wnt coreceptors LRP5 and LRP6 and blocks Wnt/beta-catenin signaling in cancer cells[J].Biochemistry,2010,49(22):4635-4643.
[19]He X,Semenov M,Tamai K,et al.LDL receptor-related proteins 5 and 6 in Wnt/beta-catenin signaling:arrows point the way[J].Dev,2004,131(8):1663.
[20]Mattila MM,Härkönen PL.Role of fibroblast growth factor 8 in growth and progression of hormonal cancer[J].Cytokine Growth Factor Rev,2007,18(3-4):257-266.
[21]刘皓,姜建萍,张娟娟,等.FGF8辅助牙源性上皮诱导hDPSCs分化为成牙本质细胞及牙髓细胞[J].中国病理生理杂志,2017,33(4):730-734.
[22]Tuomela J,Grönroos TJ,Valta MP,et al.Fast growth associated with aberrant vasculature and hypoxia in fibroblast growth factor 8b(FGF8b)over-expressing PC-3 prostate tumour xenografts[J].BMC Cancer,2010,10:596.
[23]Valta MP,Tuomela J,Bjartell A,et al.FGF-8 is involved in bone metastasis of prostate cancer[J].Ⅰnt J Cancer,2008,123(1):22-31.
[24]Song Z,Powell WC,Kasahara N,et al.The effect of fibroblast growth factor 8,isoform b,on the biology of prostate carcinoma cells and their interaction with stromal cells[J].Cancer Res,2000,60(23):6730-6736.
