2种枸杞叶片对混合盐胁迫的生理响应
2018-06-12张雯莉刘玉冰刘立超
张雯莉,刘玉冰,刘立超
(1 中国科学院西北生态环境资源研究院, 沙坡头沙漠试验研究站, 兰州, 730000; 2 中国科学院大学, 北京 100049)
盐碱土是陆地上分布广泛的土壤类型,在中国主要分布于西北、华北和滨海地区,并有逐年扩展的趋势。盐碱土壤中Na+、Cl-、SO42-和Ca2+等离子含量较高,成分复杂且程度各异,具有地域分异性[1-2]。不同的植物耐盐性不同,大部分植物在含盐量达0.25%~0.3%条件下受害,在高于0.5%时则不能生存。据报道,盐胁迫对苍耳和沙枣的生长和光合有显著抑制作用[3-4];盐胁迫下弗吉尼亚栎能够扩大根系吸收范围,维持较高的K+/Na+比值,而麻栎通过限制根系在逆境中的生长范围从而避免盐害[5];燕麦在盐胁迫下可以通过调节渗透物质、提高抗氧化物酶活性来抵御盐胁迫[6];外源水杨酸能调控棉花幼苗的渗透调节和抗氧化能力缓解质膜损伤提高耐盐能力[7]。可见,盐胁迫涉及的植物物种广泛,且不同植物甚至同一种类不同品种间,对盐胁迫的反应及适应机制也不尽相同。然而,截止目前为止,多数关于盐胁迫的研究主要集中于NaCl胁迫下植物的耐盐性以及Na+和Cl-对植物的毒害作用,事实上中国广大的西北和华北内陆盐碱地以硫酸盐和氯化盐组成的混合物居多,且比单一中性盐NaCl造成的胁迫更严重。
枸杞(LyciumbarbarumL.)是西北地区原生植物资源和传统中药材之一,也是防风固沙和改良盐碱地的先锋树种,具备生态、经济、社会三位一体的显著效益,而宁夏枸杞和黑果枸杞在宁夏等西北地区大规模种植,形成了农业特色优势产业,是农民经济收入的主要来源之一[8-9]。近年来,2种枸杞在单一盐胁迫下(如NaCl、Na2CO4等)的生理活性响应已有较多的研究,包括种子萌发、形态特征、光合生理、水分与渗透调节、抗氧化防御、盐碱土改良等多方面[10-12],并发现黑果枸杞具有更强的耐盐性[13-14]。但是,在NaCl和Na2SO4混合盐胁迫下不同品种枸杞生理活性变化的对比研究却鲜有报道,这与Na2SO4这一盐类型已经成为全球盐碱地,尤其是中国内陆盐碱地上继NaCl之后的第二大盐胁迫类型的现状极不相称[15]。因此,本试验选择NaCl和Na2SO4混合盐溶液处理‘宁杞5号’和‘黑杞1号’一年实生苗,对比研究不同盐渍化程度的混合盐胁迫处理期间2种枸杞生理活性的响应特征,旨在阐明2种枸杞适应盐胁迫的生理基础,为枸杞优势产业的持续稳定发展提供理论支撑。
1 材料和方法
1.1 材料培养与处理
枸杞材料选自宁夏中宁县枸杞培育基地的一年生‘宁杞5号’和‘黑杞1号’实生苗。将生长良好、无病虫害、长势均一的实生苗移栽至装有蛭石和珍珠岩混合基质(4∶1,V/V)体积约为8.0 L的塑料盆中,每盆植入4株试验苗,带回实验室培养间,用1/8 MS营养液(pH 6.7~7.5)培养适应2个月,再进行盐处理试验。实验室培养条件如下:昼/夜温度为25/20 ℃,相对湿度为60%,昼/夜光周期16/8 h,光强为350 mol·m-2·s-1。
适应培养结束后,选取长势较好的材料进行不同渗透势盐胁迫处理实验。在1/8 MS营养液中分别加入不同渗透势的NaCl+Na2SO4混合盐溶液(不同渗透势梯度的混合盐溶液配制见表1)处理材料,以不加盐的营养液(Ψ0= -0.05 MPa)培养的材料为对照(CK)。处理过程如表1所示,先用低浓度盐溶液培养适应,逐步添加高浓度盐溶液,1周后材料的培养液达到各自需要处理的盐溶液渗透势。选择的处理组最终盐溶液渗透势分别为-0.47(T1)、-0.82(T2)和-1.18 MPa (T3),达到该预定渗透势后,开始计时。分别在处理7 d、14 d和21 d后取枸杞叶片,用于测定生理活性指标。处理期间每隔2 d更换盐溶液培养材料。
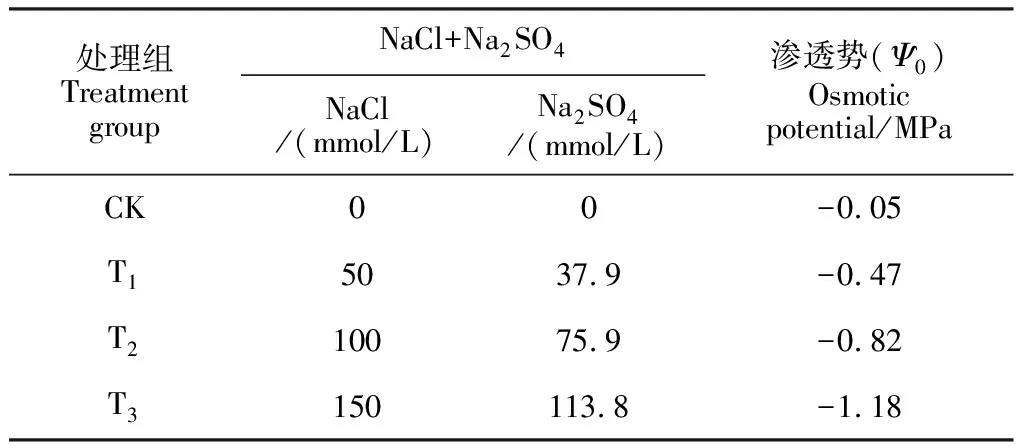
表1 各混合盐溶液处理组盐分组成和含量及渗透势梯度
1.2 生理生化指标测定
称取一定量的叶片样品进行各项生理指标的测定。其中,叶绿素(Chl)含量用丙酮提取法测定[16];细胞质膜透性采用DDS-11A型电导率仪测定,以相对电导率表示细胞膜相对透性[17];膜脂过氧化产物丙二醛(MDA)含量的测定采用硫代巴比妥酸法[17];超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性分别采用氮蓝四唑染色法、愈创木酚染色法和紫外吸收法测定[18];脯氨酸(Pro)采用酸性茚三酮法测定[18],可溶性糖(SS)采用蒽酮比色法测定[18],可溶性蛋白(SP)采用考马斯亮蓝G-250比色法测定[18]。
1.3 数据处理
采用Microsoft Excel 2013对数据进行整理,并用Origin 8.0进行绘图,SPSS 20.0统计软件对数据进行单因素方差分析(One-Way ANOVA)和Duncan差异显著性多重比较分析。
2 结果与分析
2.1 混合盐胁迫对枸杞叶片叶绿素含量的影响
如图1所示,随着混合盐溶液渗透势的降低(盐胁迫程度加剧),各处理时期‘宁杞5号’和‘黑杞1号’叶片中叶绿素含量(Chl)均呈先升后降的变化趋势,最大值多出现在T1处理(渗透势为-0.47 MPa),最小值均出现在T3处理(渗透势为-1.18 MPa),且盐胁迫处理间均差异显著(P<0.05);品种间相比较,‘宁杞5号’ 叶片中叶绿素含量在相同渗透胁迫处理条件下始终不同程度地高于相应 ‘黑杞1号’,且在低渗透胁迫下表现得更明显,同时‘宁杞5号’的变化幅度更大。其中,‘宁杞5号’枸杞叶绿素含量在 T3处理第7、14、21天时分别较同期对照减少46.49%、43.97%、38.7%,‘黑杞1号’则分别减少20.01%、14.8%、16.62%。可见,适当程度的混合盐胁迫能提高枸杞叶片叶绿素含量,胁迫过重则会明显抑制叶绿素合成,且‘宁杞5号’对盐胁迫的敏感性高于‘黑杞1号’。
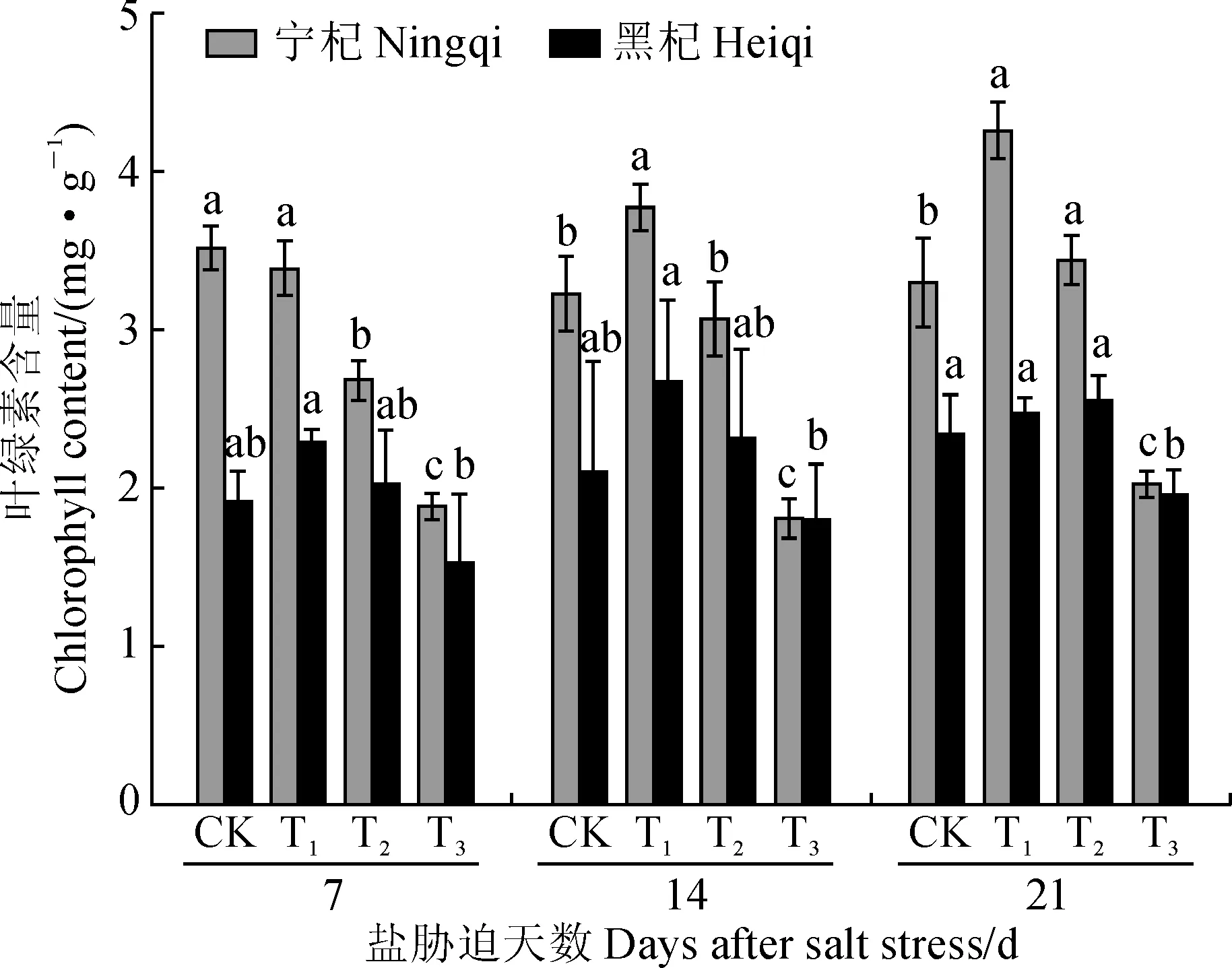
同期同一品种内不同小写字母表示盐处理间在0.05水平存在显著性差异(P<0.05)图1 不同渗透势混合盐溶液处理期间枸杞叶绿素含量的变化Different lowercase letters within a cultivar show significant difference among salt treatments at 0.05 level(P<0.05), the same as belowFig.1 Variations of chlorophyll content in leaves of L. barbarum treated by mix salt solution with different osmotic potentials
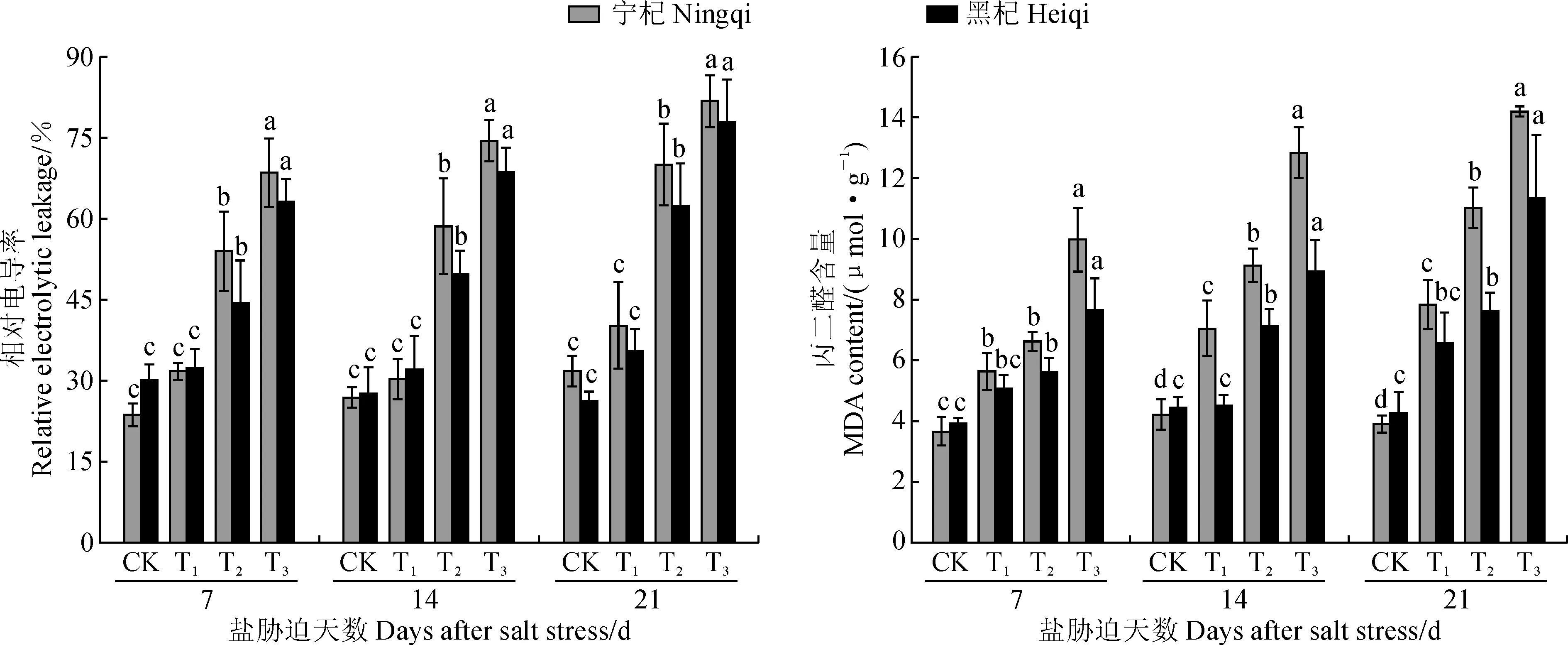
图2 不同渗透势的混合盐溶液处理期间枸杞质膜透性和丙二醛含量的变化Fig.2 Variations of membrance permeability and MDA content in leaves of L. barbarum treated by mix salt solution with different osmotic potentials
2.2 混合盐胁迫对枸杞叶片质膜透性和丙二醛含量的影响
随着混合盐溶液渗透势的降低和处理时间的延长,‘宁杞5号’和‘黑杞1号’叶片相对电导率和MDA含量均呈逐渐增加的趋势,并以‘宁杞5号’的数值更高、增加幅度更大,且胁迫程度越重表现越明显(图2)。其中,2种枸杞叶片相对电导率在T1处理下比对照稍有增加,在T2和T3处理下均比对照显著增加(P<0.05),‘宁杞5号’和‘黑杞1号’ 相对电导率在T3胁迫处理21 d后分别比对照显著提高167.29%和196.51%;2种枸杞叶片MDA含量在各处理胁迫第7天时上升幅度较小,而在T3胁迫处理21 d后分别比同期对照显著增加264.73%和166.59%,且此时‘宁杞5号’ MDA含量在T2和T3处理下分别比‘黑杞1号’高44.34%和25.14%。可见,‘宁杞5号’质膜系统受混合盐胁迫伤害程度要大于‘黑杞1号’,且胁迫程度越重这种趋势越明显。
2.3 混合盐胁迫对枸杞叶片渗透调节物质含量的影响

图3 不同渗透势的混合盐溶液处理期间枸杞叶片渗透调节物含量的变化Fig.3 Variations of osmotic regulation substance contents in leaves of L. barbarum treated by mix salt solution with different osmotic potentials
随着混合盐胁迫程度的加剧和处理时间的延长,‘宁杞5号’和‘黑杞1号’叶片中脯氨酸(Pro)和可溶性糖(SS)含量均逐渐增加(图3),且各胁迫处理组大多均显著高于对照组(P<0.05),盐胁迫程度越高,其含量上升幅度越大。其中,Pro是氨基酸中最有效的渗节调剂物质,‘宁杞5号’叶片Pro含量在T1、T2和T3胁迫处理第21天时分别较同期对照显著增加132.53%、303.5%、255.96%(P<0.05),此时‘黑杞1号’则分别较对照显著增加80.09%、254.49%、398.99%;混合盐胁迫处理21 d后,‘宁杞5号’T2处理和‘黑杞1号’ T3处理叶片的Pro含量均达到最高值。同时,植物积累高浓度的可溶性糖(SS)可以起到调节渗透压的作用,T3处理的‘宁杞5号’和‘黑杞1号’叶片SS含量分别在混合盐胁迫14 d和21 d后达到最高值,分别较同期对照显著大幅度增加336.17%和232.33%,‘宁杞5号’的增幅明显要大于‘黑杞1号’。在相同混合盐胁迫条件下,‘宁杞5号’叶片中积累的Pro和SS含量均要高于相应‘黑杞1号’。另外,随着混合盐胁迫程度的增加,2种枸杞叶片的可溶性蛋白(SP)含量均呈先升后降的变化趋势;‘宁杞5号’ 的SP含量在胁迫第7和21天时的T2处理和胁迫第14天时的T3处理下达到最大值,‘黑杞1号’ 的SP含量各时期均在T2处理下达到峰值,其在处理14 d后达到最高值。在相同渗透胁迫条件下,‘黑杞1号’叶片中积累的SP含量大多低于相应‘宁杞5号’。可见,在混合盐溶液胁迫下枸杞能有效积累Pro、SS和SP来调节细胞渗透压,缓解盐害, 同时SP在盐胁迫下随着时间和渗透势的变化出现了缓冲效应。
2.4 混合盐胁迫对枸杞叶片抗氧化系统酶活性的影响

图4 不同渗透势的混合盐溶液处理期间枸杞叶片SOD、POD和CAT活性的变化Fig.4 Variations of SOD, POD and CAT activities in leaves of L. barbarum treated by mix salt solution with different osmotic potentials
如图4,A所示,随着混合盐溶液渗透势的降低(盐胁迫程度的加剧),‘宁杞5号’叶片SOD活性在各时期均呈先升后降的变化趋势,并均在T2处理时出现峰值,各浓度处理之间差异性均达到显著水平(P<0.05),且均高于相应对照组;‘黑杞1号’叶片SOD活性在处理第7和21 天时均随着盐胁迫程度的加剧而逐渐升高,而其在处理第14天时呈先升后降的趋势,此时在T2处理下出现峰值,比相应‘宁杞5号’高20.35%。在T3盐胁迫处理第7、14和21天,‘黑杞1号’叶片中的SOD活性分别比‘宁杞5号’高出28.86%、15.07%、40.90%。
图4,B、C显示,随着混合盐溶液渗透势的降低,‘宁杞5号’叶片POD和CAT活性均呈先升后降的变化趋势;各时期POD活性均在T1盐胁迫处理下达到峰值,均在T3盐胁迫处理下降至最低值,第7、14和21天最低值比相应对照组分别减少60.01%、46.19%和44.68%;各时期CAT活性均在T2盐胁迫处理下达到峰值,此时分别比同期对照增加177.5%、234.04%、215.56%,并在处理14 d后酶活性最高。同时,‘黑杞1号’叶片POD和CAT酶活性在混合盐胁迫第7和14天时均随着渗透势的降低而逐渐升高,而在混合盐胁迫第21天时却先升高后降低,并均在T2盐胁迫处理下达到峰值;各混合盐胁迫处理的POD和CAT活性均不同程度高于对照组,且各时期T2和T3盐胁迫处理升幅均达到显著水平(P<0.05);胁迫第7、14、21天的POD活性最大值分别比对照显著增加219.23%、254.55%、186.21%,相应的CAT活性最大值分别比对照显著增加226.19%、167.16%、185.71%。
3 讨 论
不同的植物耐盐性不同,多数植物不能在含盐量高的土壤中生长,若长时间处在高盐环境中,植物生理代谢会出现紊乱,离子毒害和活性氧的伤害严重影响植物的生长发育,甚至导致死亡[19]。为了适应高盐环境,植物的外部形态和内部生理生化特性都发生了一系列变化,如渗透调节物质的积累和保护酶系统(SOD、POD、CAT)的激活等。
首先,Chl含量是反映植物光合作用强弱的生理指标[20]。在本研究中,盐生植物枸杞叶片的叶绿素含量在-0.47 MPa混合盐溶液胁迫下得到促进提高,而在-1.18 MPa混合盐溶液胁迫下则受到抑制降低,同时 ‘宁杞5号’的降幅要大于‘黑杞1号’。这说明2种枸杞开始受到盐胁迫时,植株自身均可通过促进Chl的合成来增强叶片的光合作用以适应盐胁迫环境,但随着胁迫程度的加剧,过量的盐分进入植物体,叶绿体遭到破环,加速了叶绿素的分解。可见,盐胁迫对‘宁杞5号’的影响要大于‘黑杞1号’。
其次,植物受到逆境胁迫时,体内抗氧化酶保护系统功能降低,活性氧(ROS)的产生和清除失衡,质膜发生一系列协变,形成膜质过氧化产物MDA,致使质膜受损、透性增加、胞内渗透水溶性物质外渗,作物表现出盐害特征[21-22]。本试验结果表明,-0.47 MPa混合盐溶液胁迫处理下‘宁杞5号’和‘黑杞1号’叶片相对电导率和MDA含量仅较对照稍有增加,说明在此胁迫环境下由于保护酶活性的增强,有效地清除了活性氧,防止膜脂过氧化;但随着盐渗透胁迫程度的加剧和胁迫时间的延长,2种枸杞叶片相对电导率和MDA含量均显著增加,且‘宁杞5号’的增幅要大于‘黑杞1号’,说明此时保护酶活性已经受到抑制,细胞膜脂过氧化作用增强,MDA大量产生,细胞膜透性增加,混合盐胁迫已经对2种枸杞都造成了一定的损伤,但‘宁杞5号’细胞膜受损伤的程度要大于‘黑杞1号’。
与此同时,植物体内SOD等抗氧化酶的活性与植物的抗氧化胁迫能力呈正相关[23]。为了防止盐伤害,植物体的保护酶系统协同作用共同清除细胞内多余的O2-和H2O2,使得植物体内活性氧和自由基维持在较低水平,保护细胞免受伤害[21,24]。本实验中,‘宁杞5号’叶片中的SOD、POD、CAT活性均随胁迫程度的加剧呈先升后降的变化趋势,且SOD和CAT活性均显著高于对照;‘黑杞1号’叶片中3种保护酶活性均呈升高趋势,但其POD和CAT活性在-1.18 MPa混合盐溶液胁迫21 d后有所下降,但均显著高于对照。说明枸杞忍受的活性氧水平存在阈值[25],一旦超过阈值,保护酶清除活性氧的防御能力下降,有害物质含量上升,造成质膜损伤。高渗透势(-1.18 MPa)的盐胁迫和处理时间的延长破坏了2种枸杞抗氧化酶系统,但‘黑杞1号’的抗氧化酶系统在混合盐处理下相对较为稳定,且‘黑杞1号’的抗氧化酶活性要高于‘宁杞5号’,又说明‘黑杞1号’比‘宁杞5号’具有更强的抗氧化酶保护系统。这与肖国增等[26]对耐盐性不同的2种匍匐翦股颖抗氧化酶活性在盐胁迫下的表现相一致。
再次,渗透调节作用也是植物适应逆境胁迫的重要生理机制[27]。在盐胁迫条件下,植物体内会逐渐积累大量的Pro、SS、SP,以协调细胞与外界的渗透压平衡,保护细胞膜和蛋白活性,减轻盐胁迫对植物伤害[28,29]。本试验中,2种枸杞的Pro和SS含量均随混合盐胁迫程度的加剧而增加,同时‘宁杞5号’的积累量高于‘黑杞1号’,且二者在-0.82和-1.18 MPa混合盐溶液胁迫处理下显著高于对照,而在-0.47 MPa盐溶液胁迫下较对照增加不显著。说明枸杞对-0.47 MPa盐溶液胁迫具有一定的耐受性,在-0.82和-1.18 MPa盐溶液胁迫下枸杞能有效积累Pro和SS来调节细胞渗透压,以维持细胞的正常功能。2种枸杞SP含量在混合盐溶液胁迫下的变化趋势也大致相同,呈先升后降的趋势,说明随着盐胁迫程度的加剧,大量的Na+、Cl-、SO42-渗入细胞后,使蛋白质合成受阻,同时蛋白质的水解作用加强。
综上所述,不同品种的枸杞在混合盐胁迫下有不同的适应机制。-0.47 MPa混合盐溶液渗透胁迫增加了‘宁杞5号’和‘黑杞1号’的叶绿素和可溶性蛋白含量,进而促进了2种枸杞的光合作用和新陈代谢能力。随着渗透势的降低和胁迫处理时间的延长,2种枸杞相对电导率以及丙二醛、脯氨酸和可溶性糖含量逐渐增加,但‘宁杞5号’的积累量大于‘黑杞1号’;但是,相同混合盐渗透胁迫下,‘黑杞1号’的抗氧化酶活性要高于‘宁杞5号’,且表现得更为稳定。可见,2种枸杞均可通过积累渗透调节物质和加强抗氧化酶系统来缓解盐胁迫对自身的伤害,‘宁杞5号’的渗透调节能力较强,而‘黑杞1号’具有更稳定的抗氧化酶系统,能及时有效清除活性氧,降低膜脂过氧化作用,稳定细胞膜,从而具有更强耐受盐胁迫的能力。
参考文献:
[1] SHABALA S. Learning from halophytes: physiological basis and strategies to improve abiotic stress tolerance in crops[J].AnnalsofBotany,2013,112(7): 1 209-1 221.
[2] 李建国,濮励杰,朱 明,等.土壤盐渍化研究现状及未来研究热点[J].地理学报,2012,67(9): 1 233-1 245.
LI J G, PU L J, ZHU M,etal. The present situation and hot issues in the salt-affected soil[J].ActaGeogeraphicaSinicaResearch, 2012,67(9): 1 233-1 245.
[3] 刘 强,王占武,周晓梅. 苍耳对盐碱胁迫的生理响应[J].东北林业大学学报,2017,45(4): 23-27.
LIU Q, WANG Z W, ZHOU X M. Physiological responses ofXanthiumsibiricumto salt and alkali stresses[J].JournalofNortheastForestryUniversity, 2017,45(4): 23-27.
[4] 刘正祥,张华新,杨 升,等. NaCl胁迫对沙枣幼苗生长和光合特性的影响[J].林业科学,2014,50(1): 32-40.
LIU Z X, ZHANG H X, YANG S,etal. Effects of NaCl stress on growth and photosynthetic characteristics ofElaeagnusangustifoliaseedlings[J].ScientiaSilvaeSinicae,2014,50(1): 32-40.
[5] 王树凤,胡韵雪,孙海菁,等.盐胁迫对2种栎树苗期生长和根系生长发育的影响[J].生态学报, 2014,34(4): 1 021-1 029.
WANG S F, HU Y X, SUN H J,etal. Effects of salt stress on growth and root development of two oak seedlings[J].ActaEcologicaSinica,2014,34(4): 1 021-1 029.
[6] 高彩婷,刘景辉,张玉芹,等.短期盐胁迫下燕麦幼苗的生理响应[J].草地学报,2017,25(2): 337-343.
GAO C T, LIU J H, ZHANG Y Q,etal. Physiological responses of oats seedlings to short -term salt stress[J].ActaAgrestiaSinica, 2017,25(2): 337-343.
[7] 王立红,李星星,孙影影,等.外源水杨酸对NaCl胁迫下棉花幼苗生长生理特性的影响[J].西北植物学报, 2017,37(1): 154-162.
WANG L H, LI X X, SUN Y Y,etal. Effects of exogenous salicylic acid on the physiological characteristics and growth of cotton seedlings under NaCl stress[J],ActaBot.Boreal.-Occident.Sin, 2017,37(1): 154-162.
[8] 钟鉎元.枸杞高产栽培技术[M].北京:金盾出版社,第2版,2012.
[9] 刘丽萍,张东智,张 冲,等.黑果枸杞抗逆性及栽培育种研究进展[J].生物技术通报,2016,32(10): 118-127.
LIU L P, ZHANG D Z, ZHANG C,etal. Research progress of stress tolerance and breeding research onLyciumruthenicumMurr[J].BiotechnologyBulletin, 2016,32(10): 118-127.
[10] WEI Y, XU X, TAO H,etal. Growth performance and physiological response in the halophyteLyciumbarbarumgrown at salt-affected soil[J].AnnalsofAppliedBiology,2006,149(3): 263-269.
[11] 王桔红,陈 文.黑果枸杞种子萌发及幼苗生长对盐胁迫的响应[J].生态学杂志,2012,31(4): 804-810.
WANG J H, CHEN W. Responses of seed germination and seedling growth ofLyciumruthenicumto salt stress[J].ChineseJournalofEcology, 2012,31(4): 804-810.
[12] QI Y, WANG J, WANG Q,etal. Physiological response of Chinese wolfberry seedling to NaCl stress[J].AgriculturalScience&Technology,2016,17(6): 1 301-1 304.
[13] 王龙强,蔺海明,米永伟.盐胁迫对枸杞属2种植物幼苗生理指标的影响[J].草地学报,2011,19(6): 1 010-1 017.
WANG L Q, LIN H M, MI Y W. Effects of salt stress on physiological indices of twoLyciumseedlings[ J].ActaAgrestiaSinica, 2011,19(6): 1 010-1 017.
[14] 齐延巧,王建友,王 琴,等.枸杞幼苗对NaCl处理的生理响应[J].AgriculturalScience&Technology, 2016,17(6): 1 301-1 304.
QI Y Q, WANG J Y, WANG Q,etal. Physiological response of chinese wolfberry seedling to NaCl stress[J].AgriculturalScience&Technology, 2016,17(6): 1 301-1 304.
[15] 刘正祥,张华新,杨秀艳,等.植物对氯化钠和硫酸钠胁迫生理响应研究进展[J].世界林业研究, 2015,28(4): 17-23.
LIU Z X, ZHANG H X,YANG X Y,etal. Reaearch progress on physiological responses of plants to NaCl and Na2SO4stress[J].WordForestryRersearch, 2015,28(4): 17-23.
[16] 张立军,樊金娟.植物生理学实验教程[M].北京:中国农业大学出版社,2007.
[17] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[18] 李合生.植物生理生化实验原理与技术[M].北京: 高等教育出版社,2000.
[19] KOYRO H W, HUSSAIN T, HUCHZERMETER B,etal. Photosynthetic and growth responses of a perennial halophytic grassPanicumturgidumto increasing NaCl concentrations[J].Environmental&ExperimentalBotany, 2013,91(91): 22-29.
[20] 刘玉冰,李新荣,谭会娟,等.荒漠地区两种生态型芦苇叶片的抗氧化生理特性分析[J].中国沙漠,2011,31(2): 277-281.
LIU Y B, LI X R, TAN H J,etal. Leaf anti-oxidative physiology of two ecotypes of reed in the desert regions, China[J].JournalofDesertResearch, 2011,31(2): 277-281.
[21] REGINATO M A, CASTAGNA A, FURLAN A,etal. Physiological responses of a halophytic shrub to salt stress by Na2SO4and NaCl: oxidative damage and the role of polyphenols in antioxidant protection[J].AoBPlants, 2016,6(4): 367-372.
[22] FARHANGI-ABRIZ S, TORABIAN S. Antioxidant enzyme and osmotic adjustment changes in bean seedlings as affected by biochar under salt stress[J].Ecotoxicology&EnvironmentalSafety, 2017,137: 64-70.
[23] TARCHOUNE I, SGHERRI C, IZZO R,etal. Antioxidative responses of ocimum basilicum to sodium chloride or sodium sulphate salinization[J].PlantPhysiologyandBiochemistry, 2010,48(9): 772-777.
[24] AHMAD P, LATEF A A A, HASHEM A,etal. Nitric oxide mitigates salt stress by regulating levels of osmolytes and antioxidant enzymes in chickpea[J].FrontiersinPlantScience, 2016,7(868): 347.
[25] 李永洁,李 进,徐 萍,等.黑果枸杞幼苗对干旱胁迫的生理响应[J].干旱区研究, 2014,31(4): 756-762.
LI Y J, LI J, XU P,etal. Physiological responses ofLyciumruthenicumMurr. seedlings to drought stress[J].AridZoneResearch, 2014,31(4): 756-762.
[26] 肖国增,滕 珂,李林洁,等.盐胁迫下匍匐翦股颖抗氧化酶活性及基因表达机制研究[J].草业学报,2016,25(9): 74-82.
XIAO G Z, TENG K, LI L J,etal. Antioxidant enzyme activity and gene expression in creeping bentgrass under salt stress[J].ActaPrataculturaeSinica, 2016,25(9): 74-82.
[27] KIANI S, GRIEU P, MAURY P,etal. Genetic variability for physiological traits under drought conditions and differential expression of water stress-associated genes in sunflower (HelianthusannuusL.)[J].Tag.Theoretical&AppliedGenetics.theoretischeUndAngewandteGenetik, 2007,114(2): 193-207.
[28] FOOWERS T J, COLMER T D. Salinity tolerance in halophytes[J].NewPhytologist, 2008,179(4): 945-963.
[29] XU Z M, HE B Y, LI Q S,etal. Differences between two amaranth cultivars in accumulations of Cd and main osmotic adjustment substances under salt stress[J].ChineseJournalofEcology, 2015,34(2): 483-490.
