不同放牧强度下土壤氨氧化和反硝化微生物的变化特征
2018-06-07孙翼飞沈菊培张翠景韩国栋赵巴音那木拉贺纪正
孙翼飞,沈菊培,*,张翠景,韩国栋,红 梅,赵巴音那木拉,贺纪正
1 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085 2 中国科学院大学,北京 100049 3 内蒙古农业大学生态环境学院,呼和浩特 010019
放牧是草地生态系统主要的土地利用方式之一,动物的采食、践踏和排泄等行为直接或间接的影响草地植物群落组成。有研究表明,放牧显著降低了植物地上生物量,进而影响植物对土壤氮素的吸收,降低生态系统生产力[1],且不同放牧强度下地上植物生产力及植物群落组成有显著变化[2]。植物是生态系统物质循环的纽带,地上植物生物量、丰度及多样性的变化势必会影响地下生态系统功能及元素循环过程[3-4]。因此,放牧会直接或间接的影响土壤微生物代谢、生长和养分转化等。Xie和Wittig研究发现,随着放牧强度的增加,土壤有机质、有机氮含量显著降低[5]。轻度放牧会增加土壤总氮含量,促进土壤氮素循环,有利于提高土壤肥力,而重度放牧会降低土壤有效氮含量,从而影响植物氮吸收[6]。放牧对植物生产力、土壤环境及氮素循环的影响已有大量的研究[7-8],而参与氮循环的土壤微生物对放牧强度的响应机制还不十分明确[9]。
氨氧化作用是土壤硝化作用的限速步骤,是氮循环过程的关键环节[10];氨氧化过程的产物硝酸盐通过反硝化作用还原为一系列氮氧化气体和氮气,进而导致土壤氮素的损失及温室气体排放增加[11-12],加剧全球气候变化。土壤硝化及反硝化功能微生物在氮素可利用性、硝酸盐淋溶和氮氧化气体排放等方面起着关键作用。有研究表明,放牧显著降低了荒漠草原氨氧化及反硝化微生物功能基因丰度,进而显著影响土壤中可利用氮含量及生态系统氮素流失[11]。轻度放牧可显著刺激地下微生物活性,而中度和重度放牧通过改变土壤异养呼吸、矿化和硝化过程,进而影响土壤氮库[13- 15]。理解放牧对微生物介导的氨氧化过程和反硝化过程的影响及其反馈有助于认识草地生态系统氮素循环过程及其对人类活动及气候变化的响应机制,为草地生态系统恢复及合理开发利用提供科学依据。
北方温带草原是我国重要的生态屏障,在涵养水源、防风固沙、调节气候、维持生物多样性和提供畜牧产品等方面发挥着不可替代的作用。近几十年来,我国草地不同程度地存在着过度放牧现象,草地退化严重。本研究依托于内蒙古农牧科学院四子王旗试验基地不同放牧强度的试验,分析放牧强度对土壤理化性质、氨氧化细菌(ammonia oxidizing bacteria, AOB)和氨氧化古菌(ammonia oxidizing archaea, AOA)微生物(amoA基因)及反硝化(如nosZ基因)功能微生物丰度、群落结构及多样性的影响,以探索草地生态系统土壤微生物对放牧干扰的响应机制。
1 材料与方法
1.1 试验样地与设计
试验样地位于内蒙古农牧科学院四子王旗试验基地(41°47′17″ N,111°53′46″ E),年平均气温在3.4 ℃,年平均降水量在110—250 mm之间。试验区植被属短花针茅荒漠草原的地带性植被,草场处于半干旱草原和干旱半荒漠草原地带。草地植物群落类型为短花针茅+冷蒿+无芒隐子草[16]。
放牧试验开始于2004年,整个试验区分为12个小区,划分为3个区组,每个区组有对照区、轻度放牧区、中度放牧区和重度放牧区4种处理,每个处理3个重复。各小区位置完全随机分布,面积为4.40 hm2。放牧载蓄率分别为对照0只/hm2、轻度放牧0.93只/hm2、中度放牧1.82只/hm2、重度放牧2.71只/hm2[17]。供试羊为当地成年蒙古羯羊,每年总放牧期为6个月,放牧从6月初开始,到11月末结束。试验区绵羊每3年更换一次。
土壤采集于2014年5月底。每个小区以“S”形采集9个样点,每个采样点用直径5 cm的土钻取0—20 cm土壤,混合后作为该小区供试土样。剔除土壤中可见的石块和动植物残体后,土样带回实验室过2 mm筛后一部分保存于-80 ℃超低温冰箱,用于分子生物学分析;另一部分土样自然风干,用于测定土壤基本化学性质。
1.2 土壤基本理化性质和微生物活性测定

硝化潜势及反硝化酶活性的测定分别采用氯酸盐抑制法[11]和乙炔抑制法[12],主要步骤同文献[18]。土壤异养呼吸是指微生物分解土壤有机质后释放CO2的过程,其测定方法如下:称量10 g新鲜土壤加入到120 mL血清瓶中,在25 ℃条件下培养24 h, 用气相色谱仪(Agilent 7890A GC System)测定产生的CO2浓度[19]。
1.3 土壤DNA提取和实时定量PCR
称取0.25 g冻干土,按照PowerSoilTMTotal DNA Isolation试剂盒(Mo Bio Laboratories, Inc., San Diego, CA, USA)所提供的方法提取土壤DNA。采用NanoDrop分光光度计(NanoDrop Technologies, USA)测定DNA的浓度和纯度。DNA样品存储在-20 ℃,10倍稀释后用作下游分子实验的模板。
AOA-amoA、AOB-amoA和nosZ基因的定量测定在iCycler iQ5仪器(Bio-Rad Laboratories, Inc., USA)上完成,使用的引物和扩增条件如表1所示。采用SYBR GREEN作为荧光标记,反应体系为25 μL,包含12.5 μL 2 x SYBR Premix Ex TaqTM(Takara Biotechnology, Japan),前后引物各0.5 μL(10 μmol/L),2 μL的DNA模板(1—10 ng),其余用灭菌水补足。用于标准曲线的质粒制备和提取参照之前文献中发表的方法[23],十倍连续稀释的质粒用于构建定量PCR的标准曲线,所有基因的扩增效率均保证在85%—98%之间,R2为0.99。利用溶解曲线和琼脂糖凝胶电泳确保扩增的特异性。
1.4 末端限制性片段长度多态性(T-RFLP)
采用末端限制性片段长度多态性(Terminal restriction fragment length polymorphism, T-RFLP)方法来评估放牧强度对AOA-amoA,AOB-amoA和nosZ基因群落结构的影响。其原理是用荧光标记目标DNA片段的末端(5′端),酶切后产生长度不等的末端限制性长度片段(T-RFs),经测序后输出带有T-RFs长度大小及荧光强度的图谱,图谱含有的波峰越多,表明微生物种类越丰富[24]。通过对不同样品图谱间波峰的比较,可得到各功能基因群落结构和多样性在处理间的差异。土壤DNA的PCR扩增采用表1所列引物,其中正向引物的5′末端用6-carboxyfluorescein(FAM)标记荧光用于T-RFLP研究。PCR产物用Wizard SV Gel and PCR Clean-Up System试剂盒(Promega, USA)纯化。选取适当的限制性内切酶酶切纯化后的产物,即AOA-amoA和nosZ基因采用的内切酶是HhaI(TaKaRa Biotechnology, Japan),AOB-amoA基因采用内切酶MspI(Takara Biotechnology, Japan)。反应体系为20 μL,包括酶(4 U)和DNA样品(约500 ng),在37 ℃下酶切3 h。反应产物送至测序公司(TSINGKE, Beijing),利用ABI PRISM 3700 DNA分析仪(Applied Biosystems, USA)进行毛细管电泳,检测酶切片段。使用GeneMarker软件(SoftGenetics, USA)分析得到的图谱,合并长度相差1 bp的片段。T-RFs的相对丰度用每个片段的峰面积除以总的峰面积表示,相对丰度不到1%的片段未参与计算。

表1 PCR所用的引物序列和反应条件
(nosZ-F+nosZ2R) 用于nosZ基因的T-RFLP分析
1.5 统计分析
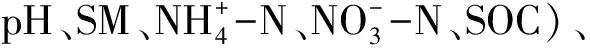
2 结果与分析
2.1 不同放牧强度对土壤理化性质和微生物活性的影响
不同放牧强度对土壤理化性质和微生物活性的影响见表2。随放牧强度的增加,土壤pH波动范围为7.90—8.18,在中度放牧处理中显著增加(P=0.03)。放牧处理显著增加了土壤铵态氮含量(P=0.02),其含量变化范围为6.37—35.92 mg/kg,且在重度放牧处理中最高。不同放牧强度土壤异养呼吸相比未放牧处理均显著降低(P=0.02),波动范围为1.54—4.70 μL CO2g-1d-1。随放牧强度增加,土壤含水量、有机碳、硝态氮、硝化潜势和反硝化酶活性无显著影响。Spearman相关分析发现,土壤pH与土壤呼吸显著负相关(ρ=-0.66,P=0.02)。
2.2 不同放牧强度对氨氧化和反硝化功能基因丰度的影响
应用定量PCR技术测定土壤氨氧化菌AOA-amoA、AOB-amoA基因及反硝化细菌nosZ基因的丰度(图1)。不同放牧强度下AOA-amoA基因丰度无显著差异(P=0.26),基因丰度范围为每克干土(4.94—7.60)×109个拷贝数。放牧强度对AOB-amoA(P=0.04)和nosZ(P=0.03)基因丰度有显著影响。AOB-amoA基因丰度波动范围为每克干土(0.68—3.75)×106个拷贝数,且在中度放牧处理中最低,与未放牧处理相比降低了18.1%。nosZ基因丰度范围为每克干土(2.49—5.78)×108个拷贝数,且在轻度放牧处理中最低,与未放牧处理相比降低了57.6%。

表2 不同放牧强度下土壤理化性质与微生物活性
同一行数据后不同字母表示同一测量指标在不同处理间差异显著(Duncan检验),显著性水平P< 0.05;表中数据为平均值±标准差(n=3)

图1 不同放牧强度下土壤AOA-amoA (a)、AOB-amoA (b)和nosZ (c)基因的丰度Fig.1 Abundance of AOA-amoA gene (a), AOB-amoA gene (b) and nosZ gene (c) across different grazing intensitiesCK:对照,control;LG:轻度放牧,low-level grazing;MG:中度放牧,middle-level grazing;HG:重度放牧,high-level grazing
Spearman相关分析表明,AOA-amoA基因丰度与土壤异养呼吸(Rh)显著负相关(ρ=-0.69,P=0.01),AOB-amoA基因丰度与铵态氮含量显著负相关(ρ=-0.60,P=0.04)。nosZ基因丰度与铵态氮含量显著正相关(ρ=0.58,P=0.04),与土壤含水量(ρ=-0.78,P< 0.01)显著负相关。
2.3 不同放牧强度对氨氧化和反硝化群落结构的影响
不同放牧强度下AOA-amoA、AOB-amoA和nosZ基因T-RFLP分析结果见图2。使用HhaI酶对土壤AOA-amoA基因进行酶切,主要得到5个限制性末端片段(T-RFs),其中T-RFs 541 bp、265 bp和352 bp为优势片段,其平均相对丰度分别为59.5%、21.4%和9.3%。AOB-amoA基因获得6个主要T-RFs片段,其中T-RFs 70 bp、130 bp、154 bp和141 bp是主要的片段,其平均相对丰度分别为25.3%、24.7%、22.2%和20.7%。反硝化nosZ基因主要获得6个片段,其中T-RFs 109 bp、190 bp、75 bp和204 bp为优势片段,其平均相对丰度分别为40.7%、18.2%、12.3%和10.8%。

图2 不同放牧强度下土壤AOA-amoA (a)、AOB-amoA (b) 和nosZ (c) 基因T-RFs相对丰度Fig.2 Relative abundance of T-RFs of AOA-amoA gene (a), AOB-amoA gene (b) and nosZ gene (c) across different grazing intensities
以各功能基因T-RFs的相对丰度为依据,以香农指数(Shannon Index)表征AOA-amoA、AOB-amoA和nosZ基因群落多样性。PerMANOVA结果表明,随放牧强度的增加,AOA-amoA、AOB-amoA和nosZ基因群落多样性均呈显著下降趋势,且中度和重度放牧处理显著低于轻度放牧处理(表3)。Spearman相关分析结果表明,AOB-amoA和nosZ基因群落多样性与Rh显著正相关(ρ=0.52,P=0.02;ρ=0.55,P< 0.05),AOA-amoA基因群落多样性与SOC显著正相关(ρ=0.44,P< 0.05)。

表3 不同放牧强度下AOA-amoA、AOB-amoA和nosZ基因香农指数
不同小写字母表示同一测量指标在不同处理间差异显著(Duncan检验),显著性水平P<0.05;表中数据为平均值±标准差(n=3)
不同放牧强度对AOA-amoA基因群落结构有显著影响(P=0.04),而对AOB-amoA和nosZ基因群落结构无显著性影响。应用冗余分析(RDA)来评估微生物群落结构和土壤理化性质之间的关系(图3)。结果表明:前两轴对AOA-amoA基因群落的解释量分别为40.1%和10.4%,且土壤SOC (P=0.03)、铵态氮(P=0.02)及硝态氮(P=0.02)含量对AOA-amoA基因群落结构有显著影响。前两轴共同解释了AOB-amoA基因群落结构变异程度的45.7%,土壤pH(P=0.08)是显著影响AOB-amoA基因群落变化的环境因子。前两轴对nosZ基因群落结构变异的解释度为35.3%,且群落结构变化与硝态氮含量(P< 0.05)显著相关。

图3 土壤AOA-amoA (a)、AOB-amoA (b) 和nosZ (c) 基因群落组成和环境变量的冗余分析Fig.3 Biplot of redundancy analysis (RDA) of relationship between soil properties and communities of AOA-amoA gene (a), AOB-amoA (b) and nosZ gene (c)pH:土壤pH,potential of hydrogen;soil moisture:土壤含水量,soil moisture;SOC:土壤有机碳,soil organic 铵态氮含量,ammonia 硝态氮含量,nitrate content
3 讨论
3.1 不同放牧强度对土壤理化性质和微生物活性的影响
放牧对土壤理化性质的影响随着放牧强度的不同而变化。本研究中土壤pH随放牧强度呈现先增加后降低的趋势,与未放牧处理相比,尽管中度放牧显著增加了土壤pH(P=0.03),但二者仅相差0.2个单位。有研究表明,放牧会显著增加土壤pH[25-26],但本研究中土壤pH变化幅度较小,不足以作为评估放牧强度对土壤功能微生物影响的主要指标。放牧显著增加了土壤铵态氮的含量,这与其他学者的研究相一致[27-28]。随放牧强度的增加,进入土壤中的牲畜排泄物增加,进而增加土壤的铵态氮和硝态氮含量。土壤异养呼吸是土壤微生物活性的重要指标,反映了微生物对土壤有机质分解的速度和强度。本研究中放牧强度显著降低了土壤异养呼吸。米智勇在研究不同放牧强度对该试验样地土壤理化性质的影响时发现,随放牧强度的增加,土壤碳氮比显著下降,其波动范围为9.56—10.26,波动幅度为0.67[29],说明微生物碳源含量的降低是土壤异氧呼吸显著降低的原因之一。
3.2 不同放牧强度对土壤氨氧化和反硝化微生物的影响
氨氧化和反硝化微生物是土壤中重要的氮素转化功能微生物,是土壤氨氧化和反硝化过程的主要参与者,其数量和活性与土壤生态系统氮循环密切相关。有研究表明,放牧会显著增加AOA-amoA和AOB-amoA基因丰度[30]。但本研究中,随放牧强度的增加,AOA-amoA基因丰度无显著变化,AOB-amoA基因丰度显著下降。造成这一结果的原因可能是:1)不同放牧处理显著影响了土壤pH,但其值变异很小,始终在pH为8的范围波动,而土壤AOA的基因丰度无显著变化,这和我们前期的研究结果一致[31],即AOA尽管在土壤中保持很高的水平,但在碱性土壤中对氮的响应比AOB更为不灵敏;2)有学者认为,氨氧化功能微生物丰度更易受土壤理化性质的影响,而非放牧处理的影响[32],土壤可利用性底物含量是影响土壤氨氧化微生物的重要因素[33]。随着放牧强度增加,土壤铵态氮含量也显著增加,而硝态氮在不同处理间无显著差异,可能是采样时间离放牧处理的时间较近,由于放牧强度增大致使铵态氮大量累积;而氨氧化微生物主要以土壤中NH3为底物[34],重度放牧处理后短时间内土壤可利用的NH3含量有限,进而显著影响AOB的数量和群落多样性,而随着时间的推移,AOB微生物可利用的底物也会逐渐增加,达到一个稳定的状态。此外,放牧强度对AOA基因群落结构有显著影响,AOB基因群落结构无显著变化。RDA结果显示土壤铵态氮和硝态氮含量对AOA群落具有显著影响,说明由放牧所导致的以牲畜排泄物形式进入土壤中的可利用氮含量增加是导致AOA群落结构变化的主要原因之一。
本研究中nosZ基因丰度与土壤铵态氮含量显著正相关。有研究表明,nosZ基因参与了反硝化作用的最后一步,其丰度主要受底物含量、土壤通气状况及土壤pH等环境条件的影响[35]。放牧显著降低了AOB基因丰度,即降低了反硝化底物硝态氮的含量,且硝态氮含量在轻度放牧处理中最低,进而轻度放牧处理显著降低了nosZ基因丰度,但随放牧强度的增加,土壤紧实度增加,通气性降低,促进反硝化细菌的生长,进而增加了nosZ基因丰度。有研究指出nosZ基因丰度随放牧强度的增加无显著变化[36],这主要与研究区域的地理位置、植物群落、土壤类型等因素有关[37],同时,目前关于放牧强度界定(轻度、中度和重度)的差异也是造成上述结果不一致性的重要原因。此外,RDA结果表明土壤硝态氮含量对nosZ基因群落结构有显著影响,说明随着放牧强度的增加,由牲畜采食践踏所导致的土壤有机质矿化加剧,显著影响土壤中可利用氮含量,进而影响土壤nosZ基因群落结构[38-39]。
4 结论
(1)土壤pH和铵态氮含量分别在7.90—8.18和6.37—35.92 mg/kg之间,中度放牧处理显著增加了土壤pH(P=0.03),而铵态氮含量在重度放牧处理中最高(P=0.02)。不同放牧强度下土壤异养呼吸相比未放牧处理均显著降低(P=0.02)。
(2)AOA-amoA和AOB-amoA基因丰度范围分别为每克干土(4.94—7.60)×109个拷贝数和(0.68—3.75)×106个拷贝数,放牧处理对AOA-amoA基因丰度无显著影响,中度放牧处理显著降低了AOB-amoA基因丰度(P=0.04);反硝化微生物nosZ基因丰度范围为每克干土(2.49—5.78)×108个拷贝数,且在轻度放牧处理中最低(P=0.03)。土壤铵态氮含量是影响AOA和AOB功能基因amoA丰度的主要因子,而nosZ基因丰度主要受反硝化底物含量及土壤通气状况影响。
(3)放牧显著影响了AOA-amoA基因群落结构,而AOA-amoA、AOB-amoA和nosZ基因群落多样性均随放牧强度的增加而降低,且中度和重度放牧显著低于轻度放牧。由放牧所引起的可利用氮素含量的变化是导致氨氧化和反硝化微生物群落显著变化的主要因素。
参考文献(References):
[1] 安慧, 李国旗. 放牧对荒漠草原植物生物量及土壤养分的影响. 植物营养与肥料学报, 2013, 19(3): 705- 712.
[2] 陈佐忠, 汪诗平. 中国典型草原生态系统. 北京: 科学出版社, 2000: 1- 5.
[3] 高英志, 汪诗平, 韩兴国, 陈全胜, 王艳芬, 周志勇, 张淑敏, 杨晶. 退化草地恢复过程中土壤氮素状况以及与植被地上绿色生物量形成关系的研究. 植物生态学报, 2004, 28(3): 285- 293.
[4] 沙琼, 黄建辉, 白永飞, 韩兴国. 植物功能群去除对内蒙古典型草原羊草群落土壤碳、氮库的影响. 应用生态学报, 2009, 20(6): 1305- 1309.
[5] Xie Y Z, Wittig R. The impact of grazing intensity on soil characteristics ofStipagrandisandStipabungeanasteppe in northern China (autonomous region of Ningxia). Acta Oecologica, 2004, 25(3): 197- 204.
[6] 高雪峰, 韩国栋. 放牧对羊草草原土壤氮素循环的影响. 土壤, 2011, 43(2): 161- 166.
[7] Guitian R, Bardgett R D. Plant and soil microbial responses to defoliation in temperate semi-natural grassland. Plant and Soil, 2000, 220(1/2): 271- 277.
[8] Clegg C D. Impact of cattle grazing and inorganic fertiliser additions to managed grasslands on the microbial community composition of soils. Applied Soil Ecology, 2006, 31(1/2): 73- 82.
[9] Zhou X Q, Wang J Z, Hao Y B, Wang Y F. Intermediate grazing intensities by sheep increase soil bacterial diversities in an Inner Mongolian steppe. Biology and Fertility of Soils, 2010, 46(8): 817- 824.
[10] Leininger S, Urich T, Schloter M, Schwark L, Qi J, Nicol G W, Prosser J I, Schuster S C, Schleper C. Archaea predominate among ammonia-oxidizing prokaryotes in soils. Nature, 2006, 442(7104): 806- 809.
[11] Chen Y L, Hu H W, Han H Y, Du Y, Wan S Q, Xu Z W, Chen B D. Abundance and community structure of ammonia-oxidizingArchaeaandBacteriain response to fertilization and mowing in a temperate steppe in Inner Mongolia. FEMS Microbiology Ecology, 2014, 89(1): 67- 79.
[12] Tiedje J M, Simkins S, Groffman P M. Perspectives on measurement of denitrification in the field including recommended protocols for acetylene based methods. Plant and Soil, 1989, 115(2): 261- 284.
[13] Liu N, Zhang Y J, Chang S J, Kan H M, Lin L J. Impact of grazing on soil carbon and microbial biomass in typical steppe and desert steppe of Inner Mongolia. PLoS One, 2012, 7(5): e36434.
[14] Gao Y H, Schumann M, Chen H, Wu N, Luo P. Impacts of grazing intensity on soil carbon and nitrogen in an alpine meadow on the eastern Tibetan Plateau. Journal of Food, Agriculture and Environment, 2009, 7(2): 749- 754.
[15] Xu Y Q, Li L H, Wang Q B, Chen Q S, Cheng W X. The pattern between nitrogen mineralization and grazing intensities in an Inner Mongolian typical steppe. Plant and Soil, 2007, 300(1/2): 289- 300.
[16] 孙熙麟, 王明玖, 陈海军, 陈丽丽, 娜乐. 短花针茅荒漠草原地下生物量对不同强度放牧的响应. 内蒙古农业大学学报, 2010, 31(4): 101- 104.
[17] 胡红莲. 不同放牧时期放牧绵羊营养限制因素及冬季优化补饲的研究[D]. 呼和浩特: 内蒙古农业大学, 2005.
[18] Zhang C J, Shen J P, Sun Y F, Wang J T, Zhang L M, Yang Z L, Han H Y, Wan S Q, He J Z. Interactive effects of multiple climate change factors on ammonia oxidizers and denitrifiers in a temperate steppe. FEMS Microbiology Ecology, 2017, 93(4): fix037.
[19] Chen C R, Condron L M, Davis M R, Sherlock R R. Effects of afforestation on phosphorus dynamics and biological properties in a New Zealand grassland soil. Plant and Soil, 2000, 220(1/2): 151- 163.
[20] Tourna M, Freitag T E, Nicol G W, Prosser J I. Growth, activity and temperature responses of ammonia-oxidizing archaea and bacteria in soil microcosms. Environmental Microbiology, 2008, 10(5): 1357- 1364.
[21] Rotthauwe J H, Witzel K P, Liesack W. The ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations. Applied and Environmental Microbiology, 1997, 63(12): 4704- 4712.
[22] Scala D J, Kerkhof L J. Horizontal heterogeneity of denitrifying bacterial communities in marine sediments by terminal restriction fragment length polymorphism analysis. Applied and Environmental Microbiology, 2000, 66(5): 1980- 1986.
[23] Wang Q, Zhang L M, Shen J P, Du S, Han L L, He J Z. Nitrogen fertiliser-induced changes in N2O emissions are attributed more to ammonia-oxidising bacteria rather than archaea as revealed using 1-octyne and acetylene inhibitors in two arable soils. Biology and Fertility of Soils, 2016, 52(8): 1163- 1171.
[24] Osborn A M, Moore E R B, Timmis K N. An evaluation of terminal-restriction fragment length polymorphism (T-RFLP) analysis for the study of microbial community structure and dynamics. Environmental Microbiology, 2000, 2(1): 39- 50.
[25] 戎郁萍, 韩建国, 王培, 毛培胜. 放牧强度对草地土壤理化性质的影响. 中国草地, 2001, 23(4): 41- 47.
[26] 陈海军, 王明玖, 韩国栋, 吴志毅. 不同强度放牧对贝加尔针茅草原土壤微生物和土壤呼吸的影响. 干旱区资源与环境, 2008, 22(4): 165- 169.
[27] 萨仁高娃, 曹芙, 敖特根, 叁巴, 王成杰. 短期放牧强度对典型草原土壤有机碳及pH值的影响. 畜牧与饲料科学, 2014, 35(3): 5- 7.
[28] 杨红善, 那·巴特尔, 周学辉, 苗小林, 苏晓春, 常根柱. 不同放牧强度对肃北高寒草原土壤肥力的影响. 水土保持学报, 2009, 23(1): 150- 153.
[29] 米智勇. 不同放牧强度和管理方式下短花针茅荒漠草原土壤的氮矿化作用[D]. 呼和浩特: 内蒙古农业大学, 2011.
[30] Xie Z, Le Roux X, Wang C P, Gu Z K, An M, Nan H Y, Chen B Z, Li F, Liu Y J, Du G Z, Feng H Y, Ma X J. Identifying response groups of soil nitrifiers and denitrifiers to grazing and associated soil environmental drivers in Tibetan alpine meadows. Soil Biology and Biochemistry, 2014, 77: 89- 99.
[31] Shen J P, Zhang L M, Zhu Y G, Zhang J B, He J Z. Abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea communities of an alkaline sandy loam. Environmental Microbiology, 2008, 10(6): 1601- 1611.
[32] Lindsay E A, Colloff M J, Gibb N L, Wakelin S A. The abundance of microbial functional genes in grassy woodlands is influenced more by soil nutrient enrichment than by recent weed invasion or livestock exclusion. Applied and Environmental Microbiology, 2010, 76(16): 5547- 5555.
[33] 王静, 尉元明, 孙旭映. 过牧对草地生态系统服务价值的影响——以甘肃省玛曲县为例. 自然资源学报, 2006, 21(1): 109- 117.
[34] He J Z, Hu H W, Zhang L M. Current insights into the autotrophic thaumarchaeal ammonia oxidation in acidic soils. Soil Biology and Biochemistry, 2012, 55: 146- 154.
[35] Liu B B, Mørkved P T, Frostegård Å, Bakken L R. Denitrification gene pools, transcription and kinetics of NO, N2O and N2production as affected by soil pH. FEMS Microbiology Ecology, 2010, 72(3): 407- 417.
[36] Patra A K, Abbadie L, Clays-Josserand A, Degrange V, Grayston S J, Loiseau P, Louault F, Mahmood S, Nazaret S, Philippot L, Poly F, Prosser J I, Richaume A, Le Roux X. Effects of grazing on microbial functional groups involved in soil N dynamics. Ecological Monographs, 2005, 75(1): 65- 80.
[37] Ding K, Zhong L, Xin X P, Xu Z H, Kang X M, Liu W J, Rui Y C, Jiang L L, Tang L, Wang Y F. Effect of grazing on the abundance of functional genes associated with N cycling in three types of grassland in Inner Mongolia. Journal of Soils and Sediments, 2015, 15(3): 683- 693.
[38] He F F, Jiang R F, Chen Q, Zhang F S, Su F. Nitrous oxide emissions from an intensively managed greenhouse vegetable cropping system in northern China. Environmental Pollution, 2009, 157(5): 1666- 1672.
[39] Sánchez-Martín L, Vallejo A, Dick J, Skiba U M. The influence of soluble carbon and fertilizer nitrogen on nitric oxide and nitrous oxide emissions from two contrasting agricultural soils. Soil Biology and Biochemistry, 2008, 40: 142- 151.
