基于Py-GC-MS/MS技术的高寒草原土壤有机质不同组分指纹特征研究
2018-06-07陈秋宇吴应琴雷天柱斯贵才张更新
陈秋宇,吴应琴,雷天柱,斯贵才,张更新
1 中国科学院青藏高原研究所,中国科学院高寒生态学与生物多样性重点实验室,北京 100101 2 中国科学院大学,北京 100049 3 中国科学院地质与地球物理研究所兰州油气资源研究中心,兰州 7300005
土壤有机质(Soil Organic Matter,SOM)是土壤中由动植物残体以及微生物残体及其分泌物组成的混合物,其结构复杂,异质性强。由于土壤有机质复杂的结构与组成,所以对其的研究通常与分组技术密切相关。土壤有机质密度分组技术始于20世纪80年代[1],该技术的原理为:利用土壤在密度为1.6—2.5g/cm3的重液中的沉降作用将土壤有机质分为不同的组分。密度较小的有机质主要由动植物残体、菌丝体、孢子、单糖、多糖以及半木质素构成[2- 3],是介于植物与土壤腐殖质之间的产物,具有较高的周转速率,比全土周转快3—11倍[4],为中等分解速度的有机碳库。这一部分土壤在全土中含量较少,仅为土壤总重量的1.8%—3.2%,但其碳含量达到土壤总有机碳的15%—32%[5],是微生物重要的碳源,易受到微生物及土壤酶的侵入,因此具有较快的分解速率。密度较大的有机质主要是与土壤矿物紧密结合的腐殖质类物质,为土壤有机质的主要组成部分,含量高达70%—80%[2],其C/N比较低,分解转化速率极慢。正是由于不同组分的土壤有机质具有不同的性质,因此人们常将该技术应用于评价土地利用、管理措施、植被类型对碳周转、碳贮量、养分有效性、物理保护、团聚过程的影响中[6- 8]。
热裂解气相色谱质谱联用技术(Py-GC-MS/MS)是近几年兴起的专门用于研究热裂解机理的有效方法[9- 10]。该技术首先将样品置于严格控制条件的热解器中进行加热,使得大分子化合物迅速裂解成可以挥发的小分子化合物,随后小分子化合物由载气带入气相色谱/质谱仪中进行分离和鉴定,最后通过气相色谱/质谱图的特征来推断样品的组成、结构及其化学特征[11]。通过对热解产物定性定量的分析及其与裂解条件(温度、时间等)之间的相关性研究,可以推导热解产物与原样品组成、结构和物理化学性质之间的内在联系。该技术优点显著,即:快速、灵敏、需样量少等,因此被广泛应用于聚合物科学、微生物学、生物工程及地球化学等领域[12]。之前对土壤有机质的研究主要集中在土壤总碳量的估算,但土壤有机质结构组成较为复杂,仅仅从总碳量的估算难以得知其来源及降解过程,因此从分子水平对土壤有机质进行研究可以补充总碳研究中的短板。土壤有机质分子水平的研究可以确定具体化合物的种类及其含量,并且将其作为植物或者微生物的指纹谱图,例如土壤中的特征生物标志物可以区分有机质的地上或地下贡献、裸子植物源或被子植物源或是微生物源等[6- 13]。
青藏高原是世界最高、中国最大的高原,广泛分布着高寒草原和高寒草甸土壤。草原生态系统作为最脆弱的生态系统,对全球及区域环境的变化非常敏感[14]。之前,对高寒生态系统的研究主要集中在土壤总碳及总氮量的研究,有关分子水平的研究较少。因此,从分子水平对青藏高原高寒土进行研究有利于进一步了解该区域碳循环受到区域的变化、自然环境的变化以及人类活动的影响。因此,本文将采用热裂解气相色谱质谱联用(Py-GC-MS/MS)技术,来研究高寒草原土壤5个密度组分之间的热解指纹差异。
1 研究区域概况与研究方法
1.1 研究区域概况
本研究地点为青藏高原纳木错地区,位于青藏高原腹地,为典型的半干旱高原季风气候区。该地区夏、冬两季分别受印度季风与西风带控制,降水多发生在5—9月,多年平均降水量为410mm,年平均气温为-0.6℃[15]。该地区植被类型为高寒草原,主要优势种为紫花针茅(Stipapurpurea)和大花嵩草(Kobresiamacrantha)等[16]。
1.2 土壤样品采集
本试验在中国科学院纳木错综合观测站(30°46′44″N,90°59′31″E)开展相关研究。2013年8月,在纳木错典型高寒草原地区选取1m×1m的小样方,每个样点用土钻通过蛇形采集0—15cm土壤,过2mm筛后混合在一起,共3个重复。采集后的样品空运回北京,风干后进行后续实验。
1.3 分析方法
1.3.1 密度分级提取
密度分组所用重液为NaI溶液,采用Gregorich 和Ellert[6]所描述的方法:将3个重复样品混合在一起,称取10g混合样加入30mL 密度为1.6g/cm3的NaI溶液,在120rpm下振荡30min,之后在2330g下离心20min,漂浮物过0.7μm玻璃纤维滤膜(Whatman GF/F, 0.7μm)。回收滤膜上的物质用去离子水清洗至盐浓度<50Ms/cm。上述所有步骤重复3次,以确保土壤的有效分离。配制不同密度的NaI溶液,将土壤分为5个组分,分别为:F1(密度为小于1.6g/cm3)组分、F2(密度为1.6—1.8g/cm3)组分、F3(密度为1.8—2.0g/cm3)组分、 F4(密度为2.0—2.25g/cm3)组分以及F5(密度大于2.25g/cm3)组分。将获得的各组组分在80℃下烘至24h。干燥后的土壤组分进行研磨,使样品中各成分混合均匀,之后将研磨好的样品保存留待上机测定。
1.3.2 热裂解气相色谱质谱(Py-GC-MS/MS)分析条件
热裂解气相色谱质谱(Py-GC-MS/MS)分析首先是在热解器中进行,热解器接口直接与气相色谱/质谱相连接。其中,热解仪为:PY3030D;色谱质谱仪器型号为:Agilent 7890型气相色谱/7000B型三重四极杆质谱联用仪(美国Agilent公司)及Agilent 气相色谱工作站。在分析过程中,称取研磨后的土样约5mg放入热解进样杯中,并向样品中加入内标:氘代菲和C24D50,以待后续对裂解产物进行定量分析。GC-MS 分析色谱条件为:恒流模式,以氦气为载气,色谱柱为HP- 5 (100m×0.32mm×0.25μm)。升温程序:初始温度40℃, 以1℃/min速率升至100℃, 再以3℃/min 升至280℃, 恒温 25min;进样口温度为300℃。质谱条件:采用 EI, 70eV, 离子源温度 230℃, 四极杆温度150℃, 全扫描, 扫描范围为50—550amu。
1.4 统计分析
纳木错土壤不同组分各化合物的含量、不同化合物之间的比值的数据整理及计算在Excel种完成,使用R语言进行主成分分析(Principal Component Analysis,PCA),绘图在SigmaPlot中完成。
2 结果与分析
2.1 不同密度组分样品Py-GC-MS/MS的指纹特征
本研究共对150种热解产物进行定性定量分析,详细化合物信息见表1。土壤中的化合物类型主要是碳水化合物、含氮化合物、含磷化合物以及木质素等。因此,为了便于研究,本文将热解产物根据其相似的化学性质进行分组,包括:烷烃、烯烃、脂肪酸、芳烃、多环芳烃、木质素、酚类物质、多糖、含氮化合物和几丁质。
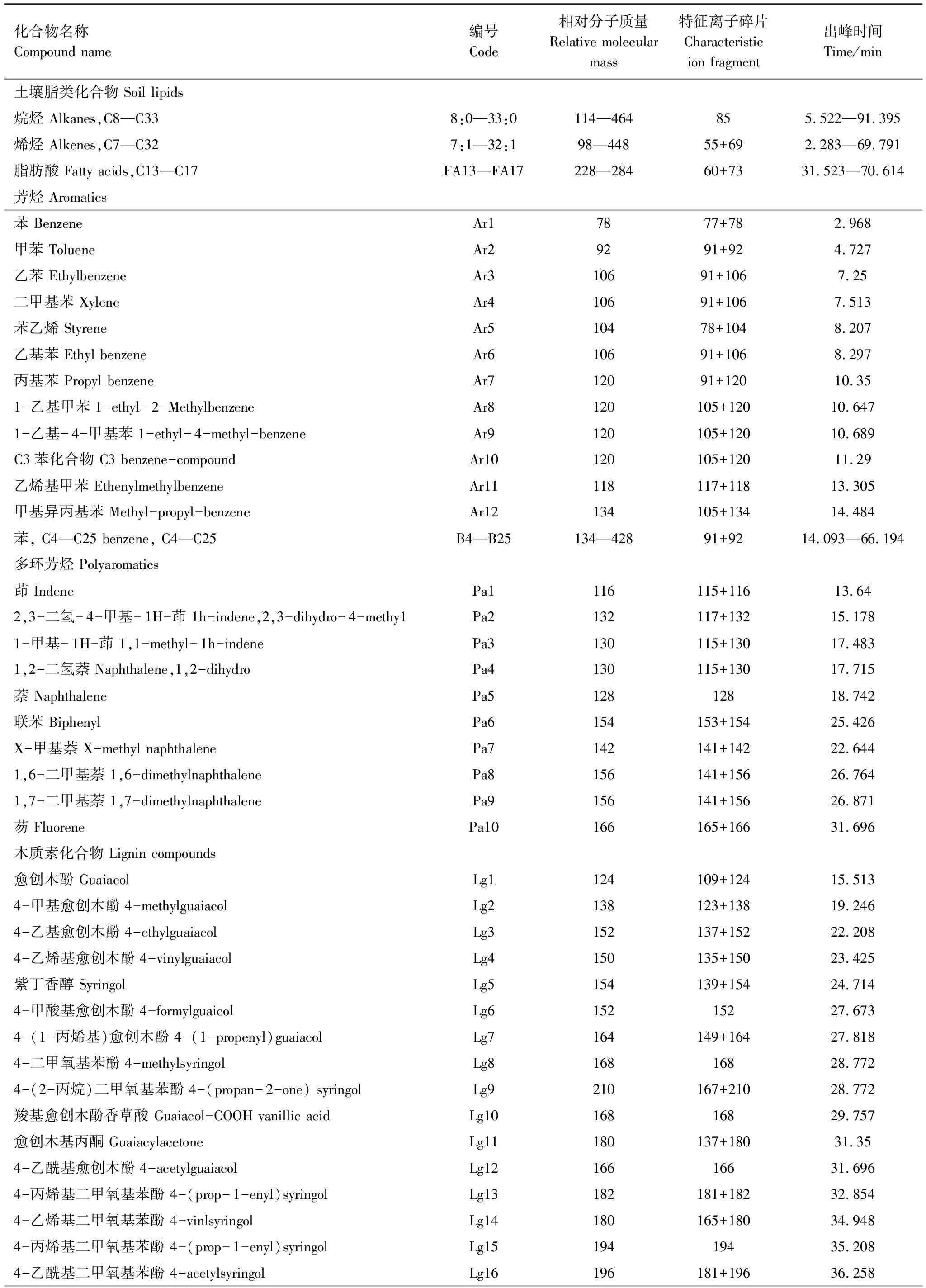
表1 本研究中土壤有机质的热解产物
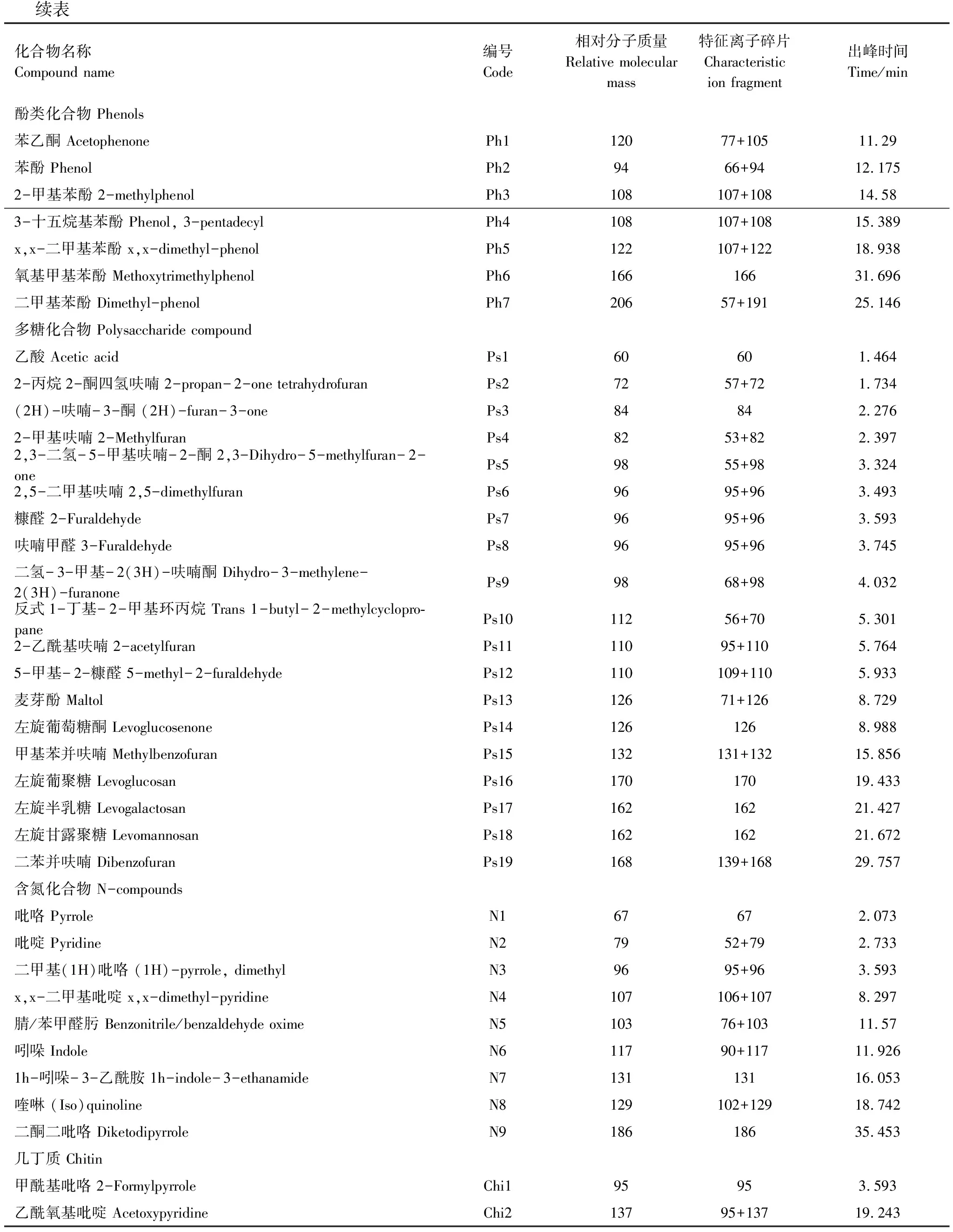
续表化合物名称Compound name编号Code相对分子质量Relative molecular mass特征离子碎片Characteristic ion fragment出峰时间Time/min酚类化合物 Phenols苯乙酮 AcetophenonePh112077+10511.29苯酚 PhenolPh29466+9412.1752-甲基苯酚 2-methylphenolPh3108107+10814.583-十五烷基苯酚 Phenol, 3-pentadecylPh4108107+10815.389x,x-二甲基苯酚 x,x-dimethyl-phenolPh5122107+12218.938氧基甲基苯酚 MethoxytrimethylphenolPh616616631.696二甲基苯酚 Dimethyl-phenolPh720657+19125.146多糖化合物 Polysaccharide compound乙酸 Acetic acidPs160601.4642-丙烷2-酮四氢呋喃 2-propan-2-one tetrahydrofuranPs27257+721.734(2H)-呋喃-3-酮 (2H)-furan-3-onePs384842.2762-甲基呋喃 2-MethylfuranPs48253+822.3972,3-二氢-5-甲基呋喃-2-酮 2,3-Dihydro-5-methylfuran-2-onePs59855+983.3242,5-二甲基呋喃 2,5-dimethylfuranPs69695+963.493糠醛 2-FuraldehydePs79695+963.593呋喃甲醛 3-FuraldehydePs89695+963.745二氢-3-甲基-2(3H)-呋喃酮 Dihydro-3-methylene-2(3H)-furanonePs99868+984.032反式1-丁基-2-甲基环丙烷 Trans 1-butyl-2-methylcyclopro-panePs1011256+705.3012-乙酰基呋喃 2-acetylfuranPs1111095+1105.7645-甲基-2-糠醛 5-methyl-2-furaldehydePs12110109+1105.933麦芽酚 MaltolPs1312671+1268.729左旋葡萄糖酮 LevoglucosenonePs141261268.988甲基苯并呋喃 MethylbenzofuranPs15132131+13215.856左旋葡聚糖 LevoglucosanPs1617017019.433左旋半乳糖 LevogalactosanPs1716216221.427左旋甘露聚糖 LevomannosanPs1816216221.672二苯并呋喃 DibenzofuranPs19168139+16829.757含氮化合物 N-compounds吡咯 PyrroleN167672.073吡啶 PyridineN27952+792.733二甲基(1H)吡咯 (1H)-pyrrole, dimethylN39695+963.593x,x-二甲基吡啶 x,x-dimethyl-pyridineN4107106+1078.297腈/苯甲醛肟 Benzonitrile/benzaldehyde oximeN510376+10311.57吲哚 IndoleN611790+11711.9261h-吲哚-3-乙酰胺 1h-indole-3-ethanamideN713113116.053喹啉 (Iso)quinolineN8129102+12918.742二酮二吡咯 DiketodipyrroleN918618635.453几丁质 Chitin甲酰基吡咯 2-FormylpyrroleChi195953.593乙酰氧基吡啶 AcetoxypyridineChi213795+13719.243
FA:脂肪酸,Fatty acids;Ar:芳烃,Aromatic;B:苯,Benzene;Pa:多环芳烃,Polyaromatic;Lg:木质素,Lignin;Ph:酚类化合物,Phenol;Ps:多糖,Polysaccharide;N:含氮化合物,N-compound;Chi:几丁质,Chitin
图1为5个组分的热解总离子流图。从总离子流图中,可以清晰的看出5个组分在含量以及化合物组成中有明显差别。F1组分峰强最强,单位有机质含量最多;F2、F3和F4 3个组分总离子流图较为相似,单位有机质含量相对较多;而F5组分总离子流图与前4个组分相比明显不同,其峰强最小,单位有机质含量最少。
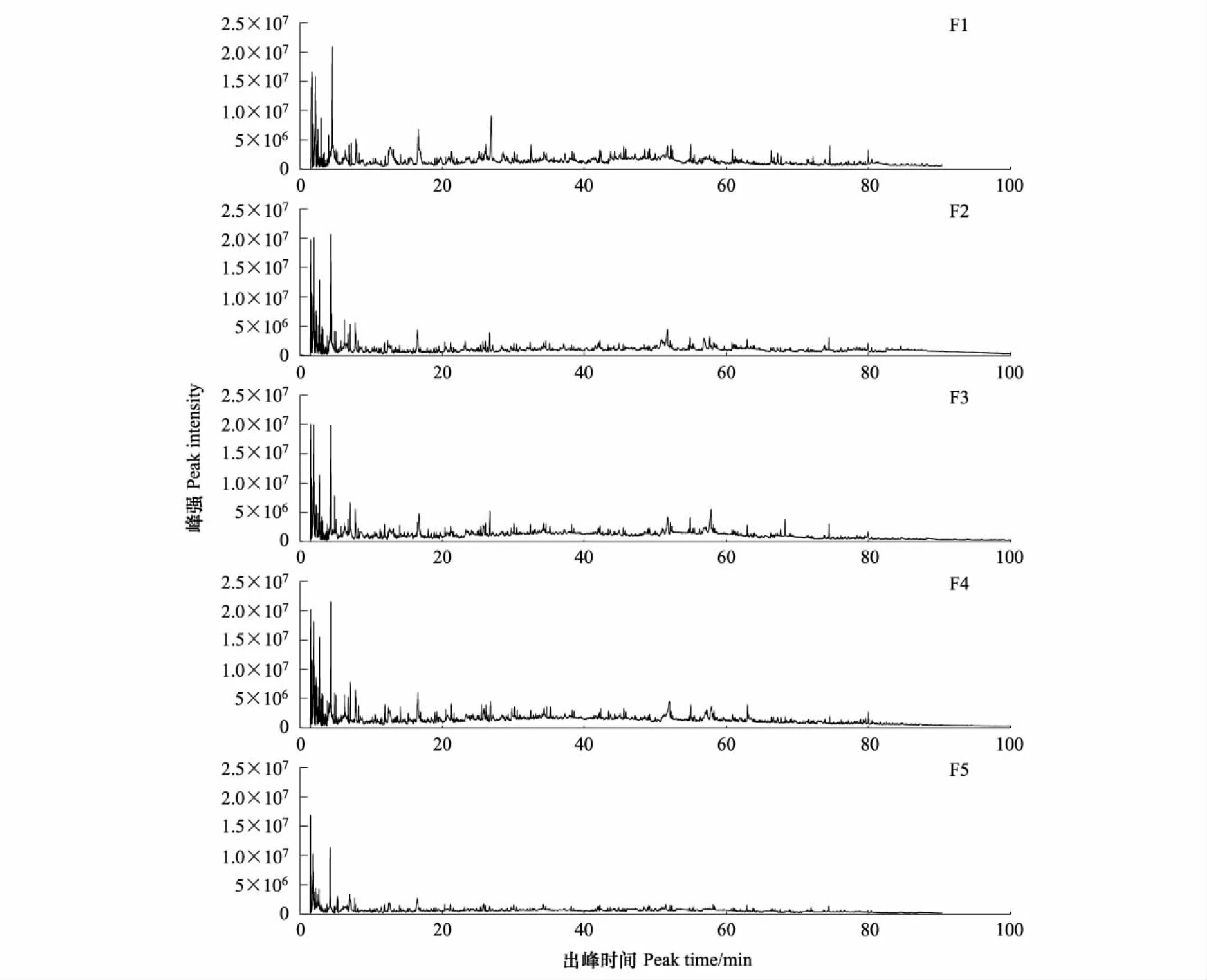
图1 不同密度土壤有机质组分总离子流图Fig.1 The typical ion chromatograms of five different density componentsF1:组分1,Fraction 1;F2:组分2,Fraction 2;F3:组分3,Fraction 3;F4:组分4,Fraction 4;F5:组分5,Fraction 5
2.2 不同密度组分样品中各化合物含量
5个组分化合物含量之间的差异在表2中呈现。烷基类化合物主要来源于土壤和植物的表面蜡质层以及维管束植物的保护层[17]。短链正构烷烃和烯烃(n<20)主要来源于微生物产物,它们为微生物的脂质碎片或是热解过程中由长链烷烃断裂而来;中链正构烷烃和烯烃来源于植物的生物聚合物(如角质和软木脂)以及微生物,但通常植物的贡献占主导地位。在5个组分中,短链烷基类化合物与长链烷基类化合物的变化趋势相同,均呈现为:F1中含量最高(分别为:24.47%,4.77%),随后在F2、F3和F4组分中呈减少趋势,在F5中又有所增加,可达到20.18%与4.07%。
脂肪酸是构成生物体有机成分之一,具有高度的生物专一性,可以用来判断沉积物和土壤中有机质的来源[18- 20]。不同来源的脂肪酸具有不同的分布特征。通常,长链饱和脂肪酸(C20—C32)来源于高等植物蜡质部分,最大浓度为C24和C26;短链脂肪酸(C14—C18)主要来源于微生物[18- 20]。从F1到F5组分中,脂肪酸含量呈现减少的趋势,由3.17%减少至1.2%。
芳烃与多环芳烃在5个组分中呈现累积的趋势,其中在F1组分中含量最少(分别为:22.34%与3.05%)。芳烃通常被认为是蛋白质的热解产物[21],可能来源与微生物[22]或者燃烧后的产物[23]。多环芳烃可能来源于脂肪族类化合物在热解反应中的环化反应[24]或者烧焦物质[23]。由于其特殊的化学结构使其具有较强的稳定性,对土壤中的微生物具有抑制作用。
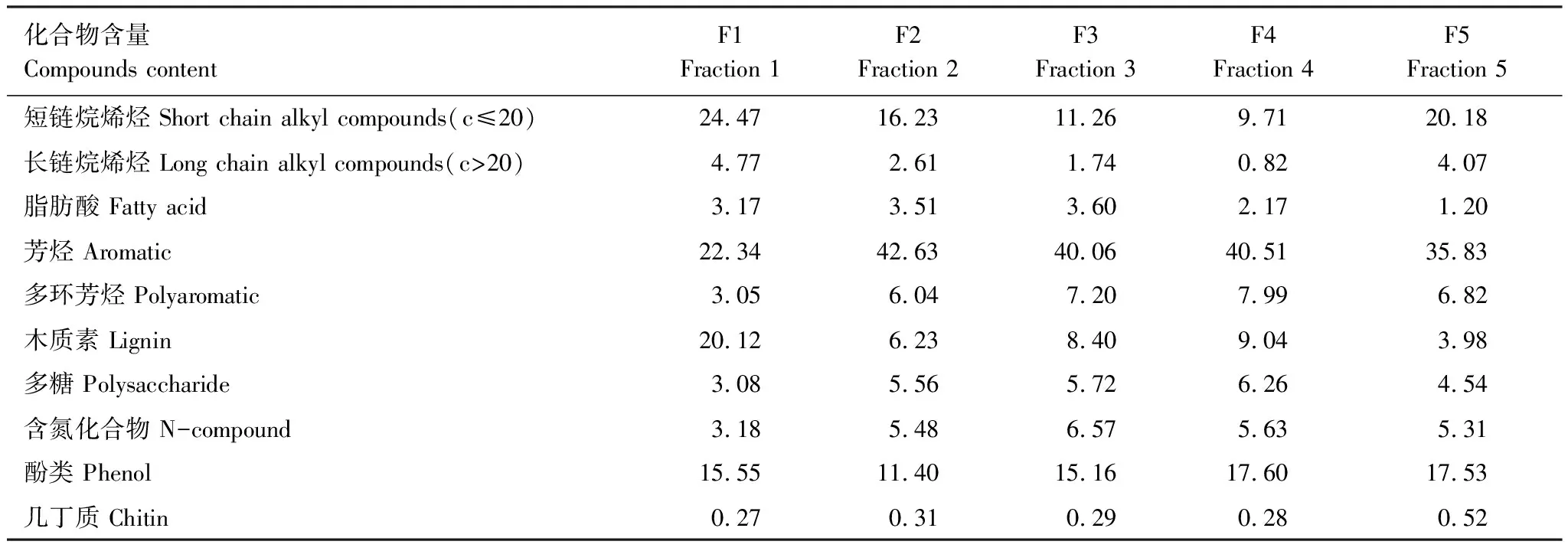
表2 不同密度组分中化合物的百分含量/%
F1:组分1,Fraction 1;F2:组分2,Fraction 2;F3:组分3,Fraction 3;F4:组分4,Fraction 4;F5:组分5,Fraction 5

在热解产物中确定了7种酚类物质,虽然该化合物数量较少,但其相对贡献很大。这类化合物来源于蛋白质、木质素以及纤维素。事实上,酚类物质及木质素大量存在于表层土中,因为在表层土中新鲜枯枝落叶的输入较大,有机质含量相对较高。
单糖和多糖为土壤中主要的碳水化合物。游离的单糖为微生物代谢产生,而且极易被微生物利用,因此这类物质在土壤中的含量极少,所以土壤中的碳水化合物多以多糖的形式存在。土壤中的多糖不仅来源于植物的降解,也来自于微生物的贡献。土壤多糖中的木糖和阿拉伯糖主要来自于植物多糖;而微生物多糖则以葡萄糖、脱氧六碳糖、半乳糖、甘露糖等为主。呋喃、糠醛多来自于埋藏土;这类化合物在土壤中的停留时间较长[27],其原因是这类物质在土壤有机质的分解及腐殖质化的过程中会再次循环利用[6]。在5个组分中,多糖随着密度的增大呈现轻微的积累趋势。
土壤中的含氮化合物包括蛋白质、多肽以及氨基酸。它们在土壤中可以与土壤矿质表面相互作用而使其稳定性增强[28]。肽类物质在土壤矿质表面的吸附特别是与黏粒的强烈吸附使得蛋白质受到保护。理论表明,从砂粒到黏粒级,表面的吸附作用变强,含氮化合物更倾向于在小粒级库中积累。
几丁质衍生的热解产物主要是特殊的含氮化合物的片段。几丁质通常来自于真菌或是节肢动物[29]。在5个组分中,几丁质的含量均较少,少量的几丁质可能来源于节肢动物骨骼的残余物。
2.3 不同密度组分降解难易性的差异
如表3所示,F1—F4组分在土壤中所占比例较少,F5最高为98%,是土壤中主要的组成部分。F1组分含量虽少(0.13%),但其热解有机质的含量却相对较高,可达5.7%。从烷烃与烯烃、多环芳烃与芳烃以及酚类与木质素的比值上看,5个组分呈现增加的趋势,由于烷烃相对较于烯烃、多环芳烃相较于芳烃以及酚类化合物相较于木质素而言,降解难度大,因此使用它们的比值来衡量5个密度组分降解的难易程度。此外,对于短链烷基类化合物(C≤20)与长链烷基类化合物(C>20)的比值而言,前4个组分呈增加趋势,并且大于F5组分。
由于5个组分之间的关系不易直观比较,因此应用主成分分析(Principal Component Analysis,PCA)来比较不同密度组分之间的差别。其中,PC1权重最大,为79.66%,PC2权重次之,为12.64%,二者累积贡献率为92.3%,因此本文只对PC1、PC2进行分析(图2)。分析表明,F2、F3与F4 3个组分性质较为相近,与F1和F5 2个组分有明显差异。
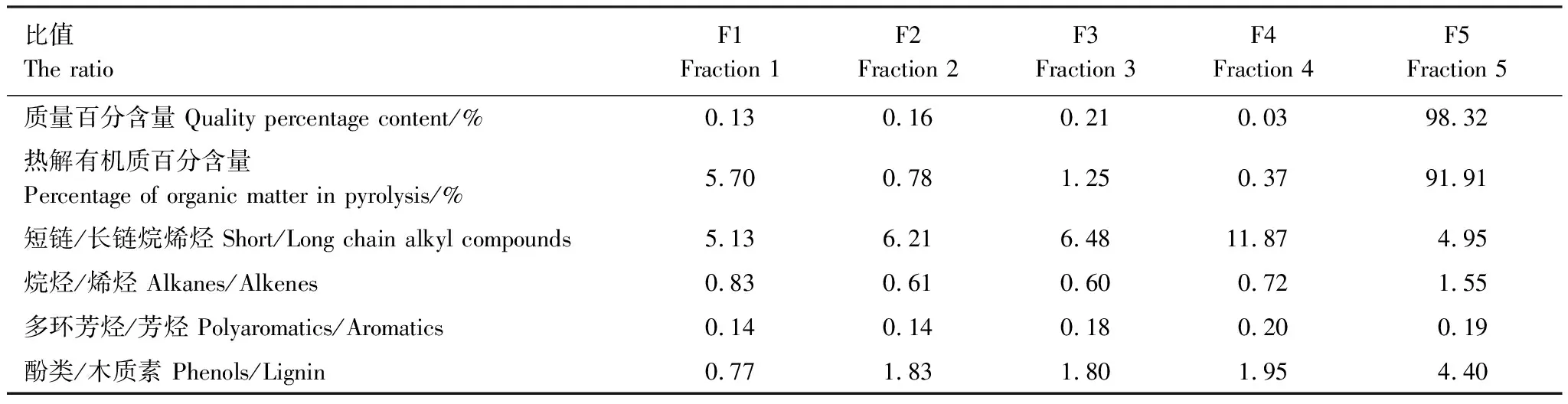
表3 不同密度组分土壤有机质之间差异
烷烃/烯烃:烷烃含量与烯烃含量的比值;短链烷烯烃(n≤20)/长链烷烯烃(n>20):n≤20的烷烯烃含量与n>20的烷烯烃含量比值;多环芳烃/芳烃:多环芳烃含量与芳烃含量的比值;酚类/木质素:酚类含量与木质素含量的比值
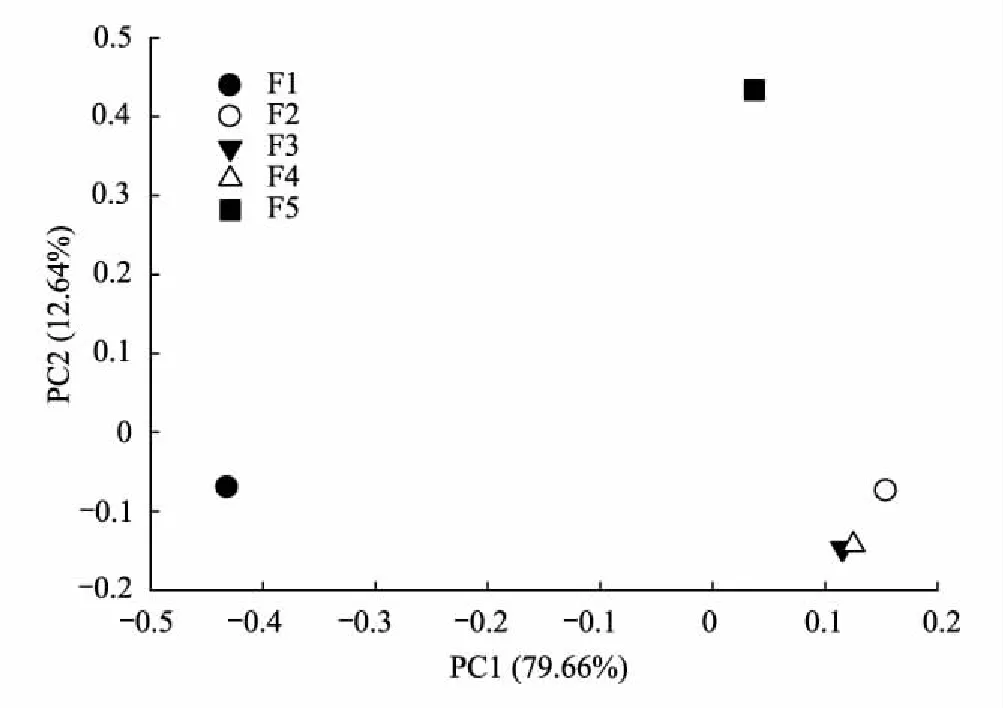
图2 不同密度组分主成分分析(PCA)图Fig.2 Principal components analysis (PCA) of different groups
3 讨论
3.1 五个密度组分之间的差异
本文旨在使用Py-GC-MS/MS技术来研究高寒草原土壤不同密度组分的之间的指纹差异,系统的分析了150种具体化合物的种类与分布。在国内土壤有机质分子领域相关研究开展甚少的情况下,本文所提到的实验方法对研究土壤有机质的来源和降解具有一定的启示意义。首先,从5个组分的总离子流图(图1)中,可以宏观的看出5个组分之间存在一定的差异;随后在主成分分析(图2)中,可进一步观测到,在5个组分中,F2、F3与F4 3者性质更为相近,并且与F1和F5组分之间有较大差异。
5个组分化合物含量的变化呈现以下趋势(表2):(1)木质素及脂肪酸含量的减少;(2)芳烃与多环芳烃的累积,以及(3)多糖与含氮化合物的增加。F1组分主要为植物碎屑,随着土壤密度的增大,植物碎屑逐渐减少,土壤有机质与土壤中的黏粒和粉粒形成复合体,因此木质素的含量呈现逐渐减少的趋势;同时长链脂肪酸多来源于植物,同样呈现减少趋势。有研究表明,短链烷基类化合物来源于微生物或者是在热解过程中由长链烷基类化合物断裂而来,在5个组分中,该类化合物呈现先减少(24.47%—9.71%),随后在F5组分(20.18%)中又增加的趋势,其原因可能为在F1组分中含有较多的植物信息,在热解的过程中该组份中的长链烷基类化合物被断裂为短链烷基类化合物被检测出来,而F5组分本身含有较少的植物物质,因此其中较多的短链烷基类化合物说明该组份本身含有较多的微生物信息。芳烃与多环芳烃在土壤中属于降解难度较大的有机化合物,不仅因为其复杂的分子结构,同时因为在土壤中能分解这两类化合物的微生物含量很少,因此这两类化合物在土壤中会呈现逐渐累积的趋势。如表2所示,芳烃与多环芳烃均呈现为增加趋势,这表明随着土壤密度的增大,难降解的物质逐渐累积,致使F5组分降解难度增大。多糖与含氮化合物在5个组分中呈现逐渐累积的现象,造成该现象的原因可能是随着土壤密度的增大,土壤中微生物的指纹信息逐渐增加。
饱和化学键相对于不饱和化学键、多苯环结构相对于单苯环结构而言降解难度均增大,因此本文旨在用烷烃与烯烃、多环芳烃与芳烃的比值来进一步说明5个组分之间的降解难易性。比值结果显示(表3),烷烃/烯烃与多环芳烃/芳烃在5个组分中均呈现增加的趋势,这也进一步验证了上述提到的随着土壤密度的增加,难降解的物质逐渐增加,降解的难度逐渐增大。同时,酚类化合物主要来源于木质素,是由木质素分解转换而来,在5个组分中酚类与木质素的比值也呈现增加趋势,由此进一步猜测对于F1而言主要为新鲜输入的有机质,而随着密度的增加,新鲜的有机质被进行降解改造,致使最后存在于F5组分中的有机质是经过长期改造而最终形成的稳定复合有机质。
综上所述,F1组分主要由植物碎屑组成,虽然在土壤中含量较少,但是含有较高的有机质成分,这一部分含有较多易降解的物质,但是由于输入到土壤中的时间较短,使其被外界改造的程度较低,属于“较为新鲜的有机质”;F2、F3和F4 3个组分组成相似,可视为同一种组分,该组份的含量及有机质含量均较少,处于有机质被分解转化的过渡阶段,属于被外界“部分改造的有机质”;F5组分是土壤中的主要组成部分,该组份在土壤中存在的时间较长,被外界改造的程度较高,含有较多难降解的物质。对于土壤有机质来说,有3种形式会使其变稳定,第一种:化学过程,例如与金属离子形成沉淀;第二种:生化顽固,即存在不易于被微生物分解的某些结构的化合物;第三种:物理保护,土壤有机质与土壤中的黏粒和粉粒形成复合体,使微生物无法接触到可以降解的有机质从而对土壤有机质进行保护。正是由于被多次的改造,使的F5组分中含有较多的难以被降解的物质,因此该组份属于“深度改造的有机质”。
3.2 高寒草原土壤有机质与其他非高寒土壤有机质之间的差异
研究表明,密度小于2g/cm3土壤通常被称为轻组有机质。这一部分有机质通常占土壤质量的0.03%—8.2%,而有机碳氮的占土壤总有机碳氮的含量高达48%与32%。但不同的土地利用类型差异较大,农田轻组含量较低,为0.18%—2.39%,轻组有机碳占总有机碳的比例为1%—25%;草地和灌木分别为0.13%—8.24%和1.8%—3.2%,轻组有机碳占总有机碳的5%—48%;森林较高,为0.6%—14.7%,轻组有机碳占总有机碳的4%—63%[30]。本文所选用的青藏高原纳木错草原土壤的轻组含量符合上述标准,但有机质含量相对较低,原因可能为该地区具有特殊的生态环境,高海拔与寒冷的温度使其有机质的含量较低。此外,随着近年来全球变暖趋势的日益突出与人类活动的不断加剧,该地区的生态环境受到了极大的影响,使得该地的高寒草甸土壤处于极度退化的阶段,造成有机质流失,含量减少的情况。
4 结论
本实验研究的高寒草原土壤有机质的不同密度组分之间具有一定的差异。首先,在土壤组成方面:F5组分为高寒草原土壤的主要组成部分,含量高达98%;而F1组分虽然在土壤中所占比例较少,但其单位质量有机质含量相对较高。其次,在化合物组成方面:随着土壤密度的增加,木质素含量在F1组分(该组份主要由植物碎屑组成)中含量最高,此后随着密度的增加逐渐减少;芳烃与多环芳烃这类难降解的物质逐渐积累;同时,微生物来源的多糖与含氮化合物也呈现增加的趋势,使得F5组分含有更多的微生物指纹信息。
参考文献(References):
[1] Randall E W, Mahieu N, Powlson D S, Christensen B T. Fertilization effects on organic matter in physically fractionated soils as studied by 13C NMR: Results from two long-term field experiments. European Journal of Soil Science, 2010, 46(4): 557- 565.
[2] Christensen B T. Physical fractionation of soil and organic matter in primary particle size and density separates. //Stewart B A, eds. Advances in Soil Science. New York: Springer, 1992.
[3] Christensen B T. Physical fractionation of soil and structural and functional complexity in organic matter turnover. European Journal of Soil Science, 2001, 52(3): 345-353.
[4] Dalal R C, Mayer R J. Long-term trends in fertility of soils under continuous cultivation and cereal cropping in southern Queensland. II. Total organic carbon and its rate of loss from the soil profile. Australian Journal of Soil Research, 1986, 24(2): 281- 292.
[5] 武天云, Schoenau J J, 李凤民, 钱佩源, Malhi S S. 耕作对黄土高原和北美大草原三种典型农业土壤有机碳的影响. 应用生态学报, 2003, 14(12): 2213- 2218.
[6] Gleixner G, Poirier N, Bol R, Balesdent J. Molecular dynamics of organic matter in a cultivated soil. Organic Geochemistry, 2002, 33(3): 357- 366.
[7] Six J, Elliott E T, Paustian K, Doran J W. Aggregation and soil organic matter accumulation in cultivated and native grassland soils. Soil Science Society of America Journal, 1998, 62(5): 1367- 1377.
[8] Russell A E, Cambardella C A, Ewel J J, Parkin T B. Species, rotation, and life-form diversity effects on soil carbon in experimental tropical ecosystems. Ecological Applications, 2004, 14(1): 47- 60.
[9] Lu Q, Li W Z, Zhang D, Zhu X F. Analytical pyrolysis-gas chromatography/mass spectrometry (Py-GC/MS) of sawdust with Al/SBA- 15 catalysts. Journal of Analytical and Applied Pyrolysis, 2009, 84(2): 131- 138.
[10] Mészáros E, Jakab E, Várhegyi G. TG/MS, Py-GC/MS and THM-GC/MS study of the composition and thermal behavior of extractive components of Robinia pseudoacacia. Journal of Analytical and Applied Pyrolysis, 2007, 79(1): 61- 70.
[11] Irwin W J. Analytical pyrolysis-an overview. Journal of Analytical and Applied Pyrolysis, 1979, 1(1): 3- 25.
[12] Wilkins R W T, George S C. Coal as a source rock for oil: a review. International Journal of Coal Geology, 2002, 50(1/4): 317- 361.
[13] Grandy A S, Neff J C. Molecular C dynamics downstream: The biochemical decomposition sequence and its impact on soil organic matter structure and function. Science of the Total Environment, 2008, 404(2/3): 297- 307.
[14] Zhou Z, Zhang Z, Zha T, Luo Z, Zheng J, Sun O J. Predicting soil respiration using carbon stock in roots, litter and soil organic matter in forests of Loess Plateau in China. Soil Biology and Biochemistry, 2013, 57(3): 135- 143.
[15] 游庆龙, 康世昌, 李潮流, 李茂善, 刘景时. 青藏高原纳木错气象要素变化特征. 气象, 2007, 33(3): 54- 60.
[16] 旦增塔庆, 旭日, 魏学红, 魏达, 刘永稳, 王迎红. 西藏纳木错高寒草原、高寒草甸和沼泽化草甸主要温室气体通量对比研究. 草地学报, 2014, 22(3): 493- 501.
[17] Almendros G, Guadalix M E, González-Vila F J, Martin F. Preservation of aliphatic macromolecules in soil humins. Organic Geochemistry, 1996, 24(6/7): 651- 659.
[18] Feng X, Simpson M J. The distribution and degradation of biomarkers in Alberta grassland soil profiles. Organic Geochemistry, 2007, 38(9): 1558- 1570.
[19] Jandl G, Leinweber P, Schulten H R, Ekschmitt K. Contribution of primary organic matter to the fatty acid pool in agricultural soils. Soil Biology and Biochemistry, 2005, 37(6): 1033- 1041.
[20] Otto A, Simpson M J. Degradation and preservation of vascular plant-derived biomarkers in grassland and forest soils from western canada. Biogeochemistry, 2005, 74(3): 377- 409.
[21] Chiavari G, Galletti G C. Pyrolysis—gas chromatography/mass spectrometry of amino acids. Journal of Analytical and Applied Pyrolysis, 1992, 24(2): 123- 137.
[22] Schulten H R, Plage B, Schnitzer M. A chemical structure for humic substances. Die Naturwissenschaften, 1991, 78(7): 311- 312.
[23] Kaal J, Rumpel C. Can pyrolysis-GC/MS be used to estimate the degree of thermal alteration of black carbon? Organic Geochemistry, 2009, 40(12): 1179- 1187.
[24] Saiz-Jimenez C. Production of alkylbenzenes and alkylnaphthalenes upon pyrolysis of unsaturated fatty acids. Naturwissenschaften, 1994, 81(10): 451- 453.
[25] Bol R, Poirier N, Balesdent J, Gleixner G. Molecular turnover time of soil organic matter in particle-size fractions of an arable soil. Rapid Communications in Mass Spectrometry, 2009, 23(16): 2551- 2558.
[26] Heim A, Schmidt M W I. Lignin turnover in arable soil and grassland analysed with two different labelling approaches. European Journal of Soil Science, 2007, 58(3): 599- 608.
[27] Gleixner G, Bol R, Balesdent J. Molecular insight into soil carbon turnover. Rapid Communications in Mass Spectrometry, 1999, 13(13): 1278- 1283.
[28] Kindler R, Miltner A, Thullner M, Richnow H H, Kästner M. Fate of bacterial biomass-derived fatty acids in soil and their contribution to soil organic matter. Organic Geochemistry, 2009, 40(1): 29- 37.
[29] Stankiewicz B A, Bergen P F V, Duncan I J, Carter J F, Briggs D E, Evershed R P. Recognition of chitin and proteins in invertebrate cuticles using analytical pyrolysis/gas chromatography and pyrolysis/gas chromatography/mass spectrometry. Rapid Communications in Mass Spectrometry, 1996, 10(14): 1747.
[30] Boone R D. Light-fraction soil organic matter: origin and contribution to net nitrogen mineralization. Soil Biology and Biochemistry, 1994, 26(11): 1459- 1468.
