赤杨对辽东落叶松人工林土壤氨基糖积累的影响
2018-06-07井艳丽刘世荣邓继峰刘源跃阎品初苟堪堪
井艳丽,刘世荣 ,2,*,殷 有,邓继峰,刘源跃,阎品初,苟堪堪
1 沈阳农业大学,沈阳 110866 2 中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京 100091
落叶松(Larixspp.)是我国北方重要的用材树种,面积约占东北地区人工林的55%[1]。近年来,长期同龄纯林连栽导致落叶松林地力衰退趋势日益明显[2- 3],直接影响人工林的可持续经营。施用氮肥能够有效改善落叶松林土壤状况,提高林地生产力[4- 5]。然而,化学氮肥的生产和使用不仅消耗大量能源、增加营林成本,还会产生土壤板结等一系列生态问题[6]。研究发现以固氮树种作为伴生种营造混交林能够有效提高土壤肥力[7]、林分生产力[8]和人工林稳定性[9]。因此,通过引入固氮树种来提高林分综合效益,是实现林业可持续发展的重要途径之一。
微生物是土壤养分循环的主要驱动者,也是维持森林生态系统可持续发展的关键因子[10]。固氮树种引入能够为微生物提供生长代谢的养分和能量,促进微生物增殖[11]并影响其群落结构[7,12]。随着活体微生物群落大小及结构的变化,相应地,微生物死亡后积累在土壤中的细胞残留物也会受到影响[13- 14]。这些微生物残留物成为重要的养分中间过渡库,显著影响土壤稳定性有机质的形成和转化[15- 16]。因此,深入了解微生物残留物对营林措施的响应,对于预测和管理森林土壤碳动态具有重要意义。氨基糖是微生物细胞壁的组成部分,具有较高的稳定性,可以作为微生物残留物的标识物来指示微生物来源的碳、氮去向,阐明微生物对土壤有机碳的贡献[17]。在已经定量的氨基糖单体中,氨基葡萄糖(Glucosamine,GluN)主要来自真菌,胞壁酸(Muramic acid,MurN)唯一来自细菌,氨基半乳糖(Galactosamine,GalN)和甘露糖胺(Mannosamine,ManN)的来源还不确定[17- 19]。由于氨基糖具有异源性,因此常用氨基葡萄糖/胞壁酸比值指示真菌和细菌对土壤有机碳的相对贡献[14,20]。研究表明氮肥添加促进森林土壤氨基糖的积累[21],改变真菌残留物对有机碳的贡献[22]。然而,长期固氮树种引入对土壤氨基糖含量的影响研究未见报道。本研究以辽东山区落叶松纯林及其与非豆科固氮树种赤杨的混交林为研究对象,探讨赤杨引入对混交林中落叶松根际、非根际土壤氨基糖积累特征的影响,揭示氨基糖含量与土壤环境之间的关系,以期为深入了解土壤有机质形成和稳定的微生物作用机制奠定理论基础,为落叶松人工林合理经营提供依据。
1 材料与方法
1.1 研究区概况
试验区位于辽宁省本溪市清原满族自治县草河口镇内的辽宁省森林经营研究所实验林场(123°34′53″—125°45′42″E, 40°48′50″—41°33′50″N)。该地区属于温带大陆性季风气候,年平均温度为6.1℃,年降雨量为926.3mm,主要集中在6—8月份,无霜期为124—144d。土壤以暗棕色森林土为主,土壤质地多为粉砂壤质,pH值为5.5—6.2。植被属于长白植物区系。现有森林以天然次生林为主,人工林主要是日本落叶松(Larixkaempferi)、油松(P.tabuliformis)、红松(P.koraiensis)等针叶林。林下灌木主要有忍冬(Loniceraaltamanni)、毛榛子(Corylusmandshurica)、卫矛(Euonyrnusalatus)等;草本主要有蕨(Pteridiumspp.)、黄花蒿(Herbaartemisiae)、蚊子草(Filipendulapalmata)等。
1.2 样地设置及样品采集
2016年7月全面调查林分情况,选择立地条件及管理措施相近的日本落叶松纯林和落叶松-赤杨带状混交林(落叶松∶赤杨=7∶3)样地各3块(表 1),样地面积为 20m×30m。在纯林内选择 3 株落叶松标准木,在混交林内选择落叶松和赤杨标准木各3 株。在每一株标准木的周围按照不同方位设置4个采样点,挖出细根并采用抖落法采集根际土壤的混合样品。在各样地内沿“S”形采集 0—10cm的非根际土壤的混合样品。所采集到的土壤样品带回实验室,过2mm筛,拣出肉眼可见的植物残体、根系、石块等,室温风干,用于土壤化学性质和氨基糖的测定。
1.3 分析方法
土壤有机碳(SOC)和全氮(TN)采用元素分析仪测定(Heraeus Elementar Vario EL, Hanau,Germany);土壤pH 值用pH计测定;全磷(TP)采用浓硫酸消煮-钼锑抗比色法测定;有效磷采用碳酸氢纳浸提法;碱解氮采用碱解扩散法测定[23]。微生物群落结构采用磷脂脂肪酸法(PLFAs)测定,其中细菌群落用14:00,14:0iso,15:0iso,15:0anteiso,16:00,16:0iso,17:0iso,17:0anteiso,16:1ω7c,17:00,17:0cyclo,18:1ω7c,19:0cyclo指示[24],真菌用18:1ω9c,18:2ω6c,16:1ω5c指示[25]。土壤氨基糖含量采用糖腈乙酰酯衍生气相色谱法测定[26]。具体步骤如下:将0.3mg N的风干土放入水解瓶内,105℃盐酸水解8h后,冷却至室温。水解瓶加入100μL的肌醇,振荡摇匀后过滤。滤液用旋转蒸发仪蒸干,残余物用蒸馏水溶解,并用 KOH调节 pH 至 6.6—6.8,然后离心(3000r/min)。上清液用冷冻干燥仪冻干,残余物用甲醇溶解并再次离心(3000r/min)。上清液转移到衍生瓶中,用氮气吹干(45℃)加入1mL水和100μL N-甲基氨基葡萄糖,冷冻干燥后进行氨基糖的糖腈乙酰酯衍生。衍生物用用乙酸乙酯-正己烷溶解,转移到色谱瓶中,进行气相色谱测定 (GC- 7890B, Agilent, USA, HP- 5 毛细管色谱柱30m×0.25mm×0.25μm) 。

表1 样地基本情况
1.4 土壤中氨基糖含量的计算
氨基糖的计算公式为:
m=miAx/AiRf
(1)
式中,mi为添加的肌醇质量;Ax和Ai分别为样品测定中氨基糖和肌醇的峰面积;Rf为每种氨基糖的相对校正因子,利用标准样品中氨基糖和肌醇的校正因子计算。
1.5 数据处理
采用SPSS 16.0进行ANOVA 方差分析及多重比较(LSD)。采用Origin 8.5制图,用Canoco 4.5分析氨基糖与环境因子间的关系。
2 结果与分析
2.1 土壤性质
由表2可以看出,根际土壤有机碳、全氮、速效磷、碱解氮和微生物生物量高于非根际土,然而根际作用对C/N、土壤pH值、全磷和真菌/细菌无显著影响。赤杨引入对土壤有机碳、全氮、C/N、土壤pH值、速效磷、碱解氮和微生物生物量影响显著。混交林落叶松根际土壤有机碳、全氮和微生物生物量比纯林分别高出74.1%、93.4%和52.4%,非根际分别高出45.6%、125.2%和58.2%。林分类型对土壤全磷和真菌/细菌影响不显著。赤杨土壤pH值显著低于混交林中的落叶松,但二者之间其他土壤性质无显著差异。
2.2 氨基糖含量
由图1可知,不同处理下根际氨基葡萄糖、胞壁酸和氨基半乳糖的变化范围分别为1099.5—2193.3、80.6—141.7、361.1—920.4 mg/kg;非根际的变化范围分别为488.9—1320.9、20.1—65.2、218.6—585.2mg/kg。赤杨引入显著促进根际及非根际各氨基糖单体含量。其中,与纯林相比,混交林落叶松根际及非根际土壤氨基糖葡萄糖含量分别高出99.5%(P<0.01)和154%(P<0.01)。胞壁酸变化趋势与氨基葡萄糖一致,其中混交林落叶松根际和非根际土壤胞壁酸比纯林分别高出66.1%(P<0.01)和132.3%(P<0.01)。然而,混交林落叶松和赤杨之间各氨基糖单体含量均无显著差异。

表2 不同林分类型根际与非根际土壤性质
纯落代表纯林中的落叶松;混落代表混交林中的落叶松;混赤代表混交林中的赤杨;数据代表平均值±标准误(n=3);不同大写字母代表林分之间差异显著,不同小写字母代表根际与非根际之间差异显著(P<0.05)
氨基糖具有异源性,因此氨基葡萄糖/胞壁酸比值可以用来指示真、细菌对土壤有机质转化过程中的相对贡献。由图2可知,不同处理下根际氨基葡萄糖/胞壁酸比值的变化范围为13.7—16.4,非根际的变化范围为17.8—21.7。赤杨引入对根际及非根际氨基葡萄糖/胞壁酸影响不显著。不同处理下氨基糖对土壤有机碳的贡献变化范围为39.4—61.9mg/g,混交林根际及非根际氨基糖对土壤有机碳的贡献均显著高于纯林(图3)。
2.3 非生物因子对氨基糖的影响
冗余分析能够确定非生物因子对土壤氨基糖的影响程度。对根际和非根际土壤氨基糖进行了冗余分析(图4),结果表明,土壤氨基糖与土壤有机碳、全氮和碱解氮含量呈正相关关系,但全氮是影响氨基糖的最主要因子(P<0.01)。第一排序轴和第二排序轴分别解释了氨基糖含量99.7% 和0.3%变异。
3 讨论
3.1 赤杨对土壤性质的影响
以往研究发现,固氮树种引入提高林地土壤碳氮的截获潜力[7]。这与本研究结果一致,说明赤杨引入改善了落叶松人工林土壤的养分状况。在温带森林生态系统,氮是限制植物生长的关键因子。因此,固氮树种引入可能缓解了土壤-植物的氮限制,提高植物净生产力[27],增加凋落物产量[7,28];同时,固氮树种较高的落叶含氮量能够促进凋落物中养分的释放[29],从而提高土壤微生物的活性(表2)并最终增加土壤碳氮的固持。我们还发现混交林中落叶松和赤杨之间的土壤养分含量差异不显著(表2),这可能是因为落叶松能够通过直接接触赤杨根系[30]或间接利用赤杨凋落物分解释放的物质[8]获得养分。
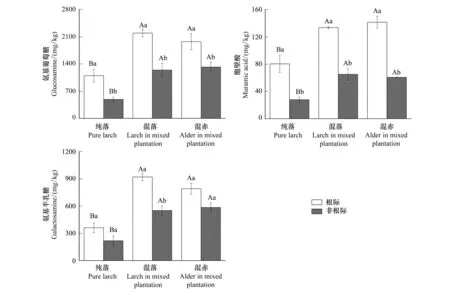
图1 不同林分下根际和非根际土壤氨基葡萄糖、胞壁酸和氨基半乳糖含量Fig.1 The contents of glucosamine, muramic acid and galactosamine in rhizosphere and non-rhizosphere soils of different stand types数据代表平均值±标准误(n=3);不同大写字母代表林分之间差异显著,不同小写字母代表根际与非根际之间差异显著(P<0.05)

图2 不同林分下根际和非根际氨基葡萄糖/胞壁酸比值 Fig.2 The glucosamine/muramic acid ratio in rhizosphere and non-rhizosphere soils of different stand types数据代表平均值±标准误(n=3);不同大写字母代表林分之间差异显著,不同小写字母代表根际与非根际之间差异显著(P<0.05)
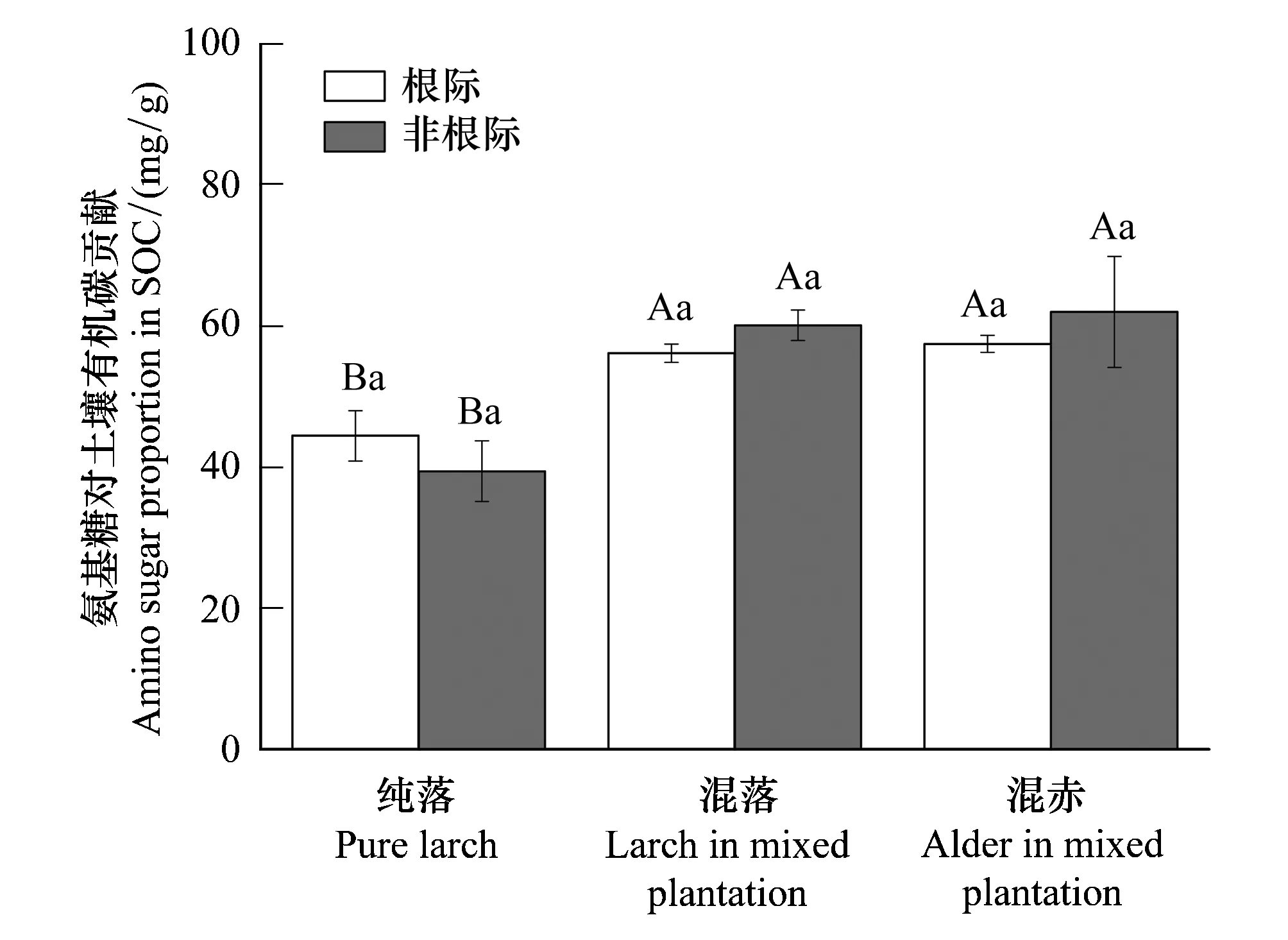
图3 不同林分下根际和非根际氨基糖对土壤有机碳的贡献 Fig.3 The amino sugar proportion in SOC in rhizosphere and non-rhizosphere soils of different stand types数据代表平均值±标准误(n=3);不同大写字母代表林分之间差异显著,不同小写字母代表根际与非根际之间差异显著(P<0.05)
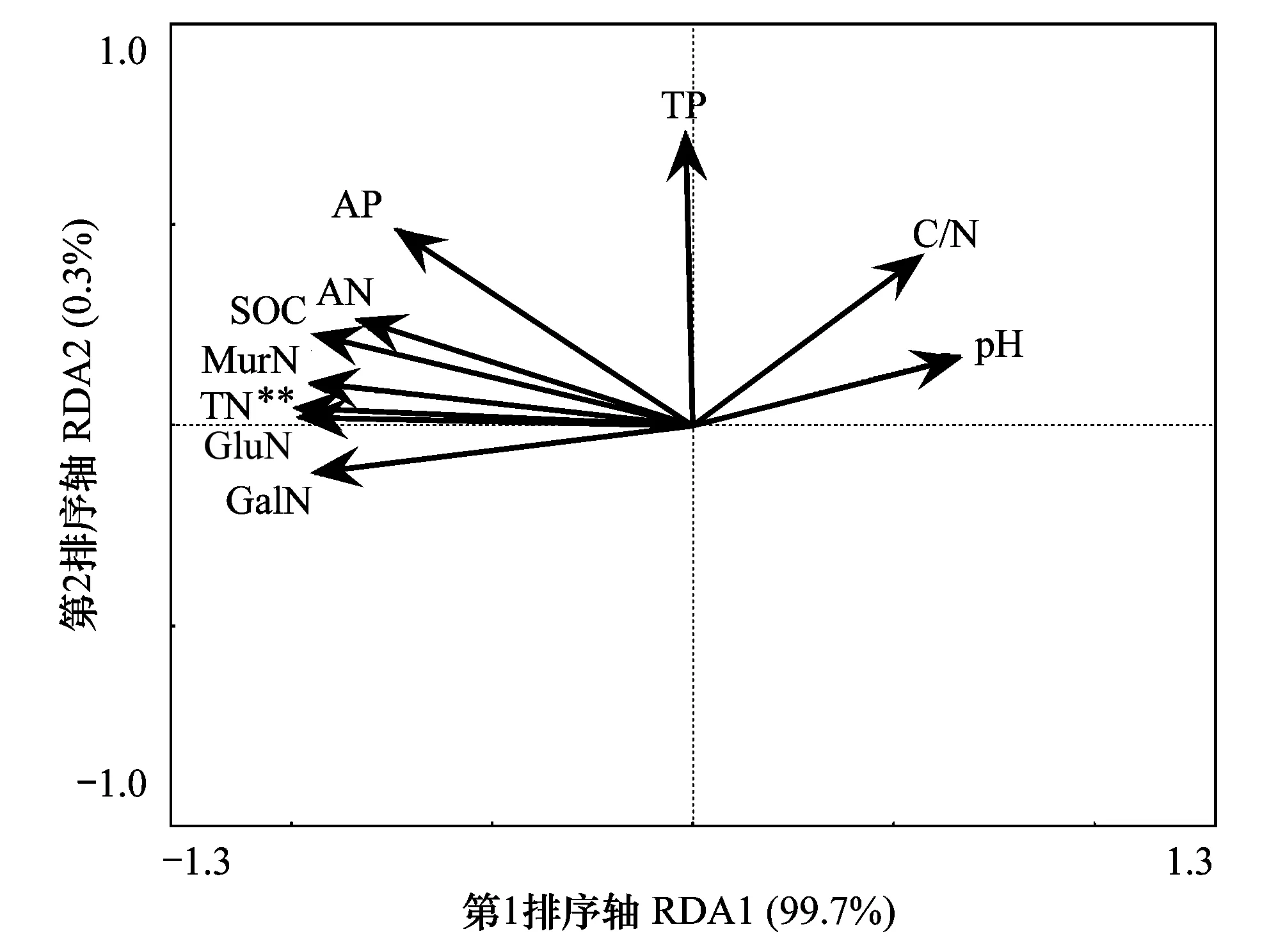
图4 落叶松纯林和落叶松-赤杨混交林土壤氨基糖的冗余分析 Fig.4 Redundancy analysis of amino sugars in pure larch plantation and a mixed larch and alder plantation soils**代表P<0.01; 土壤有机碳,SOC;全氮,TN;土壤C/N比,C/N;全磷,TP;速效磷,AP;碱解氮,AN
本研究中,纯林土壤pH值明显高于混交林(表2),说明赤杨引入加剧了落叶松人工林的土壤酸化程度。许多学者对固氮树种的研究得出一致的结论[31- 32]。造成这种现象的原因可能是一方面固氮树种的引入增强了土壤的硝化作用[33],产生了更多的H+。另一方面,固氮树种增加土壤硝态氮含量[7],导致淋溶过程中其带走的盐基阳离子也增加[34]。本研究土壤为粉砂壤质地,可能进一步加剧了盐基阳离子的损失。
3.2 赤杨对土壤氨基糖含量与比值的影响
本研究发现,纯林根际土壤氨基葡萄糖和胞壁酸含量显著高于非根际土。产生这种现象的原因主要是由于根际土壤微生物生物量高于非根际(表2)。根际作用对微生物生物量的影响与前人研究结果一致[35]。不同树种具有独特的微生物残留物积累特征[36- 37],因此固氮树种引入可能对土壤微生物残留物具有重要影响。本研究发现,落叶松混交林土壤中氨基糖单体含量均显著高于纯林(图1),说明赤杨引入有利于土壤中微生物残留物的积累。以往研究发现,当土壤中养分缺乏时,氨基糖会作为碳源或氮源被微生物利用[17,22];反之,则促进氨基糖在土壤中的积累[13,38]。本研究中赤杨引入增加了土壤的碳源和氮源(表2),进而增加微生物生物量是促进氨基糖积累的主要原因。此外,研究还发现赤杨对落叶松非根际土氨基糖的促进作用明显高于根际土,表明赤杨引入对养分较差的土壤中微生物残留物促进作用更强。类似地,李丽东等[39]研究结果也发现,秸秆添加后,氨基糖在低有机质土壤中的增加幅度高于高有机质土壤。这可能是因为与根际土高的可利用性氮相比,非根际土的氮限制更为强烈(表2),因此赤杨引入对非根际土的微生物活性和周转影响更大。冗余分析结果表明全氮是影响氨基糖的最重要因子(图4),也从另一个角度支持了这一结果。
此外,纯林与混交林之间的氨基葡萄糖/胞壁酸比值差异不显著(图2),说明赤杨引入对落叶松林土壤中真菌和细菌的相对贡献影响较小,真菌和细菌的残留物积累处于相对平衡的状态。Zhang等[22]发现11年高氮添加(150kg N hm-2a-1)抑制氨基葡萄糖/胞壁酸比值,而低氮(50kg N hm-2a-1)对其无影响。因此,本研究结果暗示当前赤杨引入强度(落叶松∶赤杨为7∶3)可能尚处于低氮添加水平。氨基糖转化和积累过程受可利用碳和矿质营养影响[17,40],其比值反映了时间尺度的微生物群落动态[41]。因此,今后研究中利用同位素标记技术,同步观测氨基糖与微生物群落结构随时间的变化动态将有利于深入了解固氮树种影响土壤氨基葡萄糖/胞壁酸比值的机制。
作为土壤稳定性碳库的重要组成部分,氨基糖在长期碳固持中扮演重要作用[14,41]。与纯林相比,混交林中高的氨基糖对土壤有机碳的贡献(图3)说明赤杨引入显著提高落叶松林土壤有机碳的稳定性。尽管赤杨同时增加了土壤有机碳以及氨基糖含量,然而非根际土壤有机碳的增加幅度显著高于氨基糖增加幅度(P<0.01),说明植物来源有机碳稀释了非根际土壤有机碳中氨基糖浓度。然而,这种稀释作用并未存在于根际土,可能是因为作为固氮植物根瘤菌产生的信号物质的组成部分及构建植物-根瘤菌共生关系的必要成分[13],氨基糖通过地下过程传递到落叶松根际。
4 结论
赤杨引入促进落叶松土壤中各氨基糖单体的积累,其中对非根际氨基葡萄糖和胞壁酸的促进作用大于非根际土。赤杨引入不影响土壤中真菌和细菌残留物积累的相对贡献,但显著促进氨基糖对土壤有机碳的贡献。本研究认为,赤杨引入改善土壤养分状况,特别是氮素含量,是促进混交林微生物残留物积累的重要原因。因此,以提高林地肥力、增汇减排为目的进行辽东山区人工造林时,可以重点考虑引入赤杨,但要预防其引起的土壤酸化问题。
参考文献(References):
[1] 梅莉, 张卓文, 谷加存, 全先奎, 杨丽君, 黄冬. 水曲柳和落叶松人工林乔木层碳、氮储量及分配. 应用生态学报, 2009, 20(8): 1791- 1796.
[2] Yang K, Zhu J J, Yan Q L, Zhang J X. Soil enzyme activities as potential indicators of soluble organic nitrogen pools in forest ecosystems of Northeast China. Annals of Forest Science, 2012, 69(7): 795- 803.
[3] 白小芳, 徐福利, 王渭玲. 我国落叶松人工林地力衰退与施肥研究综述. 世界林业研究, 2016, 29(1): 75- 79.
[4] 吉艳芝, 冯万忠, 张笑归. 施肥对落叶松人工林林地土壤肥力的可持续性的影响. 生态环境, 2004, 13(3): 376- 378.
[5] 刘修元, 杜恩在, 徐龙超, 沈海花, 方精云, 胡会峰. 落叶松原始林树木生长对氮添加的响应. 植物生态学报, 2015, 39(5): 433- 441.
[6] 陈奋飞, 庄捷, 王逸群, 陈岩松, 吴若菁. 我国林木固氮的研究现状和前景展望. 湖南林业科技, 2006, 33(4): 4- 7.
[7] Huang X M, Liu S R, Wang H, Hu Z D, Li Z G, You Y M. Changes of soil microbial biomass carbon and community composition through mixing nitrogen-fixing species withEucalyptusurophyllain subtropical China. Soil Biology and Biochemistry, 2014, 73(6): 42- 48.
[8] Forrester D I, Bauhus J, Cowie A L, Vanclay J K. Mixed-species plantations ofEucalyptuswith nitrogen-fixing trees: a review. Forest Ecology and Management, 2006, 233(2/3): 211- 230.
[9] 吴高潮, 王晓娟, 吕宁. 固氮树种在混交林中的作用. 福建林业科技, 2006, 33(3): 175- 177.
[10] Wardle D A, Bardgett R D, Klironomos J N, Setälä H, Putten W H V D, Wall D H. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629- 1633.
[11] Selmants P C, Hart S C, Boyle S I, Stark J M. Red alder (Alnusrubra) alters community-level soil microbial function in conifer forests of the Pacific Northwest, USA. Soil Biology and Biochemistry, 2005, 37(10): 1860- 1868.
[12] Allison S D, Nielsen C, Hughes R F. Elevated enzyme activities in soils under the invasive nitrogen-fixing treeFalcatariamoluccana. Soil Biology and Biochemistry, 2006, 38(7): 1537- 1544.
[13] Schmidt J, Fester T, Schulz E, Michalzik B, Buscot F, Gutknecht J. Effects of plant-symbiotic relationships on the living soil microbial community and microbial necromass in a long-term agro-ecosystem. Science of the Total Environment, 2017, 581- 582: 756- 765.
[14] Liang C, Kao-Kniffin J, Sanford G R, Wickings K, Balser T C, Jackson R D. Microorganisms and their residues under restored perennial grassland communities of varying diversity. Soil Biology and Biochemistry, 2016, 103: 192- 200.
[15] Simpson A J, Simpson M J, Smith E, Kelleher B P. Microbially derived inputs to soil organic matter: are current estimates too low? Environmental Science and Technology, 2007, 41(23): 8070- 8076.
[16] Kögel-Knabner I, Guggenberger G, Kleber M, Kandeler E, Kalbitz K, Scheu S, Eusterhues K, Leinweber P. Organo-mineral associations in temperate soils: integrating biology, mineralogy, and organic matter chemistry. Journal of Plant Nutrition and Soil Science, 2008, 171(1): 61- 82.
[17] He H B, Zhang W, Zhang X D, Xie H T, Zhuang J. Temporal responses of soil microorganisms to substrate addition as indicated by amino sugar differentiation. Soil Biology and Biochemistry, 2011, 43(6): 1155- 1161.
[18] Guggenberger G, Frey S D, Six J, Paustian K, Elliott E T. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems. Soil Science Society of America Journal, 1999, 63(5): 1188- 1198.
[19] Amelung W, Kimble J M, Samson-Liebig S, Follett R F. Restoration of microbial residues in soils of the conservation reserve program. Soil Science Society of America Journal, 2001, 65(6): 1704- 1709.
[20] Engelking B, Flessa H, Joergensen R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil. Soil Biology and Biochemistry, 2007, 39(8): 2111- 2118.
[21] 崔艳荷, 张威, 何红波, 解宏图, 张旭东. 外源氮素添加对森林土壤氨基糖转化的影响. 生态学杂志, 2016, 35(4): 960- 965.
[22] Zhang W, Cui Y H, Lu X K, Bai E, He H B, Xie H T, Liang C, Zhang X D. High nitrogen deposition decreases the contribution of fungal residues to soil carbon pools in a tropical forest ecosystem. Soil Biology and Biochemistry, 2016, 97: 211- 214.
[23] 陈涛, 常庆瑞, 刘京, 齐雁冰, 刘梦云. 黄土高原南麓县域耕地土壤速效养分时空变异. 生态学报, 2013, 33(2): 554- 564.
[24] Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils, 1999, 29(2): 111- 129.
[25] Vestal J R, White D C. Lipid analysis in microbial ecology: quantitative approaches to the study of microbial communities. Bioscience, 1989, 39(8): 535- 541.
[26] Zhang X D, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils. Soil Biology and Biochemistry, 1996, 28(9): 1201- 1206.
[27] Malcolm G M, Bush D S, Rice S K. Soil nitrogen conditions approach preinvasion levels following restoration of nitrogen-fixing black locust (Robiniapseudoacacia) stands in a pine——oak ecosystem. Restoration Ecology, 2008, 16(1): 70- 78.
[28] 李志安, 林永标, 彭少麟. 华南人工林凋落物养分及其转移. 应用生态学报, 2000, 11(3): 321- 326.
[29] 李艳红, 罗承德, 杨万勤, 胡杰, 吴福忠. 桉-桤混合凋落物分解及其土壤动物群落动态. 应用生态学报, 2011, 22(4): 851- 856.
[30] He X H, Critchley C, Bledsoe C. Nitrogen transfer within and between plants through common mycorrhizal networks (CMNs). Critical Reviews in Plant Sciences, 2003, 22(6): 531- 567.
[31] Rhoades C, Binkley D. Factors influencing decline in soil pH in HawaiianEucalyptusandAlbiziaplantations. Forest Ecology and Management, 1996, 80(1/3): 47- 56.
[32] Jensen E S, Hauggaard-Nielsen H. How can increased use of biological N2fixation in agriculture benefit the environment? Plant and Soil, 2003, 252(1): 177- 186.
[33] Rice S K, Westerman B, Federici R. Impacts of the exotic, nitrogen-fixing black locust (Robiniapseudoacacia) on nitrogen-cycling in a pine——oak ecosystem. Plant Ecology, 2004, 174(1): 97- 107.
[34] Qian C, Cai Z C. Leaching of nitrogen from subtropical soils as affected by nitrification potential and base cations. Plant and Soil, 2007, 300(1/2): 197- 205.
[35] 邱权, 李吉跃, 王军辉, 王宁, 孙奎, 何茜, 苏艳, 潘昕. 西宁南山4种灌木根际和非根际土壤微生物、酶活性和养分特征. 生态学报, 2014, 34(24): 7411- 7420.
[36] Ding X L, Zhang B, Lü X X, Wang J K, Horwath W R. Parent material and conifer biome influence microbial residue accumulation in forest soils. Soil Biology and Biochemistry, 2017, 107: 1- 9.
[37] Liang C, Fujinuma R, Wei L P, Balser T C. Tree species-specific effects on soil microbial residues in an upper Michigan old-growth forest system. Forestry, 2007, 80(1): 65- 72.
[38] Zhang B, Liang C, He H B, Zhang X D. Variations in soil microbial communities and residues along an altitude gradient on the northern slope of Changbai mountain, China. PLoS One, 2013, 8(6): e66184.
[39] 李丽东, 胡国庆, 赵钰, 刘肖, 丁雪丽, 何红波, 张旭东. 玉米秸秆掺入对土壤氨基糖分布动态的影响. 土壤通报, 2014, 45(6): 1402- 1409.
[40] Liu X, Hu G Q, He H B, Liang C, Zhang W, Bai Z, Wu Y Y, Lin G F, Zhang X D. Linking microbial immobilization of fertilizer nitrogen toinsituturnover of soil microbial residues in an agro-ecosystem. Agriculture, Ecosystems and Environment, 2016, 229: 40- 47.
[41] Glaser B, Turrión M B, Alef K. Amino sugars and muramic acid——biomarkers for soil microbial community structure analysis. Soil Biology and Biochemistry, 2004, 36(3): 399- 407.
