苦参素对大鼠脑缺血后脑线粒体损伤保护作用的研究*
2018-06-02韩亚非
余 婷 韩亚非
(1.河北省邯郸市中医院,河北 邯郸 056001;2.河北省邯郸市中心医院,河北 邯郸056001)
随着人口老龄化的加剧以及高血压、高血脂等基础疾病发病率的升高,缺血性脑血管病已逐渐发展成为致残和死亡的主要疾病之一,病理生理学研究发现能量耗竭及氧自由基代谢障碍是缺血性脑损伤的主要病理机制[1-4]。线粒体为能量代谢及自由基产生的主要场所,而线粒体又是缺血性脑损伤主要亚细胞器靶目标。
中药苦参为豆科苦参属多年生落叶亚灌木植物苦参(Sophora flavescens Ait.)的根;其味苦、性寒,具有清热燥湿、利水退黄、祛风杀虫之功效,为我国传统中药品种之一,《本草纲目》《神农本草经》等均有记载。苦参素(Oxymatrine)是从中药苦参中提取的一种喹诺西啶类生物碱,是其主要有效成分之一,现代药学研究发现苦参素具有抗炎、抗细胞凋亡等多种生物学活性[5-6]以及扩张血管、改善微循环等药理学作用[7]。本实验以线粒体为研究对象,进一步探讨苦参素对缺血性脑血管病的保护作用。
1 材料与方法
1.1 实验动物
清洁级SD大鼠(雌雄不限)100只,体质量250~300 g,购自河北省实验动物中心,动物许可证号:SCXK(冀)2013-1-003,饲养环境:恒温 23~25 ℃、相对湿度65%~70%、光照周期12 h∶12 h。适应性饲养1周后进行实验。
1.2 试药与仪器
苦参素购自南京泽朗医药科技有限公司(批号:20170114);线粒体分离试剂盒购自碧云天生物技术研究所(批号:20170124);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,丙二醛(MDA)含量,钠钾 ATP 酶(Na+-K+-ATPase)、钙镁 ATP 酶(Ca2+-Mg2+-ATPase)试剂盒和考马斯亮蓝蛋白测定试剂盒购自南京建成生物工程研究所(批号:20170309、20170413、20161207、20161128、20170316、20161125)。 UV-1206型紫外分光光度计(日本SHIMODZU);透射电子显微镜(美国FEI公司)。
1.3 干预方法
1)分组与模型制备:取100只试验用大鼠按照随机数字表法随机分为假手术组、模型组和苦参素低(25 mg/kg)、中(50 mg/kg)、高(100 mg/kg)剂量组,每组20只。参照缪培等[8]报道的试验方法,采用线栓法阻断大脑中动脉制备局灶性脑缺血再灌注大鼠模型,假手术组行手术操作但不插入栓线。各组大鼠均于术前10 min腹腔注射给药,假手术组和模型组给予生理盐水。 2)线粒体的制备[9]:脑缺血 24 h后,实施麻醉、断头取脑,分离缺血侧大脑组织,置于预冷(4℃)的组织裂解液中,制备10%脑组织匀浆液,3000 r/min低温(4℃)离心5 min后取上清液,12000 r/min低温(4℃)离心10 min后,弃上清液取沉淀,即为线粒体,考马斯亮蓝测定蛋白含量。
1.4 标本采集与检测
1.4.1 线粒体肿胀程度的测定 取线粒体加入缓冲液(250 mmol/L 蔗糖、5 mmol/L KH2PO4、3 mmol/L 琥珀酸钠,调节pH7.2)中,制备线粒体蛋白0.25 g/L悬液;混匀后,通过紫外-可见分光光度计测定520 nm处的吸光度值(A),A与膜肿胀程度呈反比关系,即A越小则表示线粒体肿胀程度越严重。
1.4.2 线粒体膜流动性测定 采用荧光偏振度法[10]:取“1.3”项下“线粒体制备”中留出的不去上清液的部分制备线粒体蛋白1.00 g/L悬液,取1 mL线粒体悬液加入3 mL二苯基己三烯溶液(2 μmol/L),25℃温水浴30 min后测定荧光偏振度(K)(激发波长362 nm,发射波长 432 nm),微黏度(η)=2K(0.46-K);膜流动性用荧光偏振度(K)、微黏度(η)表示,微黏度越大,膜流动性越小。
1.4.3 线粒体呼吸功能的测定 采用改良Clark氧电极法[11]取1 mg蛋白量线粒体加入2.5 mL反应介质中(225 mmol/L 甘露醇,75 mmol/L 蔗糖,10 mmol/L KCl,20 mmol/L Tirs-HCI,3 mmol/L 磷酸盐缓冲液,0.1 mmol/L EDTA,调pH7.4),30℃恒温孵育1 min后加入20 μL底物(NAD链为5 mmol/L谷氨酸+5 mmol/L苹果酸;FAD链为5 mmol/L唬拍酸),然后描记呼吸曲线。2 min后加人 10 μL 腺苷二磷酸(ADP,45 mmol/L),连续描记Ⅲ态(R3)快速耗氧及ADP完全磷酸化后的Ⅳ态(R4)耗氧曲线,R3、R4耗氧速率比值为呼吸控制率(RCR)。
1.4.4 线粒体超微结构观察 取1 mm×1 mm×1 mm缺血侧脑组织置于2.5%戊二醛溶液进行固定6 h后,置于1%锇酸进行后固定1 h,行梯度乙醇脱水、环氧树脂包埋、切片(厚度约70 nm)、醋酸铀浸泡、枸橼酸铅染色、冲洗、干燥处理后,通过透射电镜观察各组大鼠缺血侧脑线粒体超微结构。
1.4.5 线粒体内 SOD、GSH-Px、Na+-K+-ATPase、Ca2+-Mg2+-ATPase活性和MDA含量的测定 取线粒体加入适量冷裂解液,用超声波仪破碎线粒体,然后严格按各试剂盒操作说明,依次测定线粒体内SOD、GSH-Px、Na+-K+-ATPase、Ca2+-Mg2+-ATPase活性和MDA含量。
1.4.6 线粒体内游离 Ca2+测定 参照Xi T等[12]报道的原子化学发光法测定各组大鼠缺血侧脑组织线粒体内游离Ca2+(以CaCO3为标准)。
1.5 统计学处理
应用SPSS13.0统计软件分析。计量资料以(±s)表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠脑缺血后脑线粒体肿胀程度比较
见表1。与假手术组比较,模型组脑缺血大鼠缺血侧脑线粒体A520显著降低(P<0.01),提示线粒体肿胀程度显著升高;而与模型组比较,苦参素中、高剂量组脑缺血大鼠A520显著升高(P<0.05或P<0.01),提示缺血侧脑线粒体肿胀程度显著降低。
2.2 各组大鼠脑缺血后脑线粒体膜流动性比较
见表1。与假手术组比较,模型组脑缺血大鼠缺血侧脑线粒体荧光偏振度(K值)、微黏度(η值)显著升高(P<0.01),提示脑线粒体膜流动性明显降低;而与模型组比较,苦参素中、高剂量组脑缺血大鼠缺血侧脑线粒体K值、η值显著降低(P<0.05或P<0.01),提示苦参素具有提高脑缺血大鼠缺血侧脑线粒体膜流动性的作用。
表1 各组大鼠脑缺血后脑线粒体肿胀程度、膜流动性比较(±s)
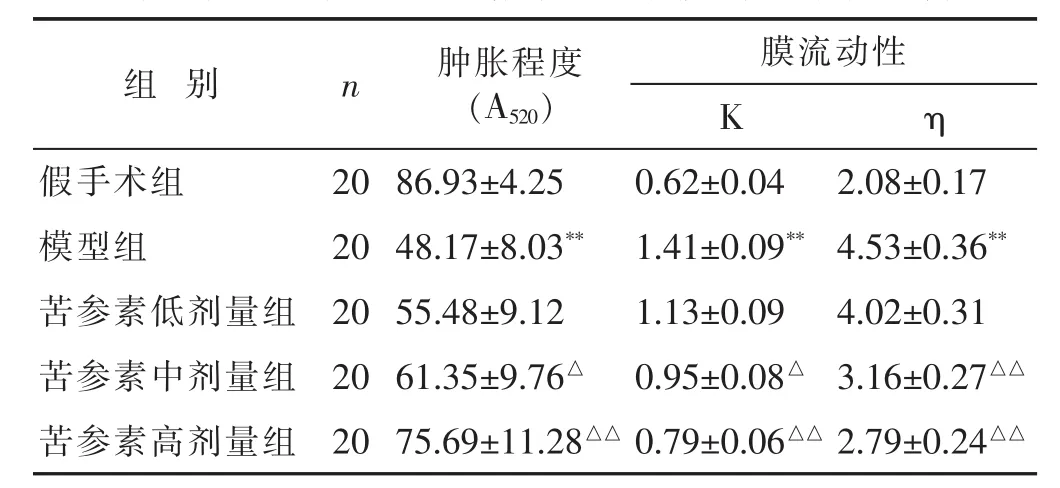
表1 各组大鼠脑缺血后脑线粒体肿胀程度、膜流动性比较(±s)
与假手术组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。 下同。
组 别 n 肿胀程度(A520)膜流动性K η假手术组 20 86.93±4.25 0.62±0.04 2.08±0.17模型组 20 4.53±0.36**苦参素低剂量组 20 4.02±0.31 48.17±8.03** 1.41±0.09**55.48±9.12 1.13±0.09苦参素中剂量组 20 3.16±0.27△△61.35±9.76△ 0.95±0.08△苦参素高剂量组 20 75.69±11.28△△ 0.79±0.06△△ 2.79±0.24△△
2.3 各组大鼠脑缺血后脑线粒体呼吸功能比较
见表2。与假手术组比较,模型组脑缺血大鼠缺血侧脑线粒R3值显著降低、R4值显著升高、RCR显著降低(P<0.01);而与模型组比较,苦参素中、高剂量组脑缺血大鼠缺血侧脑线粒体R3值显著升高、R4值显著降低(P<0.05或P<0.01)。
表2 各组大鼠脑缺血后脑线粒体呼吸功能比较(±s)
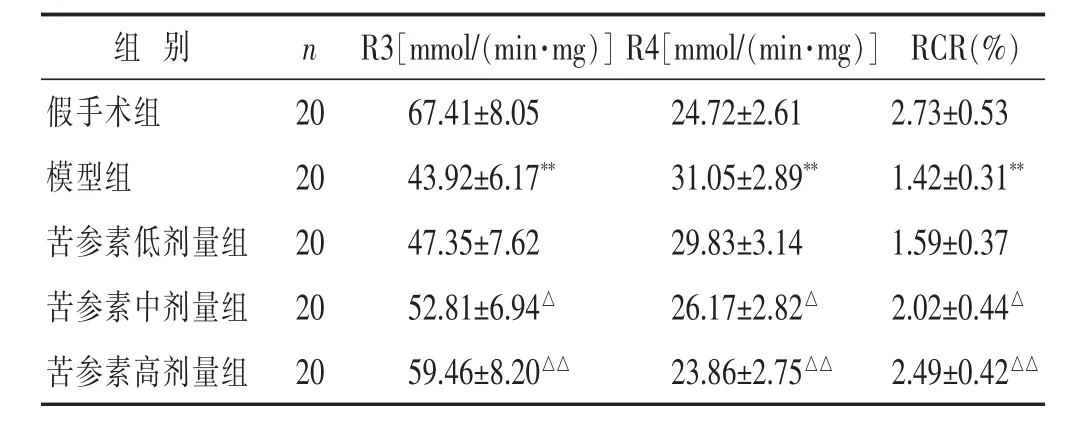
表2 各组大鼠脑缺血后脑线粒体呼吸功能比较(±s)
组 别 n RCR(%)假手术组 20 2.73±0.53模型组 20 1.42±0.31**苦参素低剂量组 20 1.59±0.37 R3[mmol/(min·mg)]R4[mmol/(min·mg)]67.41±8.05 24.72±2.61 43.92±6.17** 31.05±2.89**47.35±7.62 29.83±3.14苦参素中剂量组 20 2.02±0.44△52.81±6.94△ 26.17±2.82△苦参素高剂量组 20 59.46±8.20△△ 23.86±2.75△△ 2.49±0.42△△
2.4 各组大鼠脑缺血后脑线粒体超微结构的影响
见图1。通过透射电子显微镜观察发现,假手术组大鼠神经元形态规则、结构完整;模型组缺血侧神经元呈现形态不规则、多数线粒体水肿、少数线粒体崩解、部分嵴断裂消失等病理性形态结构改变。而与模型组比较,苦参素中、高剂量组大鼠缺血侧神经元及线粒体病理性形态结构改变呈不同程度改善,其中苦参素高剂量组缺血侧神经元线粒体仅少量出现水肿、线粒体膜基本完整、嵴仅少许破坏。
2.5 各组大鼠脑缺血后脑线粒体SOD、GSH-Px活性和MDA含量比较
见表3。与假手术组比较,模型组脑缺血大鼠缺血侧脑线粒体中SOD、GSH-Px活性显著降低而MDA含量显著升高(P<0.01);而与模型组比较,苦参素中、高剂量组脑缺血大鼠缺血侧脑线粒体SOD活性显著升高且MDA含量显著降低(P<0.05或P<0.01),苦参素高剂量组GSH-Px活性显著升高(P<0.05)。
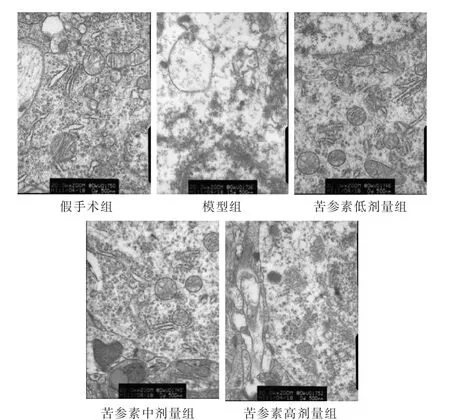
图1 透射电镜下各组大鼠脑缺血后脑线粒体超微结构(5000倍)
表3 各组大鼠脑缺血后脑线粒体呼吸功能比较(±s)
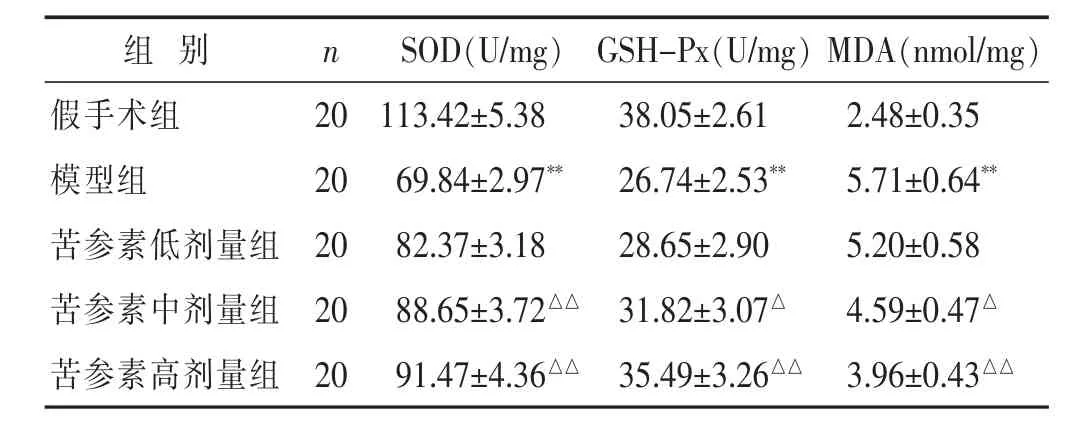
表3 各组大鼠脑缺血后脑线粒体呼吸功能比较(±s)
组 别 n MDA(nmol/mg)假手术组 20 2.48±0.35模型组 20 5.71±0.64**苦参素低剂量组 20 5.20±0.58 SOD(U/mg) GSH-Px(U/mg)113.42±5.38 38.05±2.61 69.84±2.97** 26.74±2.53**82.37±3.18 28.65±2.90苦参素中剂量组 20 4.59±0.47△88.65±3.72△△ 31.82±3.07△苦参素高剂量组 20 91.47±4.36△△ 35.49±3.26△△ 3.96±0.43△△
2.6 各组大鼠脑缺血后脑线粒体Na+-K+-ATPase、Ca2+-Mg2+-ATPase活性比较
见表4。与假手术组比较,模型组脑缺血大鼠缺血侧脑线粒体中Na+-K+-ATPase、Ca2+-Mg2+-ATPase活性显著降低(P<0.01);而与模型组比较,苦参素中、高剂量组脑线粒体Ca2+-Mg2+-ATPase活性显著升高(P<0.05或P<0.01),其中高剂量组Na+-K+-ATPase活性显著升高(P<0.01)。
表4 各组大鼠脑缺血后脑线粒体Na+-K+-ATPase、Ca2+-Mg2+-ATPase 活性比较(μmol/mg,±s)
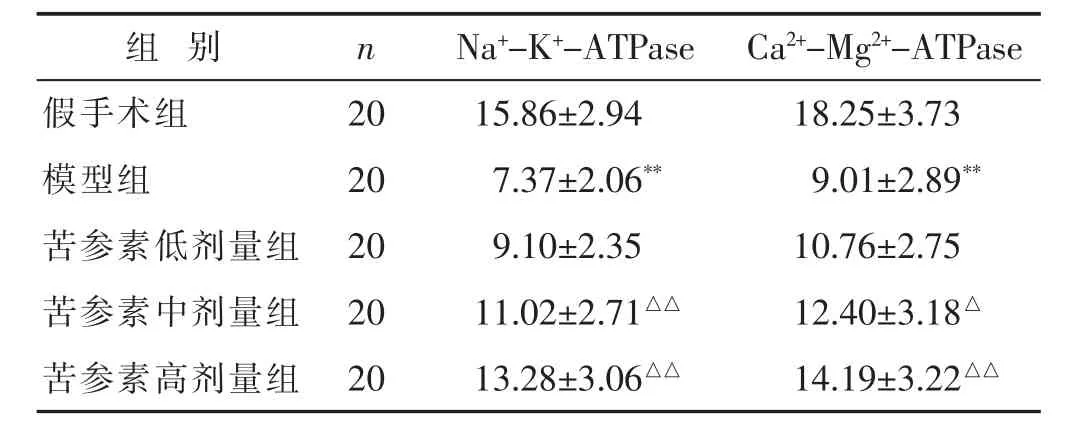
表4 各组大鼠脑缺血后脑线粒体Na+-K+-ATPase、Ca2+-Mg2+-ATPase 活性比较(μmol/mg,±s)
组 别 n Na+-K+-ATPase Ca2+-Mg2+-ATPase假手术组 20 15.86±2.94 18.25±3.73模型组 20 7.37±2.06** 9.01±2.89**苦参素低剂量组 20 9.10±2.35 10.76±2.75苦参素中剂量组 20 11.02±2.71△△ 12.40±3.18△苦参素高剂量组 20 13.28±3.06△△ 14.19±3.22△△
2.7 各组大鼠脑缺血后脑线粒体内游离Ca2+含量比较
见表5。与假手术组比较,模型组脑缺血大鼠缺血侧脑线粒体中游离Ca2+含量显著升高(P<0.01);而与模型组比较,苦参素中、高剂量组脑线粒体游离Ca2+含量显著降低(P<0.05或P<0.01)。
表5 各组大鼠脑缺血后脑线粒体内游离Ca2+含量比较(nmol/g,±s)

表5 各组大鼠脑缺血后脑线粒体内游离Ca2+含量比较(nmol/g,±s)
组 别 n Ca2+假手术组 20 12.97±2.03模型组 20 33.84±4.72**苦参素低剂量组 20 30.15±4.52苦参素中剂量组 20 25.63±4.08△苦参素高剂量组 20 19.74±2.88△△
3 讨 论
能量代谢障碍及其所引发的一系列连锁反应是脑缺血损伤发生发展的重要机制之一,线粒体是细胞能量的转换器,线粒体受损将导致线粒体呼吸功能障碍、ATP合成下降、自由基大量生成、细胞色素C释放等而进一步诱发氧化应激损伤及细胞凋亡,因此,保护线粒体对抑制缺血性脑损伤具有重要作用[13]。
苦参为豆科苦参属的变种,广泛分布于我国、俄罗斯、日本、印度等海拔1500米以上的山坡上,具有清热燥湿、祛风杀虫之功效。苦参素含有多种化学成分,其中苦参素是其主要有效成分之一,具有多种生物学活性,苦参素对心肌、肝脏、肾脏等组织缺血均具有一定的保护作用[7,14-15]。 此外,程钢等[16]和陈利平等[17]研究发现苦参素能够通过抑制氧化应激、炎症反应及继发性细胞凋亡而对脑缺血损伤起到一定的保护作用,但苦参素是否对脑缺血后脑线粒体具有保护作用尚未见文献报道。本研究发现,经苦参素50~100 mg/kg预处理能够有效降低大鼠脑缺血后缺血侧脑线粒体肿胀程度、提高线粒体膜流动性、提高线粒体呼吸功能。透射电镜观察显示:经苦参素预处理能够有效抑制大鼠脑缺血后缺血侧脑线粒体水肿、保护线粒体膜完整性等,提示苦参素对脑缺血后脑线粒体具有一定的保护作用。
线粒体是维持细胞内Ca2+动态平衡的主要调节者,缺血性脑病发生后Ca2+可由路径进入神经细胞,而线粒体则可以通过膜单向转运功能摄取细胞质中过多的 Ca2+,进而导致线粒体 Ca2+超载[18]。 氧自由基(ROS)过剩是导致机体氧化应激损伤的根本原因,生理状态下ROS能够在抗氧化酶SOD、GSH-Px相继催化作用下最终被还原生成H2O和 O2[19];但过剩的ROS将攻击细胞膜,使不饱和脂肪酸被氧化破坏而生成MDA[20];缺血性脑病发生后线粒体内SOD、GSH-Px活性降低而MDA含量升高,说明线粒体内ROS代谢失衡,发生氧化应激损伤。Ca2+超载和氧化应激是导致线粒体通透性转运孔道(MPTP)开放的主要原因[21]。本研究发现,经苦参素50~100 mg/kg预处理能够有效降低大鼠脑缺血后缺血侧脑线粒体Ca2+浓度,改善抗氧化酶SOD、GSH-Px活性并降低MDA含量,提示苦参素能够抑制线粒体Ca2+超载和氧化应激损伤,这可能是苦参素保护线粒体结构和功能损害的机制之一。
Na+-K+-ATPase、Ca2+-Mg2+-ATPase是存在于生物膜上的蛋白酶,对维持生物膜完整性及能量代谢具有重要意义,但Na+-K+-ATPase、Ca2+-Mg2+-ATPase对缺血缺氧非常敏感,缺血性脑病发生后,ATPase活性降低而使细胞内游离Na+、Ca2+浓度增高,从而破坏内环境稳态,影响细胞功能[22]。本研究发现,经苦参素50~100 mg/kg预处理能够有效提高大鼠脑缺血后缺血侧脑线粒体 Na+-K+-ATPase、Ca2+-Mg2+-ATPase活性,这可能是苦参素保护脑缺血后缺血侧脑线粒体结构的重要分子机制之一。
综上所述,苦参素对脑缺血后脑线粒体损伤具有一定的保护作用,其机制可能与降低Ca2+浓度、抑制氧化应激损伤以及改善Na+-K+-ATPase、Ca2+-Mg2+-ATPase活性有关。
[1]颜娟,郑茂东,崔玉环,等.牡荆苷对脑缺血再灌注损伤小鼠脑组织能量代谢的影响[J].山东医药,2017,57(5):26-29.
[2]秦胜利.红花注射液对大鼠脑缺血再灌注损伤后能量代谢的影响[J].临床医学,2016,36(7):114-116.
[3]孙明,赵育梅,徐超.牛磺酸降低局灶性脑缺血引起的能量代谢紊乱和氧化损伤[J].中风与神经疾病杂志,2008,25(5):577-579.
[4]Zheng L,Ding J,Wang J,et al.Effects and mechanism of action of inducible nitric oxide synthase on apoptosis in a rat model of cerebral ischemia-reperfusion injury[J].Anat Rec(Hoboken),2016,299(2):246-255.
[5]黄秀梅,李波,等.氧化苦参碱对TNFA、IL-6和IL-8的影响[J].中成药,2003,25(11):903-906.
[6]孔秀岩,苏志刚.氧化苦参碱对细胞凋亡影响的研究现状[J].河北医药,2007,29(12):1371-1373.
[7]王雪芬,王磊,陈树杰.苦参素对大鼠心肌缺血再灌注损伤的保护作用及其机制研究[J].中国中医急症,2016,25(6):988-992.
[8]缪培,张通,米海霞,等.基于线栓法大鼠大脑中动脉闭塞的局灶性脑缺血模型的比较研究[J].中国康复理论与实践,2016,22(10):1190-1195.
[9]Zhang HX,Du GH,Zhang JT.Ischemic pre-conditioning preserves brain mitochondrial functions during the middle cerebral artery occlusion in rat [J].Neurol Res,2003,25:471-476.
[10]Xiong J,Feng YP.The protective effect of butylphthalide against mitochondrial injury during cerebral ischemia[J].Acta Pharm Sin,2000,35(6):408-412.
[11]Kobayashi T,Kuroda S,Tada M,et al.Calcium-induced mitochondrial swelling and cytochrome c release in the brain:its biochemical characteristics and implication in ischemic neuronal injury[J].Brain Res,2003,960(1-2):62-70.
[12]Xi T,Rao MR.Effects of mnifedipine on left ventricular diastolic function and Ca2+content of myocardial and cerebral mitochondria and artery tissues in left ventircular hypertrophied rats[J].Acta Pharm Sin,1995,30(1):6-11.
[13]Chan PH.Mitochontria and neuronal death/survival signaling pathways in cerebral ischemia[J].Neurochem Res,2004,29:1943-1949.
[14]高鹏.苦参素抗大鼠肝脏缺血再灌注损伤作用的研究[J].当代医学,201,16(14):15-17.
[15]贾昌盛,孙建军,李美德,等.苦参素降低大鼠肾脏缺血-再灌注损伤[J].基础医学与临床,2012,32(8):943-947.
[16]程钢,秦媛媛,程迪,等.氧化苦参碱对大鼠局灶性脑缺血损伤的保护作用及其抑制凋亡的作用机制[J].中国药理学通报,2013,29(3):387-392.
[17]陈利平,王发渭,韩志涛,等.苦参碱对脑缺血再灌注损伤炎性因子的影响[J].中国中医急症,2010,19(12):2098-2099.
[18]Korge P,Honda HM,Weiss JN.Regulation of the mitochondrial permeability transition by matrix Ca2+and voltage during anoxia-reoxygenation[J].Am J Physiol,2001,280:517-526.
[19]Lartigue A,Burlat B,Coutard B,et al.The Megavirus chilensis Cu,Zn-superoxide dismutase: the first viral structure of a typical cellular copper chaperone-independent hyperstable dimeric enzyme[J].J Virol,2015,89(1):824-832.
[20]Kwiecien S,Magierowska K,Magierowski M,et al.Role of sensory afferent nerves,lipid peroxidation and antioxidative enzymes in the carbon monoxide-induced gastroprotection against stress ulcerogenesis[J].J Physiol Pharmacol,2016,67(5):717-729.
[21]Maciel EN,Kowaltowski AJ,Schwalm JM,et al.Mitochondrial permeability transition in neuronal damage promoted by Ca2+and respiratory chain complex Ⅱ inhibition[J].J Neurochem,2004,90(5):1025-1031.
[22]常明则,乔琳,吴海琴,等.葛根素预处理对大鼠局灶性脑缺血-再灌注线粒体功能的影响[J].脑与神经疾病杂志,2014,22(4):278-280.
