木栓质及其生理功能
2018-05-28杨海莉王锁民
高 丽,杨海莉,王 沛,2,王锁民
(1.兰州大学草地农业生态系统国家重点实验室;兰州大学草地农业科技学院,甘肃 兰州 730020;2.西南民族大学青藏高原研究院,四川 成都 610041)
植物在长期的进化过程中逐渐形成了一类特殊的以脂类-酚类为基础的疏水性屏障以适应复杂的、动态的、多变的土壤及外界环境。其中包括地上部的角质层及广泛分布于根中的木栓质,木栓质在根组织沉积形成的疏水性屏障不仅在控制水分和营养元素的运输以及限制病原菌和毒气入侵等方面发挥重要作用,同时在植物响应非生物胁迫中也发挥关键作用。因此,近年来有关木栓质的研究受到越来越广泛的关注,成为植物质外体屏障研究中的热点。本文概述了木栓质的结构、化学组成、单体合成,重点综述了木栓质单体的合成以及近年来在其生理功能方面的研究进展,并对目前木栓质研究中存在的问题及未来的研究方向进行了简要讨论和展望。
1 木栓质的分布
木栓质主要分布于植物根内皮层、外皮层,其中内皮层木栓质的沉积在所有高等植物中广泛存在,且形成较早,可以隔离皮层和中柱组织,是目前研究的重点[1]。
木栓质也广泛存在于周皮组织,如欧洲栓皮栎(Quercussuber)和马铃薯(Solanumtuberosum)块茎的周皮含有大量的木栓质[2-4]。此外在伤口愈合的过程中,木栓质会在伤口边缘处沉积以保护健康组织[1]。这些木栓化的周皮沉积于植物-环境界面,起到保护植物内部组织的作用。
木栓质的沉积同样存在于组织-组织界面,使植物内部各组织间相互隔离。例如,在柑橘属植物的种皮的合点及珠孔区域中也发现有木栓质的分布,将种子封闭起来[1]。在C4植物的维管束鞘细胞中,木栓质也有分布,它的作用是隔离叶肉细胞与维管束鞘细胞[1]。木栓质不仅沉积于植物体正常生长过程中的上述特定组织中,而且能响应外界环境刺激在非木栓组织中合成[5-6]。由此可见,在任何时间,植物需要形成屏障的任何部位都可能会存在木栓质的沉积[1,7]。
2 木栓质的化学组成及结构
木栓质是由甘油、脂肪酸与酚类化合物形成的高分子杂聚物[7-10]。脂肪族部分主要包括ω-羟基脂肪酸、α,ω-双羧基脂肪酸(简称α,ω-二酸)、中链含氧脂肪酸、未被取代的脂肪酸以及伯醇[1,10]。酚类组分主要由羟基化的肉桂酸组成,通常为阿魏酸、香豆酸和单木质醇[1]。
木栓质单体的碳链长度多为C16~C26,相比角质C16~C18更长,暗示着其疏水性可能更强[11-13]。木栓质总量和单体的相对含量在植物的不同发育阶段、不同组织以及不同物种间存在很大差异[14-15]。例如,拟南芥(Arabidopsisthaliana)根中的木栓质主要为C16,C18:1和C22的单体[11],而在其种皮中则是C22和C24的单体[12]。
通过对木栓化的细胞壁切片的观察发现其呈现明(电子半透明)暗(电子不透明)相间的薄层状超微结构。但关于这一明暗相间的条纹结构中电子半透明区域(明带)以及电子不透明区域(暗带)的化学组成仍存在争议。Bernards[9]以马铃薯周皮作为研究材料,认为组成木栓质的聚脂肪族域和聚芳香族域各自处在其特定的空间并以共价键彼此连接,且由聚脂肪族域形成了电子半透明的亮带,由酚类物质形成电子不透明的暗带。但Molina等[16]的研究发现,拟南芥ASFT/HHT敲除突变体中完全缺失酯结合态阿魏酸,但根中木栓层结构却没有受到影响,这否定了Bernards的观点。Soliday等[17]提出木栓层结构中的亮带是由蜡质组成的蜡层。然而,拟南芥far1-far4-far5三突变体中,木栓质相关的蜡质显著减少,木栓层的结构同样没有受到影响[18]。Serra等[19]在马铃薯中沉默细胞色素P450脂肪酸ω-羟化酶的编码基因CYP86A33,导致马铃薯块茎周皮中C18:1的ω-羟基酸和α,ω-二酸单体的含量分别下降了70%和90%,且RNAi株系中木栓层的结构扭曲变形,明暗相间的条带消失。因此,木栓层的这一明暗相间的薄层结构很可能与脂肪酸ω位点的羟基化有关。
3 木栓质单体的生物合成
木栓质的沉积首先需要合成脂肪族、酚类以及甘油单体,然后运输到细胞壁形成一个难溶的大分子。随着木栓质成分定量分析手段以及正向和反向遗传学的发展,参与编码木栓质单体合成酶的基因陆续被挖掘出来。目前已知的参与木栓质单体合成反应的酶包括β-酮脂酰-辅酶A合成酶(KCS)、细胞色素P450单加氧酶(CYP)家族、脂肪酰基还原酶(FAR)、3磷酸甘油酰基转移酶(GPAT)家族以及羟基肉桂辅酶A转移酶(ASFT)(表1、2)。
木栓质单体合成途径中涉及到的反应主要包括脂肪酸活化为脂肪酰辅酶A硫酯、长链脂肪酸前体的延伸、脂肪酸的ω-羟基化以及后续的ω-羟基酸到α,ω-双羧基酸的氧化以及脂肪酰链还原为脂肪醇等[7,9-10,15]。

表1 拟南芥中参与木栓质单体生物合成途径相关基因Table 1 Genes involved in suberin biosynthetic pathway in Arabidopsis thaliana
续表1
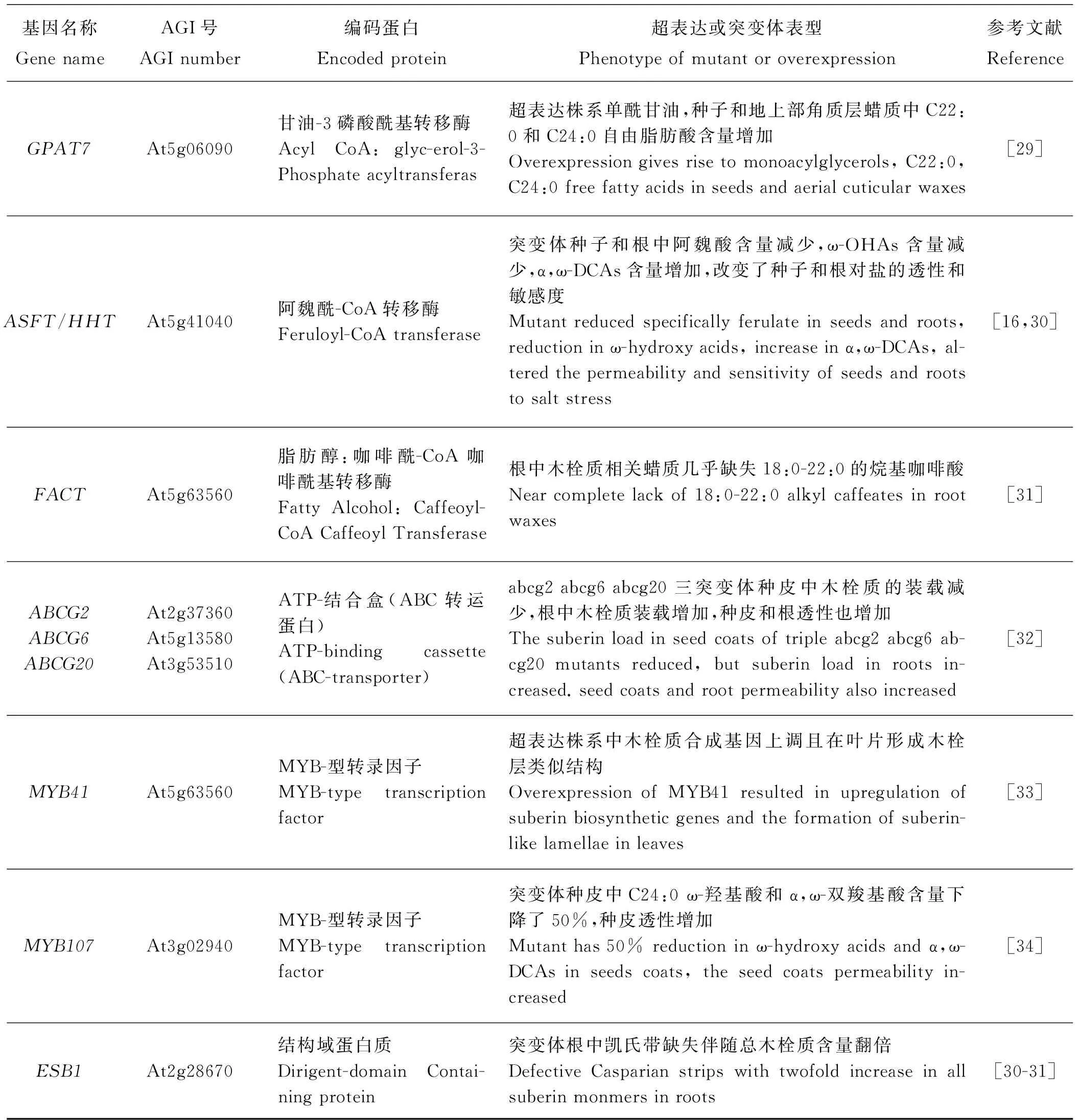
基因名称GenenameAGI号AGInumber编码蛋白Encodedprotein超表达或突变体表型Phenotypeofmutantoroverexpression参考文献ReferenceGPAT7At5g06090甘油-3磷酸酰基转移酶AcylCoA:glyc-erol-3-Phosphateacyltransferas超表达株系单酰甘油,种子和地上部角质层蜡质中C22:0和C24:0自由脂肪酸含量增加Overexpressiongivesrisetomonoacylglycerols,C22:0,C24:0freefattyacidsinseedsandaerialcuticularwaxes[29]ASFT/HHTAt5g41040阿魏酰-CoA转移酶Feruloyl-CoAtransferase突变体种子和根中阿魏酸含量减少,ω-OHAs含量减少,α,ω-DCAs含量增加,改变了种子和根对盐的透性和敏感度Mutantreducedspecificallyferulateinseedsandroots,reductioninω-hydroxyacids,increaseinα,ω-DCAs,al-teredthepermeabilityandsensitivityofseedsandrootstosaltstress[16,30]FACTAt5g63560脂肪醇:咖啡酰-CoA咖啡酰基转移酶FattyAlcohol:Caffeoyl-CoACaffeoylTransferase根中木栓质相关蜡质几乎缺失18:0-22:0的烷基咖啡酸Nearcompletelackof18:0-22:0alkylcaffeatesinrootwaxes[31]ABCG2ABCG6ABCG20At2g37360At5g13580At3g53510ATP-结合盒(ABC转运蛋白)ATP-bindingcassette(ABC-transporter)abcg2abcg6abcg20三突变体种皮中木栓质的装载减少,根中木栓质装载增加,种皮和根透性也增加Thesuberinloadinseedcoatsoftripleabcg2abcg6ab-cg20mutantsreduced,butsuberinloadinrootsin-creased.seedcoatsandrootpermeabilityalsoincreased[32]MYB41At5g63560MYB-型转录因子MYB-typetranscriptionfactor超表达株系中木栓质合成基因上调且在叶片形成木栓层类似结构OverexpressionofMYB41resultedinupregulationofsuberinbiosyntheticgenesandtheformationofsuberin-likelamellaeinleaves[33]MYB107At3g02940MYB-型转录因子MYB-typetranscriptionfactor突变体种皮中C24:0ω-羟基酸和α,ω-双羧基酸含量下降了50%,种皮透性增加Mutanthas50%reductioninω-hydroxyacidsandα,ω-DCAsinseedscoats,theseedcoatspermeabilityin-creased[34]ESB1At2g28670结构域蛋白质Dirigent-domainContai-ningprotein突变体根中凯氏带缺失伴随总木栓质含量翻倍DefectiveCasparianstripswithtwofoldincreaseinallsuberinmonmersinroots[30-31]
通常而言,脂肪酸代谢反应的第一步是自由脂肪酸的活化反应。拟南芥中目前发现存在9个编码长链酰基-COA合成酶(LACS)的基因参与脂肪酸的激活反应[40]。其中,LACS2参与角质和角质层蜡质的生物合成[41]。但LACS基因在木栓质合成过程中的作用尚未见报道,然而,在LACS2基因缺失突变体中的化学分析表明LACS2也参与木栓质的形成[13]。MYB107参与调控拟南芥种皮中木栓质的沉积,在myb107突变体中LACS的表达同样出现了下调的现象[34],这也支持了LACS2参与木栓质的沉积。此外,LACS酶也可能参与ω-羟基酸和α,ω-二酸在酯化到甘油分子上之前的激活。
脂肪酸被激活后形成的脂肪酰-COA的延长则是由定位于内质网上的脂肪酸延长酶复合体参与催化的[42]。β-酮脂酰-COA合酶(KCS)是脂肪酸延长酶复合体中的第1个酶,参与控制长链脂肪酰-CoA伸长的程度,同时也是这一过程中的限速酶[43]。拟南芥中有21个KCS基因,其中β-酮脂酰-COA合酶基因DAISY/AtKCS2和AtKCS20参与C20酰基链的木栓质前体的延伸过程[20-21]。KCS2突变虽然并未引起根中木栓质总量的变化,但却导致C22和C24极长链脂肪酸衍生物减少。然而kcs2kcs20双突变体中脂肪族木栓质的含量相比于任一单突变体都受到了更显著的影响,表明这两种酶存在部分功能冗余[21]。

表2 马铃薯中参与木栓质单体生物合成途径相关基因Table 2 Genes involved in suberin biosynthetic pathway in Solanum tuberosum
NADPH依赖的细胞色素P450单加氧酶家族中的CYP86亚家族主要参与催化脂肪酰-COA ω-位点的羟基化,形成ω-羟基酸,其中一部分 ω-羟基酸又进一步被氧化成α,ω-双羧基酸[44-46]。Benveniste等[47]首次从拟南芥中克隆到CYP86A1基因,并在酵母中异源表达,发现该基因参与短链脂肪酸的羟基化过程。拟南芥cyp86a1突变体植株根系C16和C18 ω-羟基酸和α,ω-二酸木栓质单体含量显著下降,且最终总脂肪族木栓质单体含量下降了60%。同时通过RT-PCR、GUS染色及GFP定位等方法将CYP86A1定位于根内皮层细胞的内质网上,这暗示木栓质单体的合成是在内质网上进行的[22]。且马铃薯中CYP86A1的同源蛋白StCYP86A33在马铃薯块茎周皮木栓质单体的ω-羟基化过程中同样发挥关键作用[19]。CYP86B1与CYP86A1同属一个亚家族,参与极长链(C22-C24)ω-羟基酸以及α,ω-双羧基酸的形成[16,24]。CYP86B1敲除株系的根及种皮中C22和C24 ω-羟基酸和α,ω-二酸几乎完全缺失,但脂肪族木栓质单体C22和C24脂肪酸积累增加[16]。
脂肪酰-COA还原成伯醇的过程则是由脂肪酰还原酶(FARs)介导的。在拟南芥中,FAR家族有8个成员,各自的功能均已被鉴定[48]。其中FAR1、FAR4和FAR5这3个基因参与木栓质相关的脂肪醇的合成[18,25]。这3个基因的T-DNA插入单突变体分别表现出不同链长伯醇的减少,其中far1突变体的根和种子中C22:0伯醇含量显著下降,far4突变体的根和种子中C20:0伯醇含量下降,而far5突变体的根和种子中C18:0伯醇的含量有所下降[25]。因此,FAR1和FAR4可能参与种皮木栓质中α,ω-二醇的合成,然而它们是否以ω-羟基酰链为底物仍需进一步验证[18]。在far1-far2-far3的三突变体中,木栓质中总脂肪醇的含量降低了70%~80%,而其他主要单体含量没有显著变化,表明木栓质的聚合过程并没有改变,但三突变体的种皮透性却有所增加。
酰基转移反应则是由酰基-COA-依赖的甘油-3-磷酸酰基转移酶(GPATs)催化生成甘油-酸酯完成的,甘油-酸酯被认为是木栓质大分子的基石。GPATs催化脂肪酰-COA或酰基-酰基载体蛋白向甘油-3-磷酸的sn-1或sn-2位点的转移[27]。通过这一过程,甘油被共价结合到木栓质的脂肪族与芳香族部分[4]。目前发现拟南芥中至少存在20个可能的酰基转移酶[13]。通过功能获得与缺失的方法证实其中的8个GPAT基因参与角质与木栓质的生物合成。Yang等[28-29]的研究表明GPAT4、6和8对C16:0和C18:1 ω-位点碳氧化的酰基-COAs具有更高的亲和力。而极长链(C20-C24)脂肪酰则作为GPAT5的底物[26]。在拟南芥gpat5突变体根和种子中C20-C24未被取代的脂肪酸、ω-羟基酸和α,ω-双羧基酸的含量显著减少,木栓质的总量减少为对照的一半[26]。GPAT7基因可被创伤诱导,GPAT7在叶中超表达会积累木栓质类单体,表明其可能在创伤诱导的木栓质单体合成中发挥作用[29]。
拟南芥和马铃薯中编码阿魏酰-CoA转移酶的基因相继被克隆[30,36-37]。拟南芥中脂肪族木栓质阿魏酰转移酶(ASFT/HHT)以及马铃薯中的同源蛋白ω-羟基脂肪酸/脂肪醇羟基肉桂酰转移酶(FHT)属于BAHD酰基转移酶家族,均催化阿魏酰CoA的酰基向ω-羟基酸和脂肪醇的转移[28,36-37]。拟南芥asft/hht突变体根中木栓质完全缺失阿魏酸盐,且ω-羟基酸和α,ω-双羧基酸的含量显著下降[16,30]。于此类似的是,FHT-RNAi沉默的马铃薯块茎周皮中酯结合阿魏酸大量减少,但木栓层的结构并没有发生变化[36]。
尽管许多植物中木栓质生物聚酯的许多单体成分已知,但木栓质单体合成的反应顺序依然不清楚,参与木栓质单体与角质单体合成反应的酶的区别以及它们间是否存在互作等都需要进一步研究。
4 木栓质的转运及组装
4.1 木栓质的跨膜转运
各种木栓质前体,无论是以单体还是部分形成低聚物的形式,最终都要跨膜运输到质外体,然后在质外体聚合形成木栓质屏障。虽然木栓质单体的合成途径已被广泛认知,然而有关木栓质单体跨膜转运机制的研究才刚刚开始。Mcfarlane等[49]的研究发现,高尔基体与反式高尔基体网络介导的囊泡运输参与表皮蜡质向质外体的转运。因此也很可能参与木栓质单体的转运。此外,参与角质和蜡质向细胞壁跨膜转运的ATP-结合盒(ABC)转运蛋白和脂质转移蛋白(LTPs)也是木栓质跨膜转运的候选蛋白。
定位于质膜上的ABC转运蛋白中的G亚家族参与表皮蜡质和孢粉素前体的转运[50-51],因此也可能参与木栓质的转运。编码ABCG亚家族中的一个子家族WBC(white-brown complex)型蛋白的基因在欧洲栓皮栎的木栓组织中高丰度表达[52]。近年来发现水稻(Oryzasativa)的RCN1/OsABCG5参与水稻根周皮的木栓化[53],且Landgraf等[38]的研究表明ABCG1也参与马铃薯块茎周皮木栓质的形成。拟南芥abcg2-abcg6-abcg20的三突变体表现出根和种皮木栓质结构、组分和特性上的改变,但3个单突变体均没有明显的表型,表明这3个ABC转运蛋白在木栓质前体的跨膜运输过程中存在功能冗余[32]。
糖基化磷脂酰肌醇(GPI)锚定的LTPs和III型LTPs分别参与表皮脂类的沉积和花粉外壁的形成[54-55]。按照分别参与角质、木栓质和孢粉素的合成或沉积将LTPGs分为3类[55]。然而,在拟南芥ltpg突变体中进行深入研究却发现一个对种皮透性和木栓质组分影响极大的成员却并不属于木栓质类[56-57]。最新研究表明,非特异性脂类转移蛋白AtLtpI-4在拟南芥冠瘿瘤(Crown gall)中木栓质的形成中是必需的,其突变导致C18:0的木栓质组分含量大幅下降[58]。
这些结果表明ABCG转运蛋白和LTPs脂质转移蛋白参与木栓质组分的跨膜转运,但仍需进一步挖掘参与木栓质跨膜转运的相关蛋白,进一步阐明木栓质单体的跨膜运输机制。
4.2 木栓质的组装
目前对于木栓质单体或低聚物在跨膜转运之后在细胞壁的聚合组装机制的理解还很有限。近年来,随着番茄(Solanumlycopersicum)中第1个角质合成酶CD1(cutin deficient 1)的鉴定,植物表面脂质的组装机制逐渐被阐明[59]。CD1定位于细胞外,属于GDSL-motif脂酶/水解酶家族,体外实验证实其催化sn-2-单酰甘油前体的酯基转移作用[59]。在拟南芥中克隆得到CD1的同源基因并在体外对其功能进行了鉴定,但是其聚合产物是单一的线性,表明还有其他蛋白酶参与网状聚酯的最终形成[60]。但CD1是否同样参与木栓质在细胞壁的聚合还是未知的。一种α,β水解酶折叠蛋白BODYGUARD(BDG)被证实参与角质的交联过程[61]。拟南芥bdg突变体叶片中角质含量大幅度下降,尤其是C18多元未饱和的角质单体的含量显著下降,且根中总木栓质含量也有明显的下降,GUS染色的结果也显示BDG在根系内皮层有定位,表明BDG还参与拟南芥根系木栓质的聚合[61]。
木栓化的细胞壁中酚类组分的聚合被推测是由一个过氧化物酶/H2O2介导的过程[62]。一类阴离子过氧化物同工酶参与马铃薯块茎创伤诱导的木栓化过程中酚类物质的聚合,该酶优先选择阿魏酰(O-甲氧基苯酚)取代的底物,在马铃薯块茎的创伤愈合过程中积累相应的产物[63]。近年来一种NADPH依赖型的氧化酶类和过氧化物酶类被发现参与内皮层凯氏带的木质化[64],也可能参与木栓质的聚合组装。
尽管木栓质单体的跨膜转运及组装过程可借鉴角质单体的,但由于两种单体的化学组成及各自的分布部位存在差异,其跨膜转运及组装聚合过程可能也会存在一定差异。
5 木栓质合成的调控
木栓质沉积于特殊的细胞类型,且被各种非生物和生物胁迫所诱导。木栓质生物合成相关基因的表达模式与木栓质的沉积位点和外界条件等密切相关,木栓质的生物合成在转录水平上受到严格的调控。随着转录组学及蛋白组学的发展,参与木栓质合成调控的因子也陆续被发现。最早被发现的参与木栓质合成调控的转录因子是拟南芥AtMYB41,在拟南芥叶片持续超表达AtMYB41以及在烟草(Nicotianabenthamiana)叶片中瞬时表达AtMYB41均可诱导木栓质在其叶片表皮以及叶肉细胞的细胞壁上沉积形成木栓层类似结构;同时,在超表达AtMYB41的转基因株系中参与木栓质合成基因的表达水平也大幅增加,此外,还发现AtMYB41基因在拟南芥正常发育的根中不表达,但是在内皮层响应非生物胁迫时被特异诱导,这表明MYB41仅调控胁迫诱导下的木栓质的沉积。目前还有待于进一步挖掘其他非胁迫诱导类木栓质合成的调控因子。
苹果(Malus×domestica)MdMYB93被发现参与调节黄褐色苹果果皮中的木栓质沉积[65]。在拟南芥、苹果和番茄中另一项最新研究发现,与MYB93亲缘关系十分相近的两个MYB类转录因子MYB9和MYB107也参与调控木栓质在种皮和果皮中的沉积[66]。
Gou等[34]的研究进一步证实了MYB107参与调控拟南芥种皮中木栓质的合成。MYB107主要在长角果中表达,MYB107突变导致种皮中聚脂肪族和聚芳香族成分均大幅度下降,导致种皮透性增加,木栓层结构改变,同时,myb107突变体中参与木栓质合成的关键基因FACT、CYP86A1、CYP86B1、FAR1等的表达均有所下调。但myb107突变体根系木栓质含量以及地上部角质的含量与野生型相比没有明显差异,这表明MYB107仅参与正向调控种皮中木栓质的合成及组装[34]。
最近,Verdaguer等[39]在马铃薯块茎周皮的研究中发现首个负调控周皮中木栓质及相关蜡质生物合成的转录因子NAC103,StNAC103基因沉默的马铃薯块茎周皮中木栓质及相关蜡质的装载增加,特别是烷烃类、羟基脂肪酸、二酸、阿魏酸以及伯醇等。此外,在沉默株系中与周皮木栓质合成及转运有关的关键基因的表达均有所上调。
6 木栓质的生理功能
6.1 木栓质与非生物胁迫
6.1.1木栓质与盐胁迫 高盐胁迫导致拟南芥gpat5突变体种子的发芽率降低,且幼苗对盐胁迫的耐受性下降[26]。木栓质合成中编码β-酮脂酰-COA合酶的关键酶DAISY/KCS2基因的表达在NaCl和渗透胁迫处理后显著上调[22];参与木栓质单体中脂肪醇合成的FAR1、FAR4和FAR5基因的表达也都受NaCl显著诱导[29]。Krishnamurthy等[67-68]分析发现,相比于盐敏感品种IR20和中等耐盐品种Jaya,强耐盐型品种Pokkali的根系木栓化程度最高且地上部Na+积累最少,这3种水稻品种根系木栓化均会受盐胁迫诱导加强,且木栓质合成基因的转录水平也受盐胁迫的诱导。拟南芥木栓质合成中另外一个关键基因CYP86A1突变之后,植株对水分和NaCl的透性都显著增加[69];在对CYP86A在植物响应盐胁迫中作用的分析表明,适量NaCl诱导了拟南芥根的木栓化以及根中CYP86A1基因的高丰度表达[23]。盐胁迫下,拟南芥cyp86a1突变体植株地上部生长受到显著抑制,且地上部积累更多的Na+,而K+含量则相应的减少,表明CYP86A1通过调控木栓质的合成,进而调控水分和离子转运,在植物响应盐胁迫中发挥关键作用,同时为进一步探究盐生植物小花碱茅根系质外体屏障在其适应盐渍土壤中的作用奠定基础[23]。
这些研究均表明植物根系木栓质受NaCl诱导增加,其作为质外体屏障在植物响应盐胁迫过程中发挥重要作用。
6.1.2木栓质与干旱胁迫 干旱胁迫下,木栓化的外皮层可以防止水分流失以及将溶质留在根围以维持根系渗透调节能力[70]。而长期干旱胁迫导致根系表皮和皮层细胞相继死亡,此时,内皮层作为根系最外层发挥功能[71-72]。干旱条件下,内皮层木栓化程度的增加,可以保护内部中柱鞘和维管组织免受干旱胁迫,保证其与地上部间持续的维管连接,帮助植株度过干旱期,一旦环境条件有所改善,中柱鞘/内皮层能够再生侧根来恢复生长[6,73]。
拟南芥突变体esb1(enhancedsuberin1)植株根系中的木栓质含量增加、日蒸腾速率下降,在营养生长阶段其水分利用效率增加,在干旱胁迫下相比于野生型表现出更耐萎焉的特性,且这种木栓质和水分运输的改变与地上部Ca、Mn和Zn积累减少以及Na、S、K、As、Se和Mo等积累增加有关[74]。但esb1突变体同样表现出凯氏带形成缺陷[75],因此这些离子组模式的变化也可能与凯氏带的缺陷有关。最近,Li等[76]通过对拟南芥低钙敏感的lcs2-1(lowcalciumsensitive2-1)突变体和esb1突变体的研究,揭示了这两种突变体的地上部钙浓度的降低是由内皮层木栓质积累增加而非凯氏带缺陷引起。lcs2-1突变体的根中凯氏带缺陷,内皮层木栓质积累增加,无论在正常条件还是低钙条件下,lcs2-1突变体叶片钙浓度均下降了30%,随后分别在lcs2-1和esb1突变体中转入木栓质降解酶基因CDEF1后,转基因株系地上部钙浓度增加,表明根系内皮层木栓质在离子转运中发挥重要的作用,同时还发现木栓质与侧根的形成密切相关[76]。
两个耐旱程度不同的橄榄树(Oleaeuropaea)在持续干旱胁迫后,根系木栓化的细胞层均由内皮层向皮层延伸,且伴随根系水力学导度和气孔导度下降[77]。根据橄榄树根的形态和颜色的不同将根分为棕色根(木栓化程度高)和白色根(木栓化程度低)两种,结果表明,两个品种中棕色根较白色根而言,其导水率的下降更为明显,气孔导度呈现相同的下降趋势[77]。
关于木栓质在植物响应干旱胁迫的作用研究多集中于其木栓质含量的改变对植物根系透水性的改变,对于直接通过木栓质合成关键基因的功能获得或缺失直接影响植物对干旱胁迫的生理响应的研究还相对较少。
6.1.3木栓质与水淹胁迫 木栓质沉积在植物响应水淹胁迫中同样发挥关键作用。植物处在水淹条件下首先会造成缺氧,有氧呼吸受到影响,进而导致代谢能量不足,长期处于水淹胁迫下,植物体内长期供能不足,且水淹土壤中有毒物质积累导致植物根系死亡。木栓质在植物根系的沉积能有效阻止水淹胁迫下植物根系径向氧损失,且能防止涝渍土壤中有毒物质及微生物毒素进入根系[15,78-80]。
关于木栓质在植物适应水淹条件下的作用研究多集中于湿地植物上,解剖学观察、质外体示踪以及氧气微电极分析表明水稻和芦苇(Phragmitescommunis)中径向氧损失的屏障是由木栓质在其根系外皮层沉积形成的[81-82]。此外,De Simone等[83]对4种亚马逊树的下皮(外皮层)细胞壁的氧气运输特性及质外体屏障进行研究,对下皮细胞壁分离并对其进行化学分析,并对径向氧损失进行测定,结果证实了木栓质作为一种关键的渗透屏障在根和根际间气体交换过程中发挥关键作用。水淹胁迫也会诱导大麦(Hordeumvulgare)根系木栓质沉积形成径向氧损失屏障[84-85]。
水稻RCN1/OsABCG5参与水稻根系木栓质的沉积,水淹条件下(缺氧条件),水稻野生型根系外皮层细胞壁木栓化程度明显增加以防止径向氧损失[53]。RCN1/OsABCG5突变导致水稻根系尤其是C28-C30的脂肪酸和ω-羟基脂肪酸含量显著下降,rcn1突变体根系外皮层木栓化缺失,导致其耐涝性减弱[53],且在水稻径向氧损失屏障形成过程中,参与木栓质合成的基因中有20%的基因表达上调[86]。与在水稻中的研究结果类似,在欧洲栎根系径向氧损失屏障的形成时,木栓质合成关键基因CYP、KCS、GPAT等的表达也均有所上调[87]。
6.1.4木栓质与营养胁迫 内皮层的木栓化不只受到干旱和盐胁迫的诱导,Barberon等[88]的研究发现植物根系木栓化还响应一系列由脱落酸(abscisic acid, ABA)和乙烯介导的营养胁迫。分别在Fe、Mn、Zn缺失培养基上生长的拟南芥幼苗根系内皮层木栓化均有所延迟,而缺K和缺S则使拟南芥幼苗根系内皮层木栓化增强,这也与相应突变体的分析结果一致,且营养胁迫抑制木栓化的过程由乙烯信号通路介导,而ABA信号通路则参与营养胁迫诱导木栓化的过程,此外,ABA和乙烯可直接调控拟南芥幼苗根系木栓化。ABA引起内皮层木栓化向皮层及更外层延伸,值得注意的是,乙烯处理却引起内皮层次级分化阶段已沉积的木栓质消失,这表明幼苗根系内皮层木栓化的高度可塑性[88]。
木栓化的改变与生理适应性相关,表明了内皮层木栓化在植物体内营养稳态维持方面的重要作用,但外皮层木栓化程度的改变是否同样影响营养元素的运输还需进一步研究。
6.2 木栓质与生物胁迫
除了影响水分和营养物质的运输以及抵抗非生物胁迫外,木栓质沉积在抵御病原菌入侵方面也发挥作用。马铃薯块茎遭受创伤能诱导周皮的木栓化,从而对病原菌的抗性增加[5,89-90]。此外,木栓化还能提高大豆(Glycinemax)对疫霉菌(Phytophthorasojae)的抗性,从而避免根和茎的腐烂[91-92]。接种疫霉菌增加了大豆根被皮和内皮层的木栓化,但进一步研究发现,木栓质含量高的品种中菌丝的生长只是被延迟了[91]。
马铃薯块茎结痂病是由链霉菌属引起的,Thangavel等[93]通过细胞抗毒素筛选出具有结痂病抗性的马铃薯体细胞克隆,且这些马铃薯体细胞克隆不仅对结痂病具有抗性,对其他的马铃薯块茎感染病原也具有抗性,但这些抗性机制尚不可知。在具有抗性的马铃薯体细胞克隆和其易感染的亲本马铃薯块茎的周皮组织中,对与木栓质合成相关的基因以及与先天防御反应相关的基因的表达模式进行分析,结果显示具有抗性的马铃薯体细胞克隆相较于易感染亲本,块茎周皮中与木栓质相关的基因的表达量更高,且在周皮形成更多的木栓层来响应病原菌感染,而与先天防御反应相关的信号基因的表达在两者间没有差异,这一结果充分说明了周皮木栓化在马铃薯块茎抵御病原菌入侵中的重要作用[93]。在其他一些植物,例如拟南芥、小麦(Triticumaestivum)以及番茄中也发现病原菌的侵入会诱发木栓化来响应[11,94-95]。
综上所述,木栓质能通过增强根或块茎周皮细胞壁的物理性屏障来部分地阻断病菌的侵入,但尚需对控制木栓质合成的关键基因在植物生物胁迫抗性中的作用进行深入研究。
7 总结与展望
近些年,对于木栓质生物合成的研究已经取得了巨大进步,但木栓质单体合成的反应顺序、转运及聚合组装机制以及木栓质合成的调控等关键环节依然模糊不清。可以借鉴角质及相关蜡质的合成,组装以及聚合机制,进一步完善人们对木栓质单体的运转、细胞外的组装、细胞壁木栓质聚合机制以及木栓质生物合成的调控等过程的理解。
Naseer和Geldner[96]的研究表明,根系内皮层质外体屏障凯氏带的主要组成成分是木质素而非木栓质,因此内皮层凯氏带和木栓质的沉积可能在植物根系水分和营养元素吸收运输方面发挥着不同的功能。随着一系列新技术的产生与发展,下一步研究可重点围绕木栓质与凯氏带功能特异性与互补性展开,另一方面,可将木栓质的沉积与侧根的形成结合起来,最新的研究表明侧根形成时,凯氏带这一质外体屏障被打破,但木栓质的沉积并未受到影响,因此木栓质可能在侧根形成过程中内皮层质外体屏障功能的维持中发挥更为关键的作用[76]。这一机制的阐明将是对根系结构适应环境变化模型的重要补充。
与此同时,众多研究表明木栓质在植物根系外皮层以及内皮层的沉积具有多重功能。但仍需对木栓质生理功能进行深入研究。木栓质单体中的哪些成分与植物响应生物胁迫和非生物胁迫直接相关还有待于进一步确定,且目前关于木栓质的生理功能研究多集中于抗逆性并不强的模式植物中,需要进一步挖掘抗逆性强的植物中与木栓质合成的关键基因,进一步通过功能获得或缺失的方法探究这些抗逆性强的植物中木栓质与其响应逆境间的关系。
在优良牧草紫花苜蓿中接种土壤微生物丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)显著提高了其抗旱性,这种土壤有益微生物与植物根系共生,其在根系周围形成的菌丝体网络可以帮助植物从更深的土层、更小的土壤缝隙中汲取更多的水分[97],但关于这些土壤有益微生物与植物根系木栓化是否存在互作来共同参与植物适应逆境值得进一步研究。此外,土壤环境是复杂多样化的,其离子组成和水分含量高度不均匀,两种对立的刺激(如缺Fe和缺K同时存在)或是多种刺激同时存在时对根系木栓化会造成何种影响、以及根系病原菌等生物因子对根系木栓化的影响同样值得研究。
对这些深层次机理的探究对将来通过基因工程手段培育具有多重抗性的作物及牧草新品种具有十分深远的意义。
参考文献References:
[1] Kolattukudy P E.Advances in Biochemical Engineering/Biotechnology.Springer,2001:1-49.
[2] Kolattukudy P E,Kronman K,Poulose A J.Determination of structure and composition of suberin from the roots of carrot,parsnip,rutabaga,turnip,red beet,and sweet potato by combined gas-liquid chromatography and mass spectrometry.Plant Physiology,1975,55(3):567-573.
[3] Graça J,Pereira H.Cork suberin:A glyceryl based polyester.Holzforschung-International Journal of the Biology,Chemistry,Physics and Technology of Wood,1997,51(3):225-234.
[4] Graça J,Pereira H.Suberin structure in potato periderm:Glycerol,long-chain monomers,and glyceryl and feruloyl dimers.Journal of Agricultural & Food Chemistry,2000,48(11):5476-5483.
[5] Lulai E C,Corsini D L.Differential deposition of suberin phenolic and aliphatic domains and their roles in resistance to infection during potato tuber (SolanumtuberosumL.) wound-healing.Physiological & Molecular Plant Pathology,1998,53(4):209-222.
[6] Enstone D E,Peterson C A,Ma F.Root endodermis and exodermis:Structure, function,and responses to the environment.Journal of Plant Growth Regulation,2002,21(4):335-351.
[7] Franke R,Schreiber L.Suberin-a biopolyester forming apoplastic plant interfaces.Current Opinion in Plant Biology,2007,10(3):252-259.
[8] Kolattukudy P E.Structure,biosynthesis,and biodegradation of cutin and suberin.Annual Review in Plant Physiology,1981,32(32):539-567.
[9] Bernards M A.Demystifying suberin.Canadian Journal of Botany,2002,80(3):227-240.
[10] Pollard M,Beisson F,Li Y,Ohlrogge J B.Building lipid barriers:Biosynthesis of cutin and suberin.Trends in Plant Science,2008,13(5):236-246.
[11] Franke R,Briesen I,Wojciechowski T,Faust A,Yephremov A,Nawrath C,Schreiber L.Apoplastic polyesters inArabidopsissurfacetissues:A typical suberin and a particular cutin.Phytochemistry,2005,66(22):2643-2658.
[12] Molina I,Bonaventure G,Ohlrogge J,Pollard M.The lipid polyester composition ofArabidopsisthalianaand brassica napus seeds.Phytochemistry,2006,67(23):2597-2610.
[13] Li-Beisson Y,Shorrosh B,Beisson F,Andersson M X,Arondel V,Bates P D,Baud S,Bird D,Debono A,Durrett T P.Acyl-lipid metabolism.Arabidopsis Book,2014,8:e0133.
[14] Zeier J,Schreiber L.Comparative investigation of primary and tertiary endodermal cell walls isolated from the roots of five monocotyledoneous species:Chemical composition in relation to fine structure.Planta,1998,206(3):349-361.
[15] Ranathunge K,Schreiber L,Franke R.Suberin research in the genomics era-new interest for an old polymer.Plant Science,2011,180(3):399-413.
[16] Molina I,Libeisson Y,Beisson F,Ohlrogge J B,Pollard M.Identification of anArabidopsisferuloyl-coenzyme a transferase required for suberin synthesis.Plant Physiology,2009,151(3):1317-1328.
[17] Soliday C L,Kolattukudy P E,Davis R W.Chemical and ultrastructural evidence that waxes associated with the suberin polymer constitute the major diffusion barrier to water vapor in potato tuber (SolanumtuberosumL.).Planta,1979,146(5):607-614.
[18] Vishwanath S J,Kosma D K,Pulsifer I P,Scandola S,Pascal S,Joubès J,Dittrich-Domergue F,Lessire R,Rowland O,Domergue F.Suberin-associated fatty alcohols inArabidopsis:Distributions in roots and contributions to seed coat barrier properties.Plant Physiology,2013,163(3):1118-1132.
[19] Serra O,Soler M,Hohn C,Sauveplane V,Pinot F,Franke R,Schreiber L,Prat S,Molinas M,Figueras M.CYPA33-targeted gene silencing in potato tuber alters suberin composition,distorts suberin lamellae,and impairs the periderm’s water barrier function.Plant Physiology,2009,149(2):1050-1060.
[20] Franke R,Höfer R,Briesen I,Emsermann M,Efremova N,Yephremov A,Schreiber L.The daisy gene fromArabidopsisencodes a fatty acid elongase condensing enzyme involved in the biosynthesis of aliphatic suberin in roots and the chalaza-micropyle region of seeds.Plant Journal,2009,57(1):80-95.
[21] Lee S B,Jung S J,Go Y S,Kim H U,Kim J K,Cho H J,Park O K,Suh M C.TwoArabidopsis3-ketoacyl coa synthase genes,KCS20 and KCS2/DAISY,are functionally redundant in cuticular wax and root suberin biosynthesis,but differentially controlled by osmotic stress.Plant Journal for Cell & Molecular Biology,2009,60(3):462-475.
[22] Höfer R B,Isabel,Beck M,Pinot F,Schreiber L,Franke R.TheArabidopsiscytochrome P450 CYP86A1 encodes a fatty acid ω-hydroxylase involved in suberin monomer biosynthesis.Journal of Experimental Botany,2008,59(9):2347-2360.
[23] 王沛.木栓质合成关键基因CYP86A在植物抵御盐胁迫中的作用研究.兰州:兰州大学博士学位论文,2017.
Wang P.The functional study ofCYP86A,a key gene in suberin biosynthesis,involved in plants resisting to salt stress.PhD Thesis.Lanzhou:Lanzhou University,2017.(in Chinese)
[24] Compagnon V,Diehl P,Benveniste I,Meyer D,Schaller H,Schreiber L,Franke R,Pinot F.CYP86B1 is required for very long chain ω-hydroxyacid and α,ω-dicarboxylic acid synthesis in root and seed suberin polyester.Plant Physiology,2009,150(4):1831-1843.
[25] Domergue F,Vishwanath S J,Joubes J,Ono J,Lee J A,Bourdon M,Alhattab R,Lowe C,Pascal S,Lessire R,Rowland O.ThreeArabidopsisfatty acyl-coenzyme a reductases,FAR1,FAR4,and FAR5,generate primary fatty alcohols associated with suberin deposition.Plant Physiology,2010,153(4):1539-1554.
[26] Beisson F,Li Y,Bonaventure G,Pollard M,Ohlrogge J B.The acyltransferase GPAT5 is required for the synthesis of suberin in seed coat and root ofArabidopsis.Plant Cell,2007,19(1):351-368.
[27] Li Y,Beisson F,Ohlrogge J,Pollard M.Monoacylglycerols are components of root waxes and can be produced in the aerial cuticle by ectopic expression of a suberin-associated acyltransferase.Plant Physiology,2007,144(3):1267-1277.
[28] Yang W,Pollard M,Libeisson Y,Beisson F,Feig M,Ohlrogge J.A distinct type of glycerol-3-phosphate acyltransferase with sn-2 preference and phosphatase activity producing 2-monoacylglycerol.Proceedings of the National Academy of Sciences of the United States of America,2010,107(26):12040-12045.
[29] Yang W,Simpson J P,Libeisson Y,Beisson F,Pollard M,Ohlrogge J B.A land-plant-specific glycerol-3-phosphate acyltransferase family inArabidopsis:Substrate specificity,sn-2 preference,and evolution.Plant Physiology,2012,160(2):638-652.
[30] Gou J Y,Yu X H,Liu C J.A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics inArabidopsis.PNAS,2009,106(44):18855-18860.
[31] Kosma D K,Molina I,Ohlrogge J B,Pollard M.Identification of anArabidopsisfatty alcohol:Caffeoyl-coenzyme a acyltransferase required for the synthesis of alkyl hydroxycinnamates in root waxes.Plant Physiology,2012,160(1):237-248.
[32] Gou M,Hou G,Yang H,Zhang X,Cai Y,Kai G,Liu C J.The MYB107 transcription factor positively regulates suberin biosynthesis.Plant Physiology,2017,173(2):1045-1058.
[33] Kosma D K,Murmu J,Razeq F M,Santos P,Bourgault R,Molina I,Rowland O.ATMYB41 activates ectopic suberin synthesis and assembly in multiple plant species and cell types.Plant Journal for Cell & Molecular Biology,2014,80(2):216-229.
[34] Gou M,Hou G,Yang H,Zhang X,Cai Y,Kai G,Liu C J.The MYB107 transcription factor positively regulates suberin biosynthesis.Plant Physiology,2017,173(2):1045-1058.
[35] Serra O,Soler M,Hohn C,Franke R,Schreiber L,Prat S,Molinas M,Figueras M.Silencing ofSTKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration.Journal of Experimental Botany,2009,60(2):697-707.
[36] Serra O,Hohn C,Franke R,Prat S,Molinas M,Figueras M.A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm.Plant Journal,2010,62(2):277-290.
[37] Boher P,Serra O,Soler M,Molinas M,Figueras M.The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids.Journal of Experimental Botany,2013,64(11):3225-3236.
[38] Landgraf R,Smolka U,Altmann S,Eschen-Lippold L,Senning M,Sonnewald S,Weigel B,Frolova N,Strehmel N,Hause G.The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm.Plant Cell,2014,26(8):3403-3415.
[39] Verdaguer R,Soler M,Serra O,Garrote A,Fernández S,Company-Arumí D,Anticó E,Molinas M,Figueras M.Silencing of the potatostNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin.Journal of Experimental Botany,2016,67(18):5415-5427.
[40] Shockey J M,Fulda M S,Browse J A.Arabidopsiscontains nine long-chain acyl-coenzyme a synthetase genes that participate in fatty acid and glycerolipid metabolism.Plant Physiology,2002,129(4):1710-1722.
[41] Schnurr J,Shockey J,Browse J.The acyl-coa synthetase encoded by LACS2 is essential for normal cuticle development inArabidopsis.Plant Cell,2004,16(3):629-642.
[42] Samuels L,Kunst L,Jetter R.Sealing plant surfaces:Cuticular wax formation by epidermal cells.Annual Review of Plant Biology,2008,59(1):683-707.
[43] Millar A A,Kunst L.Very-long-chain fatty acid biosynthesis is controlled through the expression and specificity of the condensing enzyme.Plant Journal,1997,12(1):121-131.
[44] Agrawal V P,Kolattukudy P E.Purification and characterization of a wound-induced omega-hydroxyfatty acid:Nadp oxidoreductase from potato tuber disks (SolanumtuberosumL.).Archives of Biochemistry & Biophysics,1978,191(2):452-465.
[45] Kurdyukov S,Faust A,Nawrath C,Bär S,Voisin D,Efremova N,Franke R,Schreiber L,Saedler H,Métraux J P.The epidermis-specific extracellular bodyguard controls cuticle development and morphogenesis inArabidopsis.Plant Cell,2006,18(2):321-339.
[46] Molina I.Biosynthesis of plant lipid polyesters.The AOCS lipid library.[2018-01-20] http://lipidlibrary.aocs.org/plantbio/polyesters/index.htm.
[47] Benveniste I,Tijet N,Adas F,Philipps G,Salaün J P,Durst F.CYP86A1 fromArabidopsisthaliana encodes a cytochrome P450-dependent fatty acid omega-hydroxylase.Biochemical & Biophysical Research Communications,1998,243(3):688-693.
[48] Rowland O,Domergue F.Plant fatty acyl reductases:Enzymes generating fatty alcohols for protective layers with potential for industrial applications.Plant Science An International Journal of Experimental Plant Biology,2012,193-194(1):28-38.
[49] Mcfarlane H E,Watanabe Y,Yang W,Huang Y,Ohlrogge J,Samuels A L.Golgi- and trans-golgi network-mediated vesicle trafficking is required for wax secretion from epidermal cells.Plant Physiology,2014,164(3):1250-1260.
[50] Pighin J,Zheng H,Balakshin L,Goodman I,Western T,Jetter R,Kunst L,Samuels A.Plant cuticular lipid export requires an ABC transporter.Science,2004,306:702-704.
[51] Choi H,Jin J Y,Choi S,Hwang J U,Kim Y Y,Suh M C,Lee Y.An ABCG/WBC-type ABC transporter is essential for transport of sporopollenin precursors for exine formation in developing pollen.Plant Journal for Cell & Molecular Biology,2011,65(2):181-193.
[52] Soler M,Serra O,Molinas M G,Fluch S,Figueras M.A genomic approach to suberin biosynthesis and cork differentiation.Plant Physiology,2007,144(1):419-431.
[53] Shiono K,Ando M,Nishiuchi S,Takahashi H,Watanabe K,Nakamura M,Matsuo Y,Yasuno N,Yamanouchi U,Fujimoto M.RCN1/OSABCG5,an ATP-binding cassette (ABC) transporter,is required for hypodermal suberization of roots in rice (Oryzasativa).Plant Journal,2014,80(1):40-51.
[54] Kim H,Lee S B,Kim H J,Min M K,Hwang I,Suh M C.Characterization of glycosylphosphatidylinositol-anchored lipid transfer protein 2 (LTPG2) and overlapping function between LTPG/LTPG1 and LTPG2 in cuticular wax export or accumulation inArabidopsisthaliana.Plant & Cell Physiology,2012,53(8):1391-1403.
[55] Huang M D,Chen T L,Huang A H.Abundant type iii lipid transfer proteins inArabidopsistapetum are secreted to the locule and become a constituent of the pollen exine.Plant Physiology,2013,163(3):1218-1229.
[56] Edstam M M,Blomqvist K,Eklöf A,Wennergren U,Edqvist J.Coexpression patterns indicate that gpi-anchored non-specific lipid transfer proteins are involved in accumulation of cuticular wax,suberin and sporopollenin.Plant Molecular Biology,2013,83(6):625-649.
[57] Edstam M M,Edqvist J.Involvement of gpi-anchored lipid transfer proteins in the development of seed coats and pollen inArabidopsisthaliana.Physiologia Plantarum,2014,152(1):32-42.
[58] Deeken R,Saupe S,Klinkenberg J,Riedel M,Leide J,Hedrich R,Mueller T D.The nonspecific lipid transfer protein ATLTPI-4 is involved in suberin formation ofArabidopsisthalianacrown galls.Plant Physiology,2016,172(3):1911-1927.
[59] Yeats T H,Martin L B B,M.-F V H,Tal I,He Y,Zhao L,Matas A J,Buda G J,Domozych D S,Clausen M H.The identification of cutin synthase:Formation of the plant polyester cutin.Nature Chemical Biology,2012,8(7):609-611.
[60] Yeats T H,Huang W,Chatterjee S,Viart H M,Clausen M H,Stark R E,Rose J K.Tomato cutin deficient 1 (CD1) and putative orthologs comprise an ancient family of cutin synthase-like (cus) proteins that are conserved among land plants.Plant Journal,2014,77(5):667-675.
[61] Jakobson L,Lindgren L O,Verdier G,Laanemets K,Brosché M,Beisson F,Kollist H.Bodyguard is required for the biosynthesis of cutin inArabidopsis.New Phytologist,2016,211(2):614-626.
[62] Kolattukudy P E.Biopolyester membranes of plants:Cutin and suberin.Science,1980,208:990-1000.
[63] Bernards M A,Fleming W D,Llewellyn D B,Priefer R,Yang X,Sabatino A,Plourde G L.Biochemical characterization of the suberization-associated anionic peroxidase of potato.Plant Physiology,1999,121(1):135-146.
[64] Lee Y,Rubio M C,Alassimone J,Geldner N.A mechanism for localized lignin deposition in the endodermis.Cell,2013,153(2):402-412.
[65] Legay S,Guerriero G,André C,Guignard C,Cocco E,Charton S,Boutry M,Rowland O,Hausman J F.MDMYB93 is a regulator of suberin deposition in russeted apple fruit skins.New Phytologist,2016,212(4):977-991.
[66] Lashbrooke J G,Cohen H,Levysamocha D,Tzfadia O,Panizel I,Zeisler V,Massalha H,Stern A,Trainotti L,Schreiber L.MYB107 and MYB9 homologs regulate suberin deposition in angiosperms.Plant Cell,2016,28(9):2097-2116.
[67] Krishnamurthy P,Ranathunge K,Franke R,Prakash H S,Schreiber L,Mathew M K.The role of root apoplastic transport barriers in salt tolerance of rice (OryzasativaL.).Planta,2009,230(1):119-134.
[68] Krishnamurthy P,Ranathunge K,Nayak S,Schreiber L,Mathew M.Root apoplastic barriers block Na+transport to shoots in rice (OryzasativaL.).Journal of Experimental Botany,2011,62(12):4215-4228.
[69] Ranathunge K,Schreiber L.Water and solute permeabilities ofArabidopsisroots in relation to the amount and composition of aliphatic suberin.Journal of Experimental Botany,2011,62(6):1961-1974.
[70] Hose E,Clarkson D T,Steudle E,Schreiber L,Hartung W.The exodermis:A variable apoplastic barrier.Journal of Experimental Botany,2001,52:2245-2264.
[71] Clarkson D T,Sanderson J.The uptake of a polyvalent cation and its distribution in the root apices of allium cepa:Tracer and autoradiographic studies.Planta,1969,89(2):136-154.
[72] Jupp A P,Newman E I.Morphological and anatomical effects of severe drought on the roots ofLoliumperenneL.New Phytologist,1987,105(3):393-402.
[73] Henry A,Cal A J,Batoto T C,Torres R O,Serraj R.Root attributes affecting water uptake of rice (Oryzasativa) under drought.Journal of Experimental Botany,2012,63(13):4751-4763.
[74] Baxter I,Hosmani P S,Rus A,Lahner B,Borevitz J O,Muthukumar B,Mickelbart M V,Schreiber L,Franke R B,Salt D E.Root suberin forms an extracellular barrier that affects water relations and mineral nutrition inArabidopsis.Plos Genetics,2009,5(5):188-192.
[75] Hosmani P S,Kamiya T,Danku J,Naseer S,Geldner N,Guerinot M L,Salt D E.Dirigent domain-containing protein is part of the machinery required for formation of the lignin-based casparian strip in the root.Proceedings of the National Academy of Sciences of the United States of America,2013,110(35):14498-14503.
[76] Li B,Kamiya T,Kalmbach L,Yamagami M,Yamaguchi K,Shigenobu S,Sawa S,Danku J M,Salt D E,Geldner N.Role of LOTR1 in nutrient transport through organization of spatial distribution of root endodermal barriers.Current Biology Cb,2017,27(5):758-765.
[77] Tataranni G,Santarcangelo M,Sofo A,Xiloyannis C,Tyerman S D,Dichio B.Correlations between morpho-anatomical changes and radial hydraulic conductivity in roots of olive trees under water deficit and rewatering.Tree Physiology,2015,35(12):1356-1365.
[78] Armstrong W.Aeration in higher plants.Advances in Botanical Research,1979,7:25-332.
[79] Soukup A,Armstrong W,Schreiber L,Franke R.Votrubova O.Apoplastic barriers to radial oxygen loss and solute penetration:A chemical and functional comparison of the exodermis of two wetland species, phragmites australis and glyceria maxima.New Phytologist,2007,173(2):264-278.
[80] Watanabe K,Nishiuchi S,Kulichikhin K,Nakazono M.Does suberin accumulation in plant roots contribute to waterlogging tolerance?Frontiers in Plant Science,2013,4(2):178-184.
[81] Armstrong J,Armstrong W.Rice and phragmites:Effects of organic acids on growth,root permeability,and radial oxygen loss to the rhizosphere.American Journal of Botany,2001,88(8):1359-1370.
[82] Armstrong J,Armstrong W.Rice:sulfide-induced barriers to root radial oxygen loss,Fe2+and water uptake,and lateral root emergence.Annals of Botany,2005,96(4):625-638.
[83] De Simone O,Haase K,Muller E,Junk WJ,Hartmann K,Schreiber L,Schmidt W.Apoplasmic barriers and oxygen transport properties of hypodermal cell walls in roots from four amazonian tree species.Plant Physiology,2003,132(1):206-217.
[84] Garthwaite A J,Bothmer R V,Colmer T D.Diversity in root aeration traits associated with waterlogging tolerance in the genus hordeum.Functional Plant Biology,2003,30(8):875-889.
[85] Garthwaite A J,Armstrong W,Colmer T D.Assessment of O2diffusivity across the barrier to radial O2loss in adventitious roots ofHordeummarinum.New Phytologist,2008,179(2):405-416.
[86] Shiono K,Yamauchi T,Yamazaki S,Mohanty B,Malik A I,Nagamura Y,Nishizawa N K,Tsutsumi N,Colmer T D,Nakazono M.Microarray analysis of laser-microdissected tissues indicates the biosynthesis of suberin in the outer part of roots during formation of a barrier to radial oxygen loss in rice (Oryzasativa).Journal of Experimental Botany,2014,65(17):4795-4806.
[87] Provost G L,Lesur I,Lalanne C,Silva C D,Labadie K,Aury J M,Leple J C,Plomion C.Implication of the suberin pathway in adaptation to waterlogging and hypertrophied lenticels formation in pedunculate oak (QuercusroburL.).Tree Physiology,2017,36(11):1330-1342.
[88] Barberon M,Vermeer J E,Debellis D,Wang P,Naseer S,Andersen T G,Humbel B M,Nawrath C,Takano J,Salt D E.Adaptation of root function by nutrient-induced plasticity of endodermal differentiation.Cell,2016,164(3):447-459.
[89] Lulai E C.Non-wound-induced suberization of tuber parenchyma cells:A physiological response to the wilt disease pathogenVerticilliumdahliae.American Journal of Potato Research,2005,82(6):433-440.
[90] Buskila Y,Tsror L L,Sharon M,Teper-Bamnolker P,Holczer-Erlich O,Warshavsky S,Ginzberg I,Burdman S,Eshel D.Postharvest dark skin spots in potato tubers are an oversuberization response toRhizoctoniasolaniinfection.Phytopathology,2011,101(4):436-444.
[91] Thomas R,Fang X,Ranathunge K,Anderson T R,Peterson C A,Bernards M A.Soybean root suberin:Anatomical distribution,chemical composition,and relationship to partial resistance toPhytophthorasojae.Plant Physiology,2007,144(1):299-311.
[92] Ranathunge K,Thomas R H,Fang X,Peterson C A,Gijzen M,Bernards M A.Soybean root suberin and partial resistance to root rot caused byPhytophthorasojae.Phytopathology,2008,98(11):1179-1189.
[93] Thangavel T,Tegg R S,Wilson C R.Toughing it out-disease-resistant potato mutants have enhanced tuber skin defenses.Phytopathology,2016,106(5):474-483.
[94] Southerton S G,Deverall B J.Histochemical and chemical evidence for lignin accumulation during the expression of resistance to leaf rust fungi in wheat.Physiological & Molecular Plant Pathology,1990,36(6):483-494.
[95] Quiroga M,Guerrero C,Botella M A,Barceló A,Amaya I,Medina M I,Alonso F J,De Forchetti S M,Tigier H,Valpuesta V.A tomato peroxidase involved in the synthesis of lignin and suberin.Plant Physiology,2000,122(4):1119-1127.
[96] Naseer S,Geldner N.Casparian strip diffusion barrier inArabidopsisis made of a lignin polymer without suberin.Proceedings of the National Academy of Sciences of the United States of America,2012,109(25):10101-10106.
[97] 林子然,张英俊.丛枝菌根真菌和磷对干旱胁迫下紫花苜蓿幼苗生长与生理特征的影响.草业科学,2018,35(1):115-122.
Lin Z R,Zhang Y J.Effect of arbuscular mycorrhizal fungi and phosphoruson growth and physiological properties of alfalfa seedlings under drought stress.Pratacultural Science,2018,35(1):115-122.(in Chinese)
