蛋氨酸限制和胶原蛋白肽对高脂饮食小鼠脂代谢和氧化应激的联合作用
2018-05-25王雅楠张佳红郭海涛乐国伟施用晖
王雅楠,张佳红,郭海涛,乐国伟,2,*,施用晖,2
肥胖是由机体能量摄入量大于能量消耗量引起的一种慢性营养代谢失调症,特别是高能量摄入以及低能量支出更易引发肥胖[1]。目前肥胖的发病率正以指数形式增加,已经成为了全球面临的最严重的健康和经济问题[2]。大量研究表明,长期高脂饮食使活性氧(reactive oxygen species,ROS)过量生成,机体氧化还原平衡被打破,引起脂质过氧化,诱发脂代谢紊乱和肥胖,并导致心血管疾病、癌症等的发生[3]。因此,研究如何有效控制和改善高脂饮食诱发肥胖的方法成为热点,除了手术和药物等方法外,人们更加关注饮食方式干预的方法,一方面是通过饮食中营养成分的限制,近20 年来饮食蛋氨酸限制(methionine restriction,MR)引起了广泛的关注,因为饮食MR不需要进行食物限制,就可以减少机体脂肪的积累[4-5],增加能量支出和代谢的灵活性[6],增加胰岛素敏感性,改善脂类代谢[7],降低炎症反应[8],并且可以显著延长多种生物体的寿命[9-11];另一方面是通过生物活性物质的添加,大量研究表明,饮食中添加生物活性物质可以抑制高脂饮食诱导的肥胖,减少机体氧化应激及脂代谢的失调[12-14]。研究报道胶原蛋白肽具有抗氧化、抑制血压上升、减缓动脉硬化和预防骨质疏松等功能[15],李亚欣等[16]研究也表明胶原蛋白肽可有效提高小鼠机体抗氧化能力,缓解高脂饮食造成的氧化应激,改善血脂代谢。C57BL/6小鼠饮食MR可以抵抗饮食诱导的肥胖和胰岛素抵抗,但是小鼠具有较低的骨密度[7],研究报道胶原蛋白肽可以改善骨密度和骨质疏松[17-18]。胶原蛋白肽联合MR对于骨小梁的厚度及单位骨强度的改善作用已有研究,但是饮食MR与生物活性物质胶原蛋白肽,对高脂饮食条件下肝脏氧化应激及脂代谢是否具有更好的改善作用鲜有报道。本实验以C57BL/6小鼠为研究对象,利用高脂饮食研究饮食MR和胶原蛋白肽的联合作用对于小鼠氧化还原状态和脂代谢的影响,为肥胖脂代谢和氧化还原状态的失衡提供营养学干预的参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级4 周龄雄性C57BL/6小鼠:SCXK(苏)2015-0001,初始体质量为18~20 g,购自南京生物医药研究院。
蛋氨酸(食品级,蛋氨酸质量分数99.93%)、猪骨胶原蛋白肽(食品级,纯度99%)均为市售;总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)试剂盒、游离脂肪酸(free fatty acid,FFA)试剂盒、苏木素-伊红(hematoxylin and eosin,HE)染色液、油红O染色液 南京建成生物工程研究所;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C) 上海丰汇医学科技股份有限公司;BCA蛋白质量浓度测定试剂盒(增强型)、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)碧云天生物技术研究所;Trizol 美国Biomiga公司;M-MLV逆转录酶、5×逆转录缓冲液 美国Promega公司;RNase抑制剂 南京生兴生物技术有限公司;Oligo(dT)、基因引物 上海捷瑞生物工程公司;SYBR Green Master Mix 南京诺唯赞生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
Epoch微孔板分光光度计 美国BioTek公司;5804R台式高速冷冻离心机 德国Eppendorf公司;7900HT Fast实时荧光定量聚合酶链反应(quantitative real time polymerase chain reaction,qPCR)仪 美国ABI公司;超微量分光光度计 上海采邑生物科技有限公司;超低温冷冻冰箱 美国Thermo Scientific公司;ETC811 PCR仪 东胜兴业科学仪器有限公司。
1.3 方法
1.3.1 动物饲喂及分组
将36 只SPF级雄性C57BL/6小鼠用正常饲料预饲喂1 周后,按体质量随机分为4 组,每组9 只:1)低脂正常蛋氨酸饮食组(ND组):饲料中含4%(质量分数,下同)脂肪、0.86%蛋氨酸;2)高脂正常蛋氨酸饮食组(HF组):饲料中含20%脂肪、0.86%蛋氨酸;3)高脂蛋氨酸限制饮食组(MR组):饲料中含20%脂肪、0.17%蛋氨酸;4)高脂蛋氨酸限制与1%胶原蛋白肽联合作用饮食组(PMR组):饲料中含20%脂肪、0.17%蛋氨酸、1%胶原蛋白肽。饲料配方见表1。实验小鼠饲养于SPF级动物房,同室分笼,每组3 笼,每笼3 只,环境温度控制在(23±2)℃,相对湿度60%,12 h/12 h昼夜循环光照,保持饲养环境卫生。所有实验小鼠均自由摄食和饮水,每周称量并记录体质量。

表1 饲料中各成分的质量分数Table 1 Compositions of experimental diets%
1.3.2 血液、组织样品采集及肝脏指标的测定
每周称体质量一次,22 周后,小鼠宰杀前禁食12 h,称体质量后摘眼球取血入抗凝管中,4 ℃、3 000 r/min离心10 min,取上层血浆,-80 ℃保存备用。断颈处死,在冰浴上迅速取肝脏,精确称质量并记录,并按照下式计算肝脏指数。
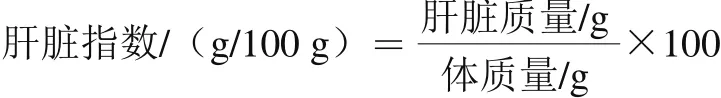
取部分肝脏组织加入预冷的生理盐水,匀浆制得质量浓度为0.1 g/mL的组织匀浆,测定ROS后3 000 r/min离心10 min后取上清液,-20 ℃保存用于测定抗氧化水平;取100 mg左右肝脏组织置于Trizol试剂中,剪碎,-80 ℃保存,用于总RNA的提取;取部分肝组织浸入质量浓度为40 g/L多聚甲醛溶液中固定,4 ℃保存备用;另取相同部位,相同大小肝组织用OCT包埋剂(聚乙二醇和聚乙烯醇水溶性混合液)包埋,液氮速冻后转至-80 ℃冻存,以备冷冻切片的制作。
T-AOC、MDA和GSH-Px水平的测定均严格按照试剂盒说明书进行操作。
将50 mg小鼠冻存肝脏组织置于具有1 mL异丙醇中匀浆并进行超声处理,匀浆经2 000×g离心,取上清液,严格按照TC和TG试剂盒测定肝脏TC和TG浓度。
1.3.3 肝脏HE和油红O染色
HE染色:甲醛固定后的肝脏组织进行乙醇梯度脱水,二甲苯透明,浸入石蜡包埋,预冷后切片(厚度5 μm)。严格按照试剂盒说明书将切片进行HE染色,滴少许中性树胶封片,自然通风晾干,收集并镜检(200×)。
油红O染色:将-80 ℃下OCT包埋备用的肝组织样品固定在速冻台上,调整合适的距离,切片厚度设为9 μm。严格按照试剂盒说明书进行进行油红O染色,染色后滴适量水性固定液封片,自然通风晾干,收集并镜检(200×)。用Image-Pro图像软件进行分析,计算肝脏脂肪浸润面积占整个视野面积的比例。
1.3.4 血浆指标测定
T-AOC、ROS、MDA、GSH-Px、TG、TC、HDL、LDL和FFA水平均按照试剂盒说明书进行操作。
1.3.5 肝脏总RNA的提取及反转录
用Trizol法提取肝脏中的总RNA,然后加入适量DEPC水稀释,通过测定溶液吸光度A260nm/A280nm比值确定所得RNA的纯度,测得A260nm/A280nm在1.8~2.0时可用于下一步实验。
取2.0 μg模板RNA,加入Oligo(dT) 2.0 μL、dNTP 2.0 μL、DEPC水4 μL,于70 ℃中水浴5 min,然后置于冰上冷却;加入5×逆转录缓冲液5.0 μL、M-MLV逆转录酶0.5 μL、RNase抑制剂0.25 μL、DEPC水9.25 μL。扩增条件为:37 ℃,1.5 h;95 ℃,5 min;4 ℃冷却。反转录所得cDNA于-20 ℃存放备用。
1.3.6 qPCR扩增
根据试剂盒说明书,以β-肌动蛋白为内标,测定脂肪酸合成酶(fatty acid synthase,FAS)、乙酰辅酶A羧化酶(acetyl CoA-carboxylase 1,ACC-1)、固醇调节元件结合蛋白1c(sterol regulatory element-binding protein 1c,SREBP1c)、胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)、对肉碱酰基转移酶1(carnitine palmityl transferase 1,CPT1)和过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)mRNA的表达量,引物如表2所示。

表2 qPCR引物序列Table 2 Sequences of primers used for qPCR
使用ABI 7900 HT FAST qPCR仪检测各模板的Ct值,通过2-△△Ct法计算,进行相对定量,反应体系如下:取0.5 μL cDNA模板,加入0.4 μL上游引物(10 μmol/L)、0.4 μL下游引物(10 μmol/L)、5.0 μL SYBR Green Master Mix和3.7 μL无菌水,形成10 μL体系。扩增条件如下:95 ℃预变性5 min,95 ℃变性20 s,62 ℃退火30 s,72 ℃延伸20 s,以上步骤循环40 次;72 ℃终末延伸2 min;4 ℃冷却恒定。
1.4 数据统计分析
采用SPSS 17.0软件对数据进行方差分析和独立样本t检验,实验均设9 组平行,结果以 ±s表示,P<0.05或P<0.01时,判断组间差异具有统计学意义。
2 结果与分析
2.1 饮食MR和胶原蛋白肽对高脂饮食小鼠体质量的影响
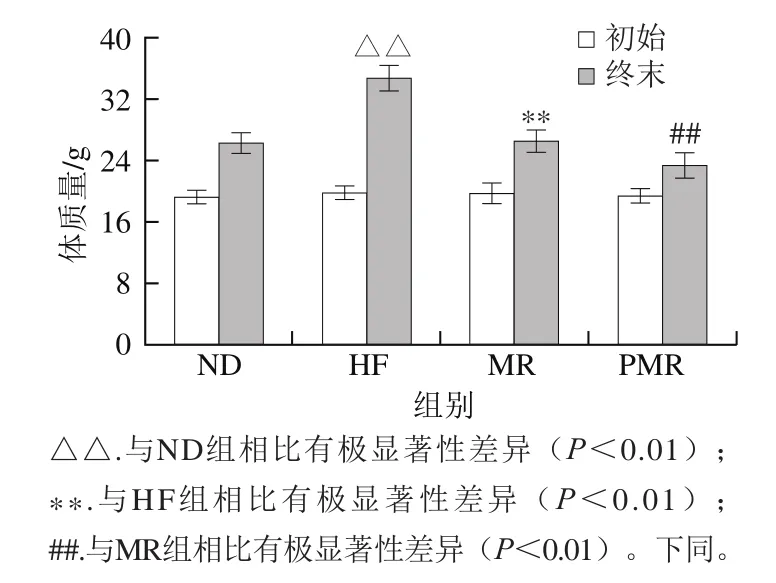
图1 蛋氨酸限制及胶原蛋白肽的干预对高脂饮食小鼠体质量的影响Fig. 1 Effects of MR and collagen peptides on body weight in HFD-fed mice
由图1可知,各组小鼠初始体质量没有显著性差异(P>0.05)。至第22周实验结束时,与ND组相比,HF组小鼠体质量极显著增加(P<0.01);与HF组相比,MR组小鼠体质量极显著降低(P<0.01);与MR组相比,PMR组小鼠体质量极显著降低(P<0.01)。
2.2 饮食MR和胶原蛋白肽对高脂饮食小鼠采食量的影响
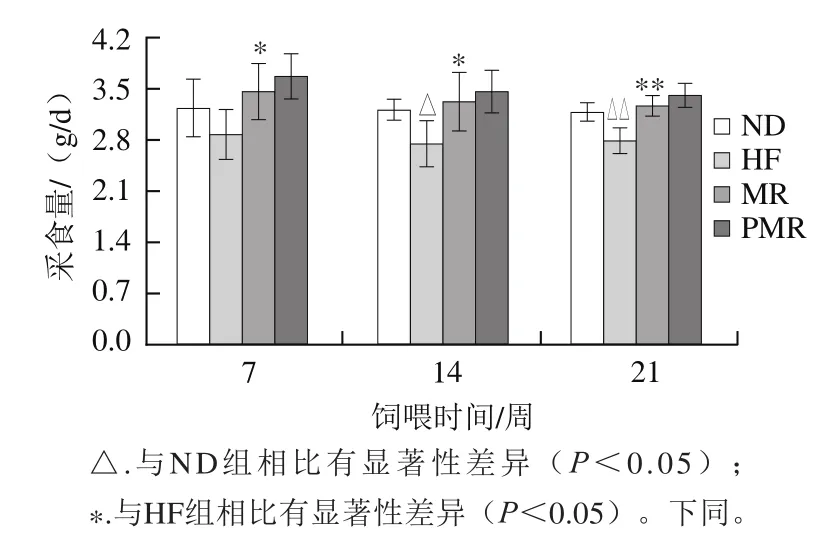
图2 蛋氨酸限制及胶原蛋白肽的干预对高脂饮食小鼠采食量的影响Fig. 2 Effects of MR and collagen peptides on food intake of HFD-fed mice
由图2可知,与ND组相比,HF组小鼠在第14周采食量显著降低(P<0.05),第21周采食量极显著降低(P<0.01);与HF组相比,MR组小鼠在第7周和第14周采食量显著增加(P<0.05),第21周极显著增加(P<0.01);与MR组相比,PMR组小鼠采食量在各周期无显著性差异(P>0.05)。
2.3 饮食MR和胶原蛋白肽对高脂饮食小鼠肝脏质量和肝脏指数的影响

图3 蛋氨酸限制及胶原蛋白肽的干预对高脂饮食小鼠肝脏质量(A)及肝脏指数(B)的影响Fig. 3 Effects of MR and collagen peptides on liver weight (A) and index (B) in HFD-fed mice
由图3可知,与ND组相比,HF组小鼠肝脏质量极显著增加(P<0.01),肝脏指数无显著性差异(P>0.05);与HF组相比,MR组极显著降低了高脂饮食小鼠的肝脏质量(P<0.01),肝脏指数有下降趋势,但无显著性差异(P>0.05);与MR组相比,PMR组小鼠肝脏质量极显著降低(P<0.01),肝脏指数有下降趋势,但没有显著性差异(P>0.05)。
2.4 饮食MR和胶原蛋白肽对高脂饮食小鼠肝脏组织形态的影响
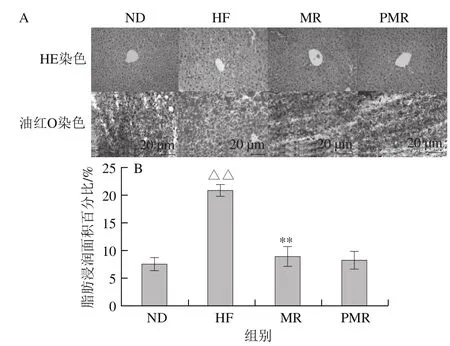
图4 HE和油红O染色(A)及油红O染色中脂肪浸润面积百分比(B)Fig. 4 HE and oil red O staining (A) and lipid accumulation of liver tissue (B) in HFD-fed mice
由图4A可知,HF组小鼠肝脏脂肪大量囤积,肝细胞体积膨大,细胞内明显发生脂肪变性;ND组、MR组和PMR组小鼠肝细胞形态结构清晰完整、排列紧密,细胞内有极少量脂肪空泡。肝脏冷冻切片经油红O染色,通过Image-Pro图像分析软件测量冷冻切片相同视野中脂肪细胞浸润所占比例,量化肝脏脂肪积累的情况。由图4B可知,与ND组相比,HF组小鼠肝脏脂肪浸润面积百分比极显著增加(P<0.01);与HF组相比,MR组小鼠肝脏脂肪浸润面积百分比极显著降低(P<0.01);与MR组相比,PMR组小鼠肝脏脂肪浸润面积百分比无显著性差异(P>0.05)。
2.5 饮食MR和胶原蛋白肽对高脂饮食小鼠肝脏TG和TC浓度的影响

图5 蛋氨酸限制及胶原蛋白肽的干预对高脂饮食小鼠肝脏TG(A)及TC(B)浓度的影响Fig. 5 Effects of MR and collagen peptides on TG (A) and TC (B)levels in liver of HFD-fed mice
由图5可知,与ND组相比,HF组小鼠肝脏TG和TC
浓度极显著增加(P<0.01);与HF组相比,MR组小鼠肝脏TG和TC浓度极显著降低(P<0.01);与MR组相比,PMR组小鼠肝脏TG浓度极显著下降(P<0.01),
TC浓度无显著性差异(P>0.05)。
2.6 饮食MR和胶原蛋白肽对高脂饮食小鼠血脂的影响

表3 蛋氨酸限制及胶原蛋白肽对高脂饮食小鼠血脂的影响Table 3 Effects of MR and collagen peptides on plasma lipid profile of HFD-fed mice mmol/L
由表3可知,与ND组相比,HF组小鼠血浆TG、TC和FFA浓度极显著增加(P<0.01),LDL浓度显著增加(P<0.05),HDL浓度显著降低(P<0.05);与HF组相比,MR组小鼠血浆TC和LDL浓度极显著下降(P<0.01),TG和FFA浓度显著下降(P<0.05),HDL浓度极显著增加(P<0.01);与MR组相比,PMR组小鼠血浆TG和TC浓度显著下降(P<0.05),HDL、LDL和FFA浓度没有显著性差异(P>0.05)。
2.7 饮食MR和胶原蛋白肽对高脂饮食小鼠脂代谢相关基因表达的影响
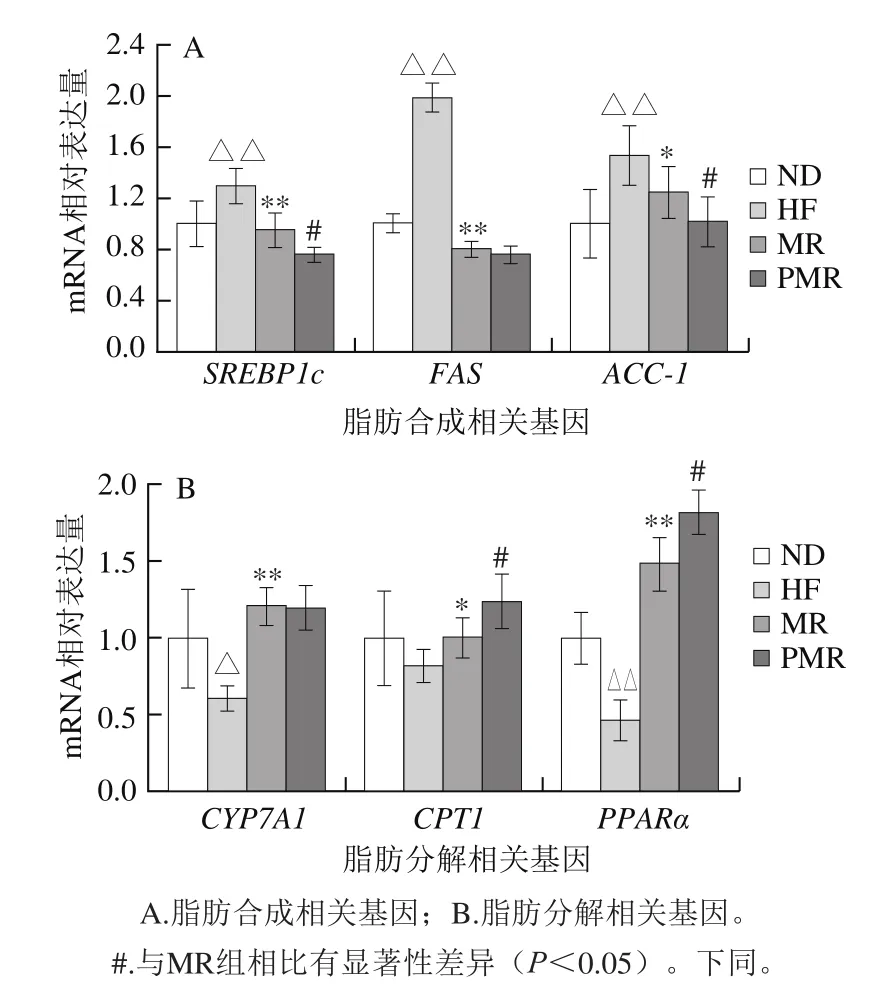
图6 蛋氨酸限制及胶原蛋白肽对高脂饮食小鼠脂代谢相关基因的影响Fig. 6 Effects of MR and collagen peptides on the expression of key lipid metabolism genes in liver
由图6可知,与ND组相比,HF组小鼠肝脏脂肪合成相关基因SREBP1c、FAS和ACC-1 mRNA表达极显著上调(P<0.01),脂肪分解相关基因CYP7A1 mRNA表达显著下调(P<0.05),PPARα mRNA表达极显著下调(P<0.01);与HF组相比,MR组小鼠肝脏脂肪合成相关基因FAS和SREBP1c mRNA表达极显著下调(P<0.01),ACC-1 mRNA表达显著下调(P<0.05),脂肪分解相关基因CYP7A1和PPARα mRNA表达极显著上调(P<0.01),CPT1 mRNA表达显著上调(P<0.05);与MR组相比,PMR组小鼠肝脏脂肪合成相关基因SREBP1c和ACC-1 mRNA表达显著下调(P<0.05),FAS mRNA表达无显著性差异(P>0.05),脂肪分解相关基因CPT1和PPARα mRNA表达显著上调(P<0.05),CYP7A1 mRNA表达无显著性差异(P>0.05)。
2.8 饮食MR和胶原蛋白肽对高脂饮食小鼠肝脏氧化还原指标的影响

表4 蛋氨酸限制和胶原蛋白干预对小鼠肝脏氧化还原状态的影响Table 4 Effects of MR and collagen peptides on hepatic redox indicators in HFD-fed mice
由表4可知,与ND组相比,HF组小鼠肝脏T-AOC和GSH-Px活力极显著降低(P<0.01),ROS和MDA含量极显著增加(P<0.01);与HF组相比,MR组小鼠肝脏T-AOC和GSH-Px活力显著增加(P<0.05),ROS和MDA含量极显著降低(P<0.01);与MR组相比,PMR组小鼠肝脏GSH-Px活力显著增加(P<0.05),T-AOC、MDA和ROS含量无显著性差异(P>0.05)。
2.9 饮食MR和胶原蛋白肽对高脂饮食小鼠血浆和血液氧化还原指标的影响
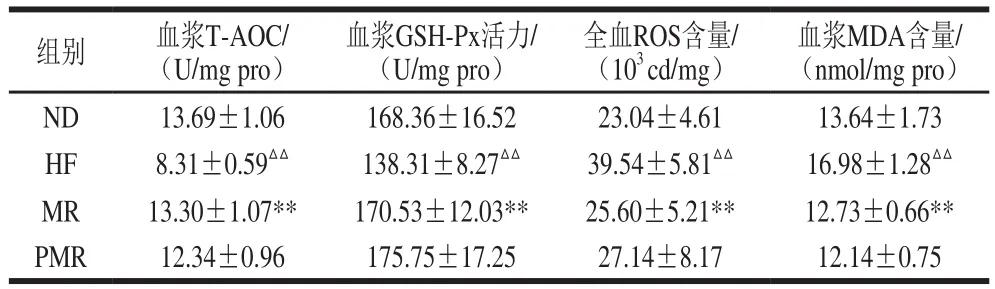
表5 蛋氨酸限制和胶原蛋白干预对小鼠血浆和血液氧化还原状态的影响Table 5 Effects of MR and collagen peptides on redox indicators of plasma and blood in HFD-fed mice
由表5可知,与ND组相比,HF组小鼠血浆T-AOC和GSH-Px活力极显著降低(P<0.01),全血ROS和血浆MDA含量极显著增加(P<0.01);与HF相比,MR组小鼠血浆T-AOC和GSH-Px活力极显著增加(P<0.01),全血ROS和血浆MDA含量极显著降低(P<0.01);与MR相比,PMR组小鼠血浆T-AOC、GSH-Px活力、MDA含量和全血ROS含量无显著性差异(P>0.05)。
3 讨 论
本研究显示,饮食MR显著抑制了高脂饮食小鼠体质量的增加,此结果与Malloy[4]、Ables[7]等研究结果一致。相比饮食MR,饮食MR和胶原蛋白肽的联合作用显著降低了小鼠体质量的增长,对高脂饮食小鼠体质量的降低有更显著的效果。
肥胖患者一般都存在脂代谢紊乱,脂代谢紊乱最直观的表现就是血脂(包括TC、TG、HDL-C和LDL-C等)异常。脂类的消化、吸收、运输、分解代谢和合成代谢,都与肝脏有着密切的关系[19],血浆中脂质的变化通常预示肝脏脂肪的生成或分解的变化。研究表明饮食MR除了可以显著降低血浆TG和TC的水平[4],还可以显著减少小鼠[20]和大鼠[21]肝脏脂肪的积累。本实验结果证实了饮食MR可以显著降低血浆和肝脏TG和TC的含量、血浆LDL-C和FFA水平,显著增加血浆HDL-C含量。胶原蛋白肽对于脂类代谢调控的积极作用也已经有实验证实[16]。相比饮食MR组,饮食PMR组血浆TG和TC含量显著下降,肝脏TG含量显著下降,说明饮食MR和胶原蛋白联合作用能够更显著改善高脂饮食小鼠血脂的异常和脂代谢的紊乱。
动物脂肪代谢与脂肪的合成、分解过程息息相关。有研究表明,饮食MR调控脂代谢合成和分解基因,改善肝脏脂代谢[22]。本实验研究也证实饮食MR可以显著下调小鼠肝脏脂肪合成相关基因(FAS、ACC-1和SREBP1c)的表达,显著上调脂肪分解相关基因(CYP7A1、CPT1和PPARα)的表达。相比饮食MR组,饮食PMR组血浆TG和TC含量显著降低,肝脏TG水平显著下降,其原因一方面与脂肪合成相关基因(SREBP1c和ACC-1)表达显著下调有关,SREBP1c是重要的核转录因子之一,能与脂质合酶基因的启动子/增强子的固醇调节元件结合,激活靶基因转录,特异性调控胆固醇和脂肪酸代谢[23-24];ACC-1是脂肪酸合成限速酶,催化脂肪酸合成的第一步反应[25]。通过下调ACC-1和SREBP1c的mRNA表达,说明饮食MR和胶原蛋白肽联合作用可以下调脂肪合成相关基因,在转录水平进一步抑制了肝脏脂肪的合成,进而抑制血脂的升高;另一方面与PMR组脂肪分解相关基因(PPARα和CPT1)的显著上调有关。PPARα作为过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)中的一个亚型,激活后可调节包括脂肪酸摄取、结合、氧化及脂质运输在内的许多基因的表达,可有效改善血脂状况,调节脂质代谢平衡[26]。CPT-1是脂肪酸氧化的限速酶,可以使长链的乙酰辅酶A进入线粒体,促进脂肪酸β氧化[27],通过PPARα和CPT1表达的显著上调,在转录水平刺激β氧化,降低脂肪酸的水平,抑制TG合成,可能进一步降低体质量的增长,抑制高脂饮食条件下肥胖的发生。而CPT1和PPARα作为腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)的下游基因,可能通过激活AMPK途径,AMPK还可以通过抑制ACC-1的活性,减少丙二酰辅酶A的生成,从而解除丙二酰辅酶A对CPT1的抑制作用,抑制合成途径的同时激活分解途径,与机体肝脏脂肪变性有密切的关系,MR与胶原蛋白肽的联合作用对于AMPK途径的影响还需要进一步验证。
越来越多研究表明,高脂饮食的摄取和脂肪组织的积聚可以显著增加机体的氧化应激水平[28]。ROS和MDA水平的显著增加,阻碍了线粒体对脂肪酸的氧化产能,导致血脂代谢异常,脂肪酸调节失衡。已经有研究证实饮食MR可以显著改善高脂饮食条件下机体氧化还原状态的失衡[29],本实验研究表明饮食MR可以显著提高高脂饮食小鼠肝脏组织和血浆中T-AOC和GSH-Px的活力,降低血浆过氧化脂质产物MDA含量和全血ROS含量,也说明MR可以显著降低高脂饮食小鼠的氧化应激反应,提高机体的抗氧化能力;相比饮食MR,饮食MR和胶原蛋白的联合作用可以显著提高肝脏组织GSH-Px的活力,说明饮食MR和胶原蛋白的联合作用可能可以更有效改善高脂饮食诱导的氧化应激,促进机体抗氧化能力的提高,但其确切机制还需要进一步研究。
综上所述,本研究表明,饮食MR具有降低高脂饮食小鼠体质量、血脂和肝脏脂肪积累,调节氧化应激的作用;而饮食MR和胶原蛋白的联合作用对于高脂饮食小鼠体质量、血脂水平和肝脏脂肪积累的降低作用优于饮食MR的单独作用。因此饮食MR和胶原蛋白肽的联合作用,对于肥胖的预防和控制具有非常重要的研究价值和广阔的应用前景。
参考文献:
[1] REDINGER R N. Fat storage and the biology of energy expenditure[J].Translational Research, 2009, 154(2): 52-60. DOI:10.1016/j.trsl.2009.05.003.
[2] NG M, FLEMING T, ROBINSON M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980—2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. The Lancet, 2014, 384: 766-781. DOI:10.1016/S0140-6736(14)60460-8.
[3] 李兴太, 纪莹. 线粒体氧化应激与天然抗氧化剂研究进展[J]. 食品科学, 2015, 36(7): 268-277. DOI:10.7506/spkx1002-6630-201507049.
[4] MALLOY V L, KRAJCIK R A, BAILEY S J, et al. Methionine restriction decreases visceral fat mass and preserves insulin action in aging male Fischer 344 rats independent of energy restriction[J]. Aging Cell, 2006, 5(4): 305-314. DOI:10.1111/j.1474-9726.2006.00220.x.
[5] PERRONE C E, MATTOCKS D A L, JARVIS-MORAR M, et al.Methionine restriction effects on mitochondrial biogenesis and aerobic capacity in white adipose tissue, liver, and skeletal muscle of F344 rats[J].Metabolism, 2010, 59(7): 1000-1011. DOI:10.1016/j.metabol.2009.10.023.
[6] HASEK B E, STEWART L K, HENAGAN T M, et al. Dietary methionine restriction enhances metabolic flexibility and increases uncoupled respiration in both fed and fasted states[J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2010, 299(3): 728-739. DOI:10.1152/ajpregu.00837.2009.[7] ABLES G P, PERRONE C E, ORENTREICH D, et al. Methioninerestricted C57BL/6J mice are resistant to diet-induced obesity and insulin resistance but have low bone density[J]. PLoS ONE, 2012,7(12): 1-12. DOI:10.1371/journal.pone.0051357.
[8] WANDERS D, GHOSH S, STONE K P, et al. Transcriptional impact of dietary methionine restriction on systemic inflammation: relevance to biomarkers of metabolic disease during aging[J]. Biofactors, 2014,40(1): 13-26. DOI:10.1002/biof.1111.
[9] ORGERON M L, STONE K P, WANDERS D, et al. The impact of dietary methionine restriction on biomarkers of metabolic health[J].Progress in Molecular Biology and Translational Science, 2014, 121:351-376. DOI:10.1016/B978-0-12-800101-1.00011-9.
[10] ORENTREICH N, MATIAS J R, DEFELICE A, et al. Low methionine ingestion by rats extends life span[J]. Journal of Nutrition, 1993,123(2): 269-274.
[11] JOHNSON J E, JOHNSON F B. Methionine restriction activates the retrograde response and confers both stress tolerance and lifespan extension to yeast, mouse and human cells[J]. PLoS ONE, 2014, 9(5):e97729. DOI:10.1371/journal.pone.0097729.
[12] 朱科学, 聂少平, 宋丹, 等. 黑灵芝多糖对Ⅱ型糖尿病大鼠血糖、血脂及肠系膜上动脉病变改善作用[J]. 食品科学, 2013, 34(23): 300-304. DOI:10.7506/spkx1002-6630-201323060.
[13] 刘冠星, 韩宁宁, 马海田. 藤黄果提取物对雄性大鼠脂代谢的影响及降脂机理[J]. 食品科学, 2015, 36(9): 202-208. DOI:10.7506/spkx1002-6630-201509038.
[14] 赵利, 苏伟, 胡火根, 等. 胶原蛋白生物活性肽的研究进展[J]. 食品科学, 2005, 26(9): 560-564.
[15] 周先艳, 樊建, 唐远龙, 等. 罗非鱼皮胶原蛋白水解产物的体外抗氧化活性和体内抗衰老作用[J]. 食品科学, 2016, 37(15): 221-226.DOI:10.7506/spkx1002-6630-201615037.
[16] 李亚欣, 施用晖, 王洁昀, 等. 胶原蛋白肽对高脂日粮小鼠抗氧化能力和血脂代谢的影响[J]. 天然产物研究与开发, 2011, 23(1): 54-58; 68.
[17] 张鹤, 赵雨, 徐云凤, 等. 鹿骨胶原蛋白对去卵巢所致骨质疏松大鼠的治疗作用[J]. 中药药理与临床, 2011(5): 76-79. DOI:10.13412/j.cnki.zyyl.2011.05.027.
[18] GUILLERMINET F, BEAUPIED H, FABIEN-SOULE V, et al.Hydrolyzed collagen improves bone metabolism and biomechanical parameters in ovariectomized mice: an in vitro and in vivo study[J].Bone, 2010, 46(3): 827-834. DOI:10.1016/j.bone.2009.10.035.
[19] PONZIANI F R, PECERE S, GASBARRINI A, et al. Physiology and pathophysiology of liver lipid metabolism[J]. Expert Review of Gastroenterology & Hepatology, 2015, 9(8): 1055-1067. DOI:10.1586/17474124.2015.1056156.
[20] ANTHONY T G, MORRISON C D, DGETTYS T W. Remodeling of lipid metabolism by dietary restriction of essential amino acids[J].Diabetes, 2013, 62(8): 2635-2644. DOI:10.2337/db12-1613.
[21] HASEK B E, BOUDREAU A, SHIN J, et al. Remodeling the integration of lipid metabolism between liver and adipose tissue by dietary methionine restriction in rats[J]. Diabetes, 2013, 62(10): 3362-3372. DOI:10.2337/db13-0501.
[22] ZHOU X H, HE L Q, WAN D, et al. Methionine restriction on lipid metabolism and its possible mechanisms[J]. Amino Acids, 2016, 48(7):1533-1540. DOI:10.1007/s00726-016-2247-7.
[23] HORTON J D, GOLDSTEIN J, LBROWN M S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver[J]. Journal of Clinical Investigation, 2002, 109(9): 1125-1131.DOI:10.1172/JCI15593.
[24] WANG Y, VISCARRA J, KIM S J, et al. Transcriptional regulation of hepatic lipogenesis[J]. Nature Reviews Molecular Cell Biology, 2015,16(11): 678-689. DOI:10.1038/nrm4074.
[25] WAKIL S J, ABU-ELHEIGA L A. Fatty acid metabolism: target for metabolic syndrome[J]. Journal of Lipid Research, 2009, 50(Suppl 1):138-143. DOI:10.1038/nrm4074.
[26] PERRONE C E, MALLOY V L, ORENTREICH D S, et al. Metabolic adaptations to methionine restriction that benefit health and lifespan in rodents[J]. Experimental Gerontology, 2013, 48(7): 654-660.DOI:10.1016/j.exger.2012.07.005.
[27] SCHLAEPFER I R, RIDER L, RODRIGUES L U, et al. Lipid catabolism via CPT1 as a therapeutic target for prostate cancer[J].Molecular Cancer Therapeutics, 2014, 13(10): 2361-2371.DOI:10.1158/1535-7163.MCT-14-0183.
[28] MILAGRO F I, CAMPIÓN J, MARTÍNEZ J A. Weight gain induced by high-fat feeding involves increased liver oxidative stress[J].Obesity, 2006, 14(7): 1118-1123. DOI:10.1038/oby.2006.128.
[29] SANCHEZ-ROMAN I, BARJA G. Regulation of longevity and oxidative stress by nutritional interventions: role of methionine restriction[J]. Expimental Gerontology, 2013, 48(10): 1030-1042.DOI:10.1016/j.exger.2013.02.021.
