碳酸钠碱性介质氧脱木素促进火炬松酶解糖化的研究
2018-05-25张雨情吴淑芳HasanJameelHouminChang
张雨情 吴淑芳,* Hasan Jameel Houmin Chang
(1. 南京林业大学江苏省制浆造纸科学与技术重点实验室,江苏南京,210037;2.北卡州立大学林业生物材料系,美国罗利,27695)
木质纤维原料是地球上储量最丰富的可再生资源。利用木质纤维原料生产生物质乙醇的研究受到了广泛关注[1- 5]。制备生物质乙醇首先需将木质纤维原料转化为可发酵单糖,再将单糖进一步发酵转化为乙醇。其中纤维素酶水解法是将木质纤维原料中的聚糖转化为可发酵单糖的最有效方法之一,为了提高酶解效率,酶解前须对木质纤维原料进行预处理,以增加酶对纤维素底物的可及度,同时适当除去木质素等影响纤维素酶对底物作用的障碍。酶解效率的高低直接影响生物质乙醇工业化生产的经济可行性,而预处理效果直接影响酶解效率,因此预处理技术直接和间接影响着生物质乙醇生产的经济性,是生产生物质乙醇非常重要的一个环节。过去几十年,人们对木质纤维原料预处理以及酶解技术进行了大量的研究,并且取得了较大的进展[6]。尽管如此,目前仍然存在酶解底物转化不完全、原料中聚糖至可发酵单糖提取率低等问题。
木质纤维原料特别是针叶材,由于复杂的形态结构和化学组成,造成了其天然的抗生物降解特性,因此,酶解前有效的预处理对于提高酶解效率尤为重要。目前对于针叶材的预处理研究主要有酸水解[7]、湿氧化[8]、蒸汽爆破[9]、SO2处理[10]、氧脱木素[11- 12]、催化处理[13]、有机溶剂处理[14]、氨水浸泡[15]、亚硫酸盐处理[16]、碱处理[17]和超临界二氧化碳预处理[18]等方法。这些预处理方法均能够不同程度提高酶解效率,但与阔叶材和其他木质纤维原料相比,其单糖提取率仍然偏低,导致总的生产成本偏高而难于实现工业化规模生产。有些处理方法甚至还产生废液,增加处理消耗,使整个工艺过程变得复杂。碱法预处理如硫酸盐预处理和绿液预处理是可操作性较强的针叶材预处理方法[19],不仅能有效脱出部分木素,且蒸煮废液碱回收工艺成熟,绿液蒸煮甚至还可使碱回收工艺简化[11,19]。适当程度的碱法蒸煮结合氧脱木素处理可有效提高酶解效率[17],尤其是,采用适宜的氧脱木素工艺可使碳水化合物损失较少,提高单糖提取率。本研究是在传统的氧脱木素方法的基础上,采用碳酸钠作为氧脱木素的碱性介质,通过延长氧脱木素时间,优化氧脱木素工艺,以期达到更高的木素脱出率和更好的脱木素选择性,从而通过后续酶解提高原料中聚糖至可发酵单糖的转化率。
1 实 验
1.1 原料和试剂
火炬松木片由美国南方某工厂提供。首先对木片进行筛选,选取尺寸为9.5~15.9 mm的木片用于本实验,实验所有化学药品均为分析纯试剂。
1.2 蒸煮
蒸煮在7 L 的M/K 蒸煮器内进行(M/K Systems Inc., Danvers, MA)。硫酸盐法(KP)蒸煮最高温度170℃,用碱量14%(以Na2O计),硫化度25%,液比1∶4,H因子600;绿液法(GL)蒸煮最高温度160℃,用碱量20%(以Na2O计),硫化度40%,液比1∶4,H因子800。蒸煮后的浆料用自来水充分洗涤后盘磨(缝隙0.13 mm)解离、0.2 mm缝隙筛浆机筛选,所得筛渣再磨后与之前筛出的浆料合并、离心脱水后备用。KP蒸煮得率61.9%,木素含量18.6%。GL蒸煮得率75%,木素含量30.6%。
1.3 氧脱木素
氧脱木素在2.8 L空气浴回转反应器内完成。氧脱木素后,冷水洗涤浆料,离心后样品备用。
1.4 打浆
使用PFI磨打浆,绝干浆30 g,浆浓10%,打浆转数90000转。
1.5 酶解
采用诺维信公司的Cellic®CTec2和 HTec2产品,以1 FPU∶1.2 FXU比例对氧脱木素后的浆料进行酶解。FPU为滤纸酶活,按照Ghose 1987方法测定[20],1 FPU酶活定义为每分钟从Whatman No.1滤纸中释放出1 μmol葡萄糖所需的酶液量;FXU为聚木糖酶活性,也是按照Ghose 1987方法测定[21],1 FXU酶活定义为每分钟从聚木糖中释放出1 μmol木糖所需的酶液量。
酶解在三角瓶内于空气浴摇床中进行,浆浓5%,温度50℃,摇床转速180 r/min,酶解48 h。
1.6 分析方法
原料及预处理后样品的木素和碳水化合物含量按照美国国家再生能源实验室方法进行测定[22]。稀酸水解液中单糖含量采用离子色谱(ICS- 3000, Dionex, Sunnyvale, CA),CarboPacTMPA1(2 × 250 mm)分析柱和 CarboPacTMPA1(4 × 50 mm)保护柱,洗脱液为0.1 mol/L NaOH溶液;酶解液中单糖含量采用高压液相色谱(HPLC, Agilent Technology 1200 series, Palo Alto, CA)测定,Shodex SP0810分离柱,去离子水洗脱,流速0.6 mL/min,温度80℃。
2 结果与讨论
2.1 蒸煮和氧脱木素对原料组分的影响
火炬松木片分别经KP和GL蒸煮,再在Na2CO3碱性介质中进行氧脱木素,所得浆料分别标记为KP-OC浆和GL-OC浆,并与NaOH氧脱木素浆(分别为KP-O浆和GL-O浆)进行比较,氧脱木素的条件及结果列于表1。相对于NaOH作为碱性介质的氧脱木素,Na2CO3作为碱性介质时氧脱木素温度由110℃升高到120℃,时间也由1 h调整为4 h。Na2CO3用量也较高,相对于蒸煮后的浆料分别为10%和20%。由表1中反应结果可见,KP蒸煮的浆料用Na2CO3作为碱性介质氧脱木素所得得率与NaOH相比均相差不到2个百分点,但木素脱出率则有明显差异,Na2CO3为碱性介质的高温、长时间处理的木素脱出率远远高于NaOH碱性介质的短时间处理,并且前者脱木素选择性也更好。当Na2CO3用量越高时,木素脱出率也越高,但脱木素选择性却随之下降,尽管如此,其脱木素选择性仍明显高于以NaOH为碱性介质的氧脱木素选择性。GL蒸煮浆料在不同条件下的氧脱木素情况与KP浆相似,与KP浆不同的是,GL浆用Na2CO3氧脱木素时选择性劣于以NaOH为碱性介质的氧脱木素选择性,且随着Na2CO3用量提高,脱木素选择性也提高。
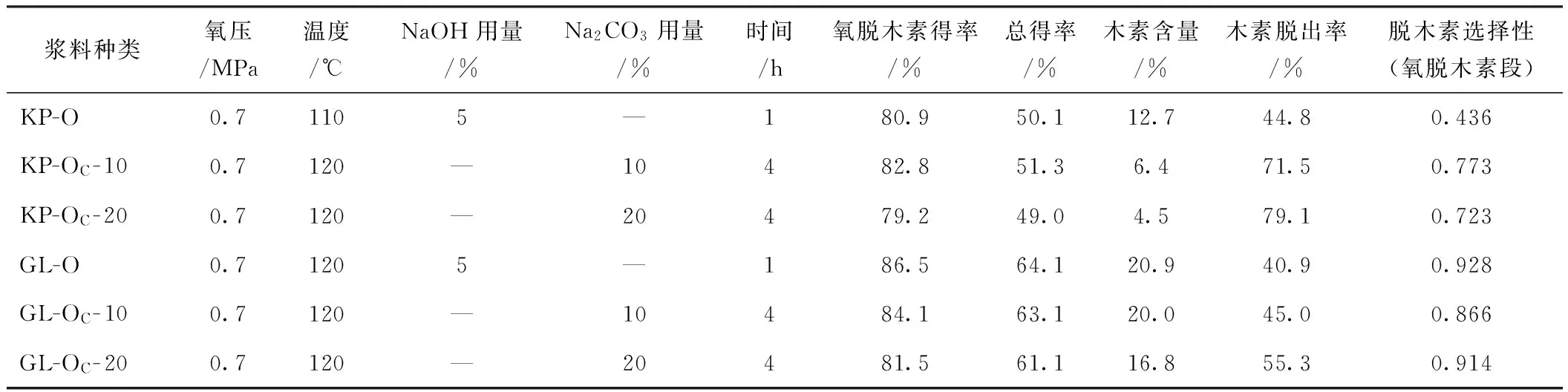
表1 氧脱木素条件和结果
注 木素含量基于氧脱木素后样品;木素脱出率=(氧脱木素前样品木素含量-氧脱木素后样品木素含量)/氧脱木素前样品木素含量,计算中木素含量均需换算为基于氧脱木素前样品;脱木素选择性以氧脱木素前后木素含量差与得率减少量之比表示。O:表示NaOH(用量5%)碱性介质的氧脱木素,OC- 10和OC- 20:表示Na2CO3(用量10%和20%)碱性介质的氧脱木素,以下同。
火炬松木片经KP和GL蒸煮后得到的样品其木素含量相差较大,分别为18.6%和30.6%。不同木素含量的浆料,即使在相同的氧脱木素条件下,其木素脱出率也有较大差异。譬如,相同温度和时间条件下,当Na2CO3用量分别为10%和20%时,KP浆木素脱出率分别可达71.5%和79.1%,而相同条件下GL浆只有45.0%和55.3%。这可能因为KP蒸煮时木素降解溶出较多,残留的木素结构单元中的部分化学键也已经断裂,因此,氧脱木素时更容易降解且溶出;而残留在GL浆中的木素分子破坏程度相对较小,所以,氧脱木素过程中降解溶出相对比较困难。
表2 显示的是木材原料及其蒸煮、氧脱木素后浆料的化学组成。表2中数据可见,木片经KP和GL蒸煮后,木素含量由原料中的28.0%分别降至11.5%和23.0%,显然,本研究的实验条件下,KP蒸煮脱木素能力更强,相应的,其碳水化合物的损失也稍高,由原料中的63.8%降至49.1%,损失14.7个百分点。而GL蒸煮后聚糖含量降至52.5%,损失11.3个百分点。尽管KP和GL蒸煮过程中总的碳水化合物损失较多,但聚葡萄糖的损失并不多,聚木糖、聚甘露糖、聚阿拉伯糖和聚半乳糖的降解和溶出率相对较高,尤其是聚半乳糖和聚甘露糖,损失均超过原料中含量的60%,聚木糖和聚阿拉伯糖的降解溶出也达到30%左右。
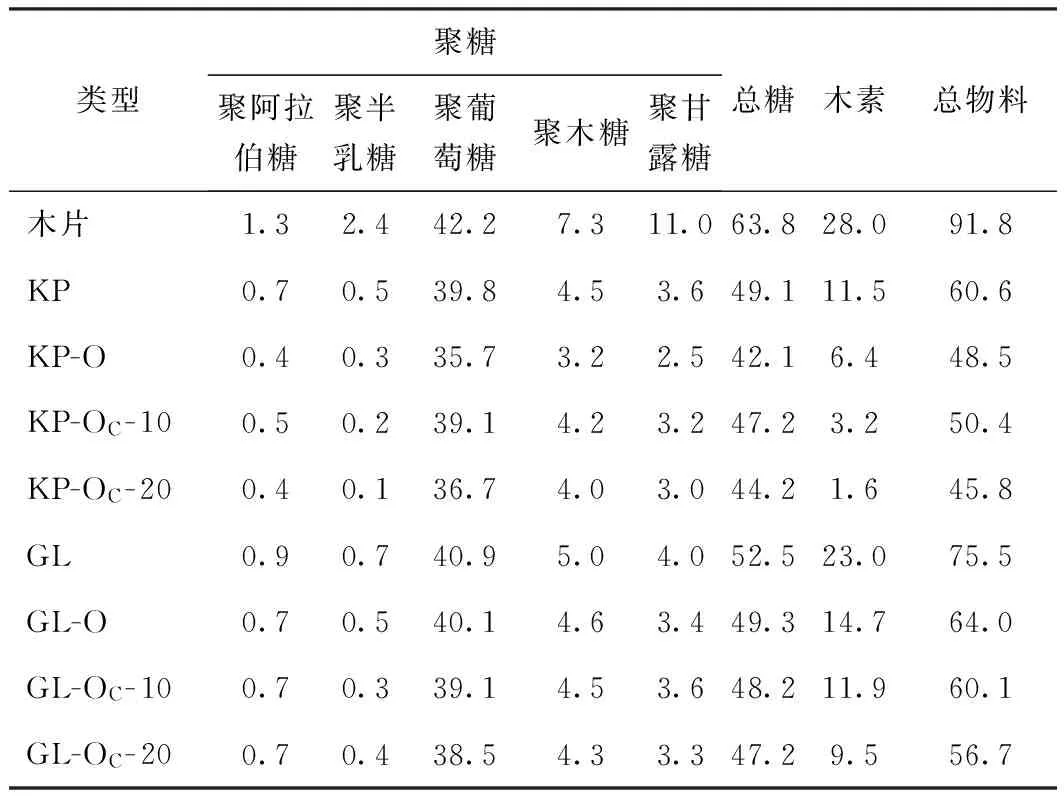
表2 原料及其蒸煮、氧脱木素后浆料的化学组成 %
注 均相对原料。
从表2结果也发现,KP和GL蒸煮后的浆料再进行氧脱木素,随着木素含量的降低,碳水化合物含量也有不同程度的下降。对于KP蒸煮样品,采用NaOH作碱性介质氧脱木素时聚糖降解稍多,其中聚葡萄糖降解约4个百分点。而GL蒸煮样品氧脱木素时,碱性介质的种类对聚糖降解的影响不大,聚葡萄糖降解均较少。
2.2 预处理样品酶解单糖转化
用Ctec2对蒸煮及氧脱木素样品进行酶解,采用单糖得率和总单糖提取率对酶解效果和整个工艺过程糖的转化进行评价。单糖得率定义为酶解得到的单糖总量占酶解前底物质量的百分比;总单糖提取率指酶解得到的单糖总量占木片原料中聚糖总量的百分比。在计算这两个评价指标时所用到的单糖量均转化为相应的聚糖量再进行计算。图1和图2显示的是不同预处理样品酶解后单糖得率比较。
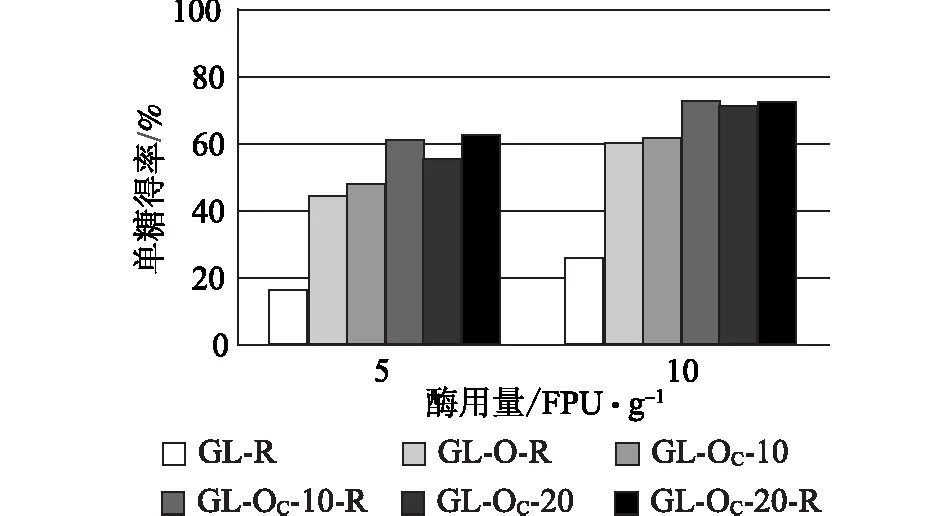
注 R表示打浆处理,下同。图1 GL蒸煮及其氧脱木素浆酶解单糖得率
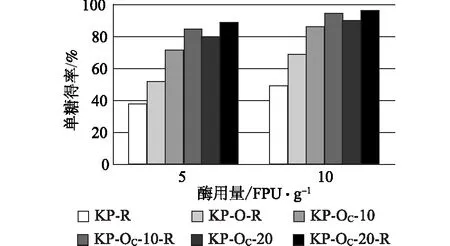
图2 KP蒸煮及其氧脱木素浆酶解单糖得率
比较单糖得率可知,蒸煮后未经氧脱木素的样品,酶解后单糖得率均较低,GL蒸煮后再经打浆处理的样品,当酶用量为5 FPU/g和10 FPU/g时,相应的单糖得率仅为16.4%和26.1%。KP蒸煮浆料相应的单糖得率高于GL浆,但也只有36.9%和48.2%。上述两个样品经不同条件氧脱木素后,均可明显提高酶解单糖得率,提高的幅度因氧脱木素条件以及有无打浆处理而异。与NaOH相比,Na2CO3作碱性介质的氧脱木素样品酶解效率似乎更高。譬如样品GL-O-R和GL-OC- 10-R,其木素含量相近(20.9%和20.0%),在酶用量为5 FPU/g、10 FPU/g时,单糖得率分别为43.9%、59.8%和60.7%、73.2%。再比较KP-O-R(木素含量12.7%)和 GL-OC- 10-R(木素含量20.0%)发现,尽管后者木素含量较高,其酶解单糖得率(10 FPU/g 时73.2%)却高于前者(10 FPU/g 时67.0%)。对于KP蒸煮的浆料,由于在Na2CO3碱性介质中木素脱出率高,其酶解底物木素含量相对较低,因此酶解效果优于NaOH介质氧脱木素的浆料。Na2CO3用量10%的氧脱木素浆料,当酶用量为5 FPU/g和10 FPU/g时,单糖得率分别比NaOH氧脱木素高33.7和27.2个百分点。上述结果除了得益于Na2CO3氧脱木素可更多降低木素含量外,推测Na2CO3氧脱木素样品更易打浆,增加酶的可及度,因此相近甚至更高木素含量时其酶解效率依然高于NaOH氧脱木素浆。此外,无论KP还是GL蒸煮,氧脱木素浆料经打浆处理后,酶解单糖得率均高于未打浆处理的样品。已经有很多关于打浆处理对酶解影响的研究[12],本研究的结果再次验证了打浆对酶解的促进作用。
根据前述定义,酶解单糖得率仅反映预处理对底物酶解效果的改善情况,一个好的预处理技术不仅能够促进后续酶的作用,预处理过程本身应尽可能将聚糖保留下来,从而提高整个生物乙醇生产过程中总的单糖提取率。只有总的单糖提取率足够高,预处理及酶解技术才有可能实现工业化应用。图3和图4显示的是酶解得到的总单糖相对于原料中聚糖的提取率,比较发现,不同样品之间总单糖提取率的相对高低与单糖得率并不一致,即酶解单糖得率高的样品其总单糖提取率未必高。譬如对于KP-OC浆,无论打浆与否,Na2CO3用量20%所得样品的单糖得率均高于相应Na2CO3用量10%的样品(图2),而样品对应的总单糖提取率则相反,Na2CO3用量10%的总单糖提取率反而高于20%Na2CO3用量的样品(图4)。无论GL还是KP蒸煮,Na2CO3用量10%时氧脱木素样品酶解总单糖提取率分别最高,酶用量10 FPU/g时分别可达72.4%和75.7%(图3和图4)。本课题组曾对KP预处理后样品的NaOH氧脱木素工艺进行了优化,火炬松原料经优化的条件处理后,总单糖提取率可达60%左右[18],Na2CO3氧脱木素样品酶解总单糖提取率明显高于前者。此外,打浆处理对于Na2CO3用量低的样品酶解效果的提高更加明显,可能是因为Na2CO3用量低的样品残留的木素较多,打浆处理使纤维素更多地暴露于酶液中,因而更有利于酶解效率的提高。
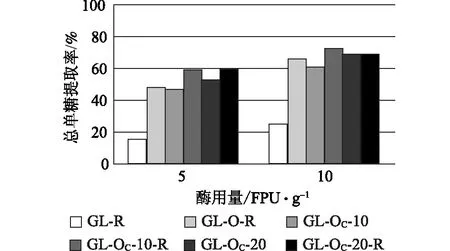
图3 GL蒸煮及其氧脱木素浆总单糖提取率
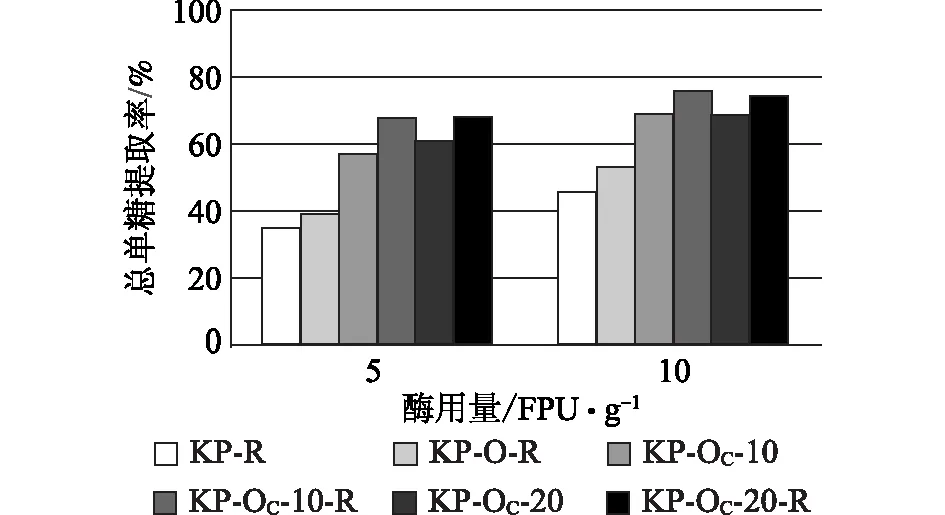
图4 KP蒸煮及其氧脱木素浆总单糖提取率
图5和图6显示的是原料中4种聚糖酶解后分别转化为可发酵单糖的情况,在此称之为提取率。可见,无论哪种蒸煮方式,预处理后的样品酶解后,聚葡萄糖的提取率均比较高,最高可达88%;其次是聚木糖,最高可达67%;聚甘露糖的转化率相对较低,最高可达30%左右;聚半乳糖的转化率更低,最高只有13%左右;此外,酶解液中几乎检测不到阿拉伯糖。从表2数据可知,原料中的聚阿拉伯糖含量本来就很低,加之预处理过程中有所损失,所以酶解提取得到的非常少。从前述蒸煮和氧脱木素后浆料中各聚糖变化情况可知,无论是KP还是GL蒸煮,原料中的聚葡萄糖损失并不是特别多,损失最多的是聚甘露糖和聚木糖,这两种聚糖在原料中所占的比例相对较高,其损失会直接影响总单糖提取率,因此尽管聚葡萄糖提取率很高,但总单糖提取率最高只能达到75%左右。与图3和图4中总单糖提取率的规律一致,原料中的各种聚糖,其转化情况也因预处理和酶解条件不同而异,但几乎每一种聚糖,都是Na2CO3作为碱性介质氧脱木素样品的提取率比较高。
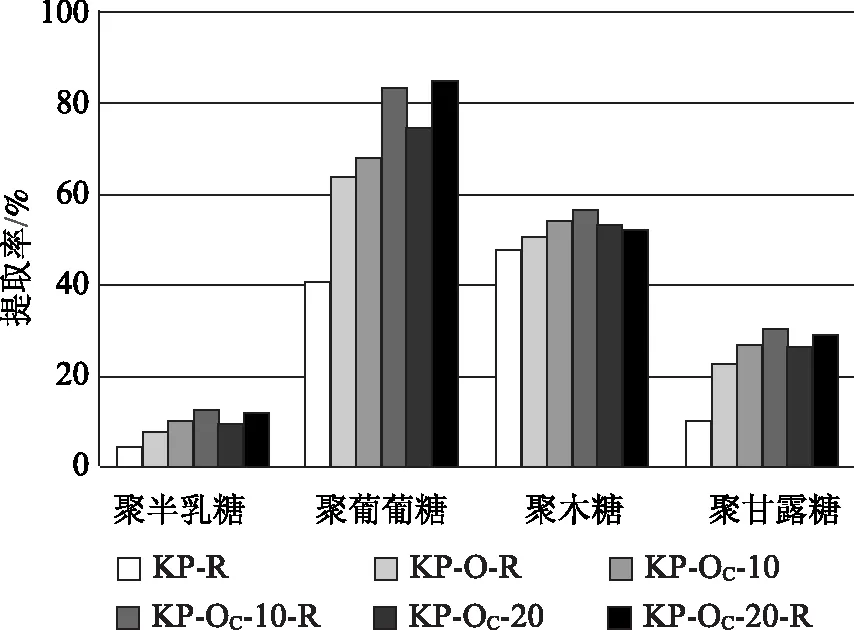
图5 KP蒸煮及氧脱木素样品酶解后原料中4种聚糖的提取率
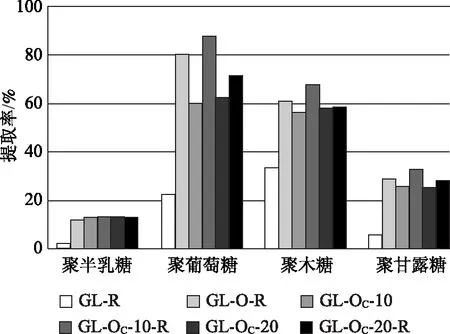
图6 GL蒸煮及氧脱木素样品酶解后原料中4种聚糖的提取率
与KP浆相比,GL浆氧脱木素后总的木素脱出率较低,相应的聚糖损失也较少,所以尽管样品酶解过程单糖得率较低,但相对于原料中的聚糖,可发酵单糖的提取率最高可达72.4%(图3),仅比相同氧脱木素条件的KP浆的总单糖提取率低3.3个百分点。当Na2CO3用量为20%时,未经打浆处理的GL和KP氧脱木素样品的酶解总单糖提取率几乎相同,分别为68.7%和68.5%(图3和图4)。与NaOH氧脱木素相比,由于Na2CO3作为碱性介质氧脱木素选择性更好,所以能保留更多的聚糖,酶解后总单糖提取率明显优于NaOH为碱性介质的氧脱木素样品。GL蒸煮的样品,Na2CO3用量10%氧脱木素后,当酶用量分别为5 FPU/g和10 FPU/g时,相应的酶解总单糖提取率分别比NaOH用量5%的样品高11.8和6.7个百分点(图3)。相似的,KP蒸煮浆料在Na2CO3用量10%氧脱木素后,当酶用量分别为5 FPU/g和10 FPU/g时,相应的总单糖提取率分别比NaOH用量5%的样品高28和23个百分点(图4)。可见,用Na2CO3作为碱性介质延长时间进行氧脱木素可大大提高聚糖的保留率,从而提高总单糖提取率。综合考虑整个工艺过程和酶解效果,KP蒸煮辅以Na2CO3氧脱木素优势更加明显。
3 结 论
以往研究发现,对于比较难处理的针叶材原料,采用碱法预处理辅以氧脱木素及后续打浆处理可明显提高预处理浆料的酶解效率,但以NaOH为碱性介质的氧脱木素过程仍会损失较多的聚糖,导致总糖提取率偏低。本研究结果表明,氧脱木素时将NaOH碱性介质改为Na2CO3,并且延长脱木素反应时间,不仅能够进一步提高木素脱出率和脱木素选择性,而且氧脱木素后浆料更易于打浆和酶解,最终可有效提高原料中总糖至可发酵单糖的转化率。
参 考 文 献
[1] Faaij A. Modern biomass conversion technologies[J]. Mitigation and Adaptation Strategies for Global Change, 2006, 11(2): 343.
[2] Ragauskas A J, Williams C K, Davison B H, et al. The path forward for biofuels and biomaterials[J]. Science, 2006, 311(5760): 484.
[3] Bozell J J. Feedstocks for the future-Biorefinery production of chemicals from renewable carbon[J]. Clean, 2008, 36(8): 641.
[4] Regalbuto J R. Cellulosic biofuels-Got gasoline?[J]. Science, 2009, 325(5942): 822.
[5] Tilman D, Socolow R, Foley J A, et al. Beneficial biofuels-The food, energy, and environment trilemma[J]. Science, 2009, 325(5938): 270.
[6] Zhang P Y H, Himmel M, Mielenz J. Outlook for cellulase improvement: Screening and selection strategies[J]. Biotechnology Advances, 2006, 24(5): 452.
[7] Kumar L, Tooyserkani Z, SokhansanjS, et al. Does densification influence the steam pretreatment and enzymatic hydrolysis of softwoods to sugars?[J]. Bioresource Technology, 2012, 121(10): 90.
[8] Rana D, Rana V, Ahring K B. Producing high sugar concentrations from loblolly pine using wet explosion pretreatment[J]. Bioresource Technology, 2012, 121(10): 61.
[9] Ewanick S M, Bura R, Saddler J N. Acid-catalyzed steam pretreatment of lodgepole pine and subsequent enzymatic hydrolysis and fermentation to ethanol[J]. Biotechnology and Bioengineering, 2007, 98(4): 738.
[10] Sassner P, Galbe M, Zacchi G. Steam pretreatment ofSalixwith and without SO2impregnation for production of bioethanol[J]. Applied Biochemistry and Biotechnology, 2005, 124(1/2/3): 1101.
[11] Wu S, Chang H, Jameel H, et al. Novel green liquor pretreatment of loblolly pine chips to facilitate enzymatic hydrolysis into fermentable sugars for ethanol production[J]. Journal of Wood Chemistry and Technology, 2010, 30(3): 205.
[12] Koo B, Treasure H, Jameel H, et al. Reduction of enzyme dosage by oxygen delignification and mechanical refining for enzymatic hydrolysis of green ligquor-pretreated hardwood[J]. Applied Biochemistry and Biotechnology, 2011, 165: 832.
[13] Hakola M, Kallioinen A, Kemell M, et al. Liberation of cellulose from the lignin cage: A catalytic pretreatment method for the production of cellulosic ethanol[J]. Chem Sus Chem, 2010, 3(10): 1142.
[14] Pan X, Xie D, Yu R W, et al. Pretreatment of lodgepole pine killed by mountain pine beetle using the ethanol organosolv process: Fractionation and process optimization[J]. Industrial & Engineering Chemistry Research, 2007, 46(8): 2609.
[15] Ko J K, Bak J S, Jung M, et al. Ethanol production from rice straw using optimized aqueous ammonia soaking pretreatment and simultaneous saccharification and fermentation[J]. Bioresource Technology, 2009, 100(19): 4374.
[16] Zhu J Y, Pan X J, Wang G S, et al. Sulfite pretreatment(SPORL) for robust enzymatic saccharification of spruce and red pine[J]. Bioresource Technology, 2009, 100(8): 2411.
[17] Salehian P, Karimi K, Zilouei H, et al. Improvement of biogas production from pine wood by alkali pretreatment[J]. Fuel, 2013, 106(4): 484.
[18] Zhang H, Wu S. Enhanced enzymatic cellulose hydrolysis by subcritical carbon dioxide pretreatment of sugarcane bagasse[J]. Bioresource Technology, 2014, 158(4): 161.
[19] Wu S, Jameel H, Chang H, et al. Techno-economic analysis of the optimum softwood lignin content for the production of bioethanol in a repurposed kraft mill[J]. BioResources, 2014, 9(4): 6817.
[20] Ghose T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 1987, 59(2): 257.
[21] Ghose T K. Measurement of hemicellulose activities Part 1: xylanase[J]. Pure and Applied Chemistry, 1987, 59(12): 1739.
[22] Sluiter A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytical Procedure, 2008, NREL, Report No. TP- 510- 42618[S].
