类风湿关节炎患者外周血单个核细胞中TRAIL、c-FLIP等表达水平及临床意义①
2018-05-25林美娜梅序桥许瑞元
林美娜 章 涛 梅序桥 许瑞元
(漳州卫生职业学院,漳州 363000)
类风湿关节炎(Rheumatoid arthritis,RA)是一种病因未明的以慢性、对称性、多关节滑膜炎和关节结构破坏为主要特征的自身免疫性疾病[1]。有研究指出,TRAIL在RA中具有双重角色[2],同时与TRAIL诱导凋亡抵抗的RAFLS和TRAIL与RA中促进疾病活动有关。吴凤霞等[3]研究认为RA滑膜组织中抗凋亡分子FLIP表达增高,而且与RA滑膜炎症程度积分相关。在多种肿瘤和炎症反应中,c-FLIP阻断肿瘤坏死因子α(TNF-α)、Fas配体(FasL)和TRAIL等诱导的凋亡[4]。另外,臧凤琳等[5]研究认为c-FLIP对TRAIL生物治疗具有辅助作用。
有关RA患者中凋亡相关蛋白TRAIL、c-FLIP等的研究目前多基于滑膜细胞,在外周血细胞当中研究甚少。取材的有创性使得滑膜细胞的研究受到一定的限制。由于RA是一种系统性炎症性疾病,其免疫病理事件涉及循环中大部分的淋巴细胞、单核细胞等,且关节内的活化炎症细胞均可由外周激活的细胞池中募集而来。因此,对PBMC 的研究可能更能反映患者的整体病理状况[6]。本研究通过分析RA患者外周血单个核细胞TRAIL、c-FLIP、caspase-8等基因的表达情况,探讨其在RA中的临床意义,为RA 的临床诊治寻找更有效的途径和方法提供实验基础。
1 材料与方法
1.1材料
1.1.1研究对象 选择从2014年1月至2015年6月入住漳州市医院血液风湿内科的患者60例,按RA疾病活动指数(DAS28)分为低度活动期(L)组(DAS28<3.2)、中度活动期(M)组(DAS28 3.2~5.1)、高度活动期(H)组(DAS28>5.1)。其中L组22例,M组20例,H组18例。女40例,男20例,患者32~78岁,平均年龄(46.75±13.52)岁。RA的诊断标准为2010年美国风湿病学会与欧洲风湿病学会联合提出的类风湿关节炎诊断标准[7]。
对照(N)组为门诊健康体检者,共25例,其中女18例,男7例,31~80岁,平均年龄(45.35±14.02)岁。与RA患者相比性别、年龄构成无统计学差异(P>0.05)。排除其他自身免疫系统等疾病。
1.1.2主要试剂 促凝管(长庚医疗器械公司);引物序列(上海生工有限公司);Anti-TNFSF10/TRAIL Antibody(aa31-80)、Anti-CFLAR TRUEMAB Antibody Clone OTI2D3(ORIGENE);Caspase-8 Antibody、Beclin 1 Antibody(药明康德);HRP标记的抗兔二抗、RNA提取试剂盒、反转录试剂盒以及荧光定量PCR试剂盒(北京全式金生物技术有限公司)。
1.2方法
1.2.1临床资料的收集 对60例RA患者的临床资料进行收集整理,包括:①患者的一般情况:性别、年龄、病程以及用药情况;②患者病例情况:晨僵持续时间、疼痛持续时间、疼痛程度、疼痛28关节计数、疼痛总数、活动度(DAS28);③类风湿因子RF、超敏C反应蛋白、血沉(ESR)、抗CCP等相关辅助检查结果信息。
1.2.2PBMC的提取和处理 分别采RA患者和健康人静脉血2 ml,置于真空采血管中(抗凝剂),采用Ficoll-Hypaque密度梯度离心法分离PBMC[8],一部分加入1 ml RNA 提取试剂,吹打混匀,放入-20℃冰箱过夜保存,另一部分保存用于后续试验。
1.2.3采用荧光定量PCR检测TRAIL、c-FLIP、caspase-8等mRNA的表达 总RNA的提取参照RNA提取试剂盒说明书。1%琼脂糖凝胶电泳检测RNA质量,紫外分光光度计检测RNA浓度及纯度。取单个核细胞经PBS洗涤2次后,再加入1 ml Trizol混匀;加入氯仿200 μl剧烈混匀,室温静置5 min;4℃ 12 000 r/min离心5 min,将400 μl上层水相转移到新的EP管中;加500 μl预冷异丙醇,静置10 min后,4℃ 12 000 r/min离心10 min;加入无水乙醇1 ml洗涤沉淀物,4℃ 8 000 r/min离心5 min;加入DEPC水20~80 μl,56℃助溶,总RNA经紫外分光光度计定量OD260∶OD280≥1.8,-80℃保存备用。
RNA逆转录:按RNA逆转录试剂盒TransScript Reverse Transcriptase[M-MLV,RNaseH](Cat.No.:AT101-02)说明书操作。反应条件:Step 1,42℃ 15 min;Step 2,85℃ 5 s。得到的cDNA放置-20℃冰箱中备用,或者立即用于Real-time qPCR反应。Real-time qPCR反应体系及反应条件的优化,采用北京全式金生物技术有限公司(TransGen)荧光定量PCR试剂盒2×TransStarTMTop Green qPCR SuperMix(Cat.No.:AQ131-02)进行Real-time qPCR试验,优化Real-time qPCR反应体系及反应条件,确定最佳的模板浓度、退火温度,确保PCR引物的特异性及PCR扩增效率(引物见表1)。
优化Real-time qPCR扩增反应体系及反应条件后,进行正式试验。Real-time qPCR扩增反应体系(见表2) 要在冰上进行配制。每个反应重复3次,配制反应体系时先配制总的反应液,再各个分装。选择Bio-Rad CFX96荧光定量PCR仪进行定时定量PCR反应。反应结束后,以GAPDH为内参基因,2-ΔΔCt法分析基因表达水平,比较各基因在不同组织样本中的表达差异,得到表达差异分析结果。
1.2.4Western blot检测TRAIL、FADD、caspase-8的表达水平 外周血单个核细胞总蛋白的提取:PBMC细胞,用1×PBS 洗2次后,加入400 μl含蛋白酶抑制剂 cooktail的RIPA 强裂解液,冰上充分裂解15 min;将裂解液移入1.5 ml离心管,用超声细胞裂解器在冰上裂解;将液体移入1.5 ml离心管,4℃ 12 000 r/min离心15 min;取上清移入另一新的离心管;BCA法进行蛋白定量;蛋白样品加入1/4体积上样缓冲液,沸水煮 5 min,蛋白电泳。
Western blot流程:取蛋白样品各30 μg,用10% SDS-PAGE凝胶将提取的总蛋白分离,120 V条件下电泳约 90 min;将胶上的蛋白条带利用湿式转膜法电转移至NC膜上,恒压100 V,冰浴中转120 min;取出NC膜,丽春红染色,观察转移效果后用 5%脱脂牛奶室温封闭1 h,TBST洗膜5 min;一抗稀释液稀释1∶1 000,含适当稀释一抗的塑料袋中封膜,4℃摇床孵育冰箱过夜,TBST洗膜 5 min,3 次;TBST稀释二抗1∶5 000,含适当稀释二抗的塑料袋中封膜,室温摇床孵育 1 h,TBST洗膜 5 min,3 次;将胶片进行扫描,用南京驰顺科技发展有限公司的GIS300凝胶成像分析系统分析目标带的分子量和光密度相对比值。
2 结果
2.1各组RA患者PBMC TRAIL、c-FLIP、caspase-8 mRNA表达情况(见表3、图1) RA患者PBMC中中M组TRAIL mRNA为3.26±0.78,明显高于N组1.30±0.20 (P=0.028),L组和H组 (1.56±0.37、1.83±0.26) 略高于N组(P=0.048、0.043);L、M、H组中c-FLIP的mRNA相对表达量分别为1.27±0.28、1.32±0.34、1.93±0.40,均高于N组(1.08±0.12),P分别为0.035、0.034、0.030,均小于0.05,有显著性差异;L、M、H组中caspase-8的mRNA分别为2.77±0.97、4.52±0.85、2.13±0.44,均高于N组1.04±0.13,P分别为0.023、0.012、0.032,均小于0.05,差异有显著统计学意义。M组水平较L、H组高(P=0.037、0.029)。
表1Real-timeqPCR反应引物(引物序列5′→3′)
Tab.1Real-timefluorescencequantitativePCRprimer(Primersequence5′→3′)

GeneForwardprimerReverseprimerTRAILCCCAATGACGAAGAGAGTATGAACTGTAGAAATGGTTTCCTCAGAGGTc⁃FLIPTTTACCACCCAGAGACACGCAGAACCTCTGCCTGCTGAACCaspase⁃8TGATGAAGAGGCTCTGAGTAATGGCAAAGTGACTGGATATAGAPDHAATGAAGGGGTCATTGATGGAAGGTGAAGGTCGGAGTCAA
表2实时荧光定量PCR反应体系
Tab.2Real-timefluorescencequantitativePCRreactionsystem

ComponentsVolume(μl)2×TransStarTMTopGreenqPCRSuperMix100Forwardprimer(10μmol/L)04Reverseprimer(10μmol/L)04cDNAtemplate20ddH2OUpto20
表3RA患者PBMCTRAIL、c-FLIP、caspase-8的mRNA表达情况
Tab.3mRNAexpressionofPBMCTRAIL,C-FLIPandcaspase-8inRApatients
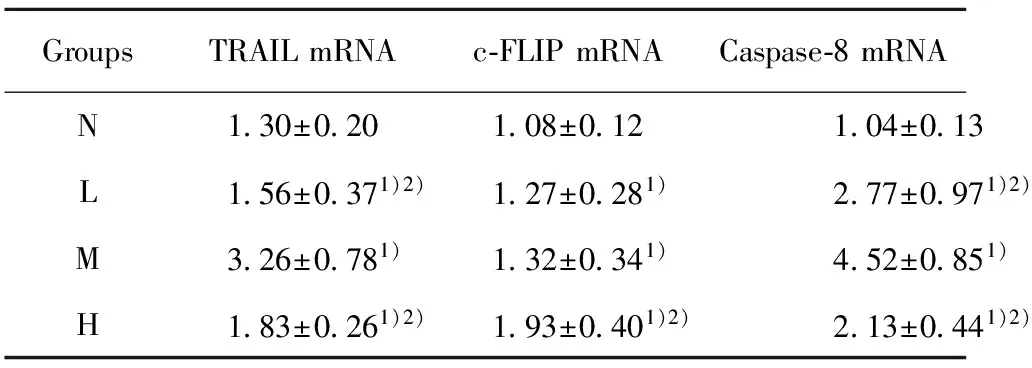
GroupsTRAILmRNAc⁃FLIPmRNACaspase⁃8mRNAN130±020108±012104±013L156±0371)2)127±0281)277±0971)2)M326±0781)132±0341)452±0851)H183±0261)2)193±0401)2)213±0441)2)
Note:Compare with group N,1)P<0.05;compare with group M,2)P<0.05.

图1 TRAIL、c-FLIP、caspase-8 mRNA相对表达情况Fig.1 Relative expression level of TRAIL,c-FLIP and caspase-8 mRNA

图2 TRAIL、c-FLIP、caspase-8蛋白表达情况Fig.2 Protein expression of TRAIL,c-FLIP and caspase-8
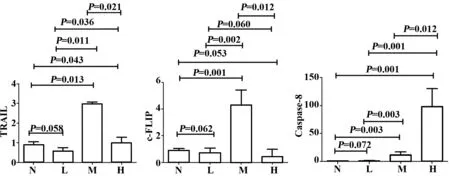
图3 TRAIL、c-FLIP、caspase-8蛋白相对表达量Fig.3 Relative expression of TRAIL,c-FLIP and caspase-8 protein
2.2RA患者PBMC TRAIL、c-FLIP、caspase-8蛋白表达变化(见图2、3) RA患者PBMC中TRAIL蛋白M组明显高于N组(P=0.013 ),H组稍高于N组(P=0.043),L组与N组差异无明显统计学意义(P=0.058),M组明显高于L、H组(P=0.011,0.021);c-FLIP蛋白M组表达显著高于N组(P=0.001), L、 H组与N组比较, 差异无统计学意义(P=0.062,0.053);caspase-8蛋白表达 M、H组明显高于N组(P=0.003,0.001);L组与N组比较,差异无统计学意义(P=0.072)。
3 讨论
RA是关节滑膜慢性炎症为主的自身免疫性疾病,致残率高[9]。RA发生发展是一个多因素参与的复杂过程,RA发病机制的研究一直处在不断发展中。RA关节软骨和骨组织的损害,与滑膜细胞的过度增生活化与凋亡不足有关,凋亡机制在RA发病中占重要地位[10]。对于RA患者细胞的相关研究,NaKajima和Firestein 首先报道了RA滑膜细胞表达fas抗原,且fas抗体可诱导滑膜细胞凋亡[11]。也有研究表明,TRAIL及其受体在T细胞的表达分布可能是RA发病机制的重要启示[12]。
TRAIL共有5种受体,包括死亡受体4(DR4 )、死亡受体5(DR5) 、诱骗受体1(DcRI) 、诱骗受体2(DcR1) 和可溶性受体骨保护素。其中DR4、DR5属于死亡受体,因这两种受体均含有胞内死亡结构域和依赖caspase系统的凋亡命令的识别结构域,TRAIL与DR4或DR5受体结合后将TRAIL的死亡信息传递至细胞内,通过进一步激活caspase系统,从而导致细胞凋亡。本研究RA外周血单个核细胞TRAIL mRNA中L、M、H三个活动组均显著高于N组,且M组又显著高于 L、H组。TRAIL蛋白表达中M、H组均明显高于N组,L组与N组差异无统计学意义;M组明显高于L、H组,差异有统计学意义。在不同RA组别中TRAIL mRNA及蛋白表达总体趋势增高,而M组呈明显高表达,这可能与RA不同活动期不同程度的凋亡抑制的代偿体现有关。
细胞型Fas 相关死亡域样IL-1β转换酶抑制蛋白(c-FLIP)是外部凋亡通路中的一个重要负调控因子。c-FLIP蛋白在结构与序列上与caspase-8 有很多相似之处,其N-端含有与caspase-8 相似的两个相互串联的DED 。研究认为c-FLIP通过其caspase 同源结构域与caspase-8 相互靠近形成异二聚体c-FLIP(L)/caspase-8,使得c-FLIP 竞争性结合FADD,抑制DISC的形成,阻碍TRAIL诱导细胞凋亡[13]。本研究外周血单个核细胞中c-FLIP mRNA L、M、H组分别高于N组(P=0.035,0.034,0.030)。c-FLIP基因mRNA水平在RA患者不同活动程度的外周血单个核细胞中呈递进性升高,且与疾病的进程呈正相关。这表明c-FLIP这一凋亡抑制要素在RA患者中的存在,其mRNA水平与RA患者不同活动程度的相关性可在外周血单个核细胞中体现,方便为RA病情评估提供参考。c-FLIP蛋白与c-FLIPmRNA表达不那么同步,M组c-FLIP蛋白表达明显高于其他组别。L、H组与正常对照表达差异不大(P=0.062,0.053)。原因有待进一步探讨,这可能是c-FLIP存在转录环节的调节,或是c-FLIP在滑膜细胞与外周血细胞的转录差异,或是本实验中对RA患者收集的病例数量有限造成的误差所致。本研究caspase-8 mRNA中,L、M、H组也均高于N组(P=0.023,0.012,0.032)。caspase-8蛋白表达中,L组与N组比较,无显著性差异(P=0.072);M、H组明显高于N组(P=0.003,0.001)。caspase-8总体水平增高,有可能由于c-FLIP通过其caspase 同源结构域与caspase-8 相互靠近形成异二聚体c-FLIP(L)/caspase-8,使得增高的caspase-8不能结合到DISC上,从而不能有效活化,引起下级caspase 酶系的级联反应。
TRAIL具有强大的诱导肿瘤细胞凋亡的能力,但对正常细胞基本没有影响。体内、体外实验表明,TRAIL可选择性地诱导肺癌细胞、胃癌细胞等多种肿瘤细胞及转化细胞的凋亡;对荷瘤动物应用外源性的TRAIL,结果显示肿瘤生长速度显著降低,对荷瘤动物本身无明显的副作用[14]。RA的特征之一就是滑膜组织表现为增生性侵蚀性生长,其生长性质和病理学行为在许多方面类似于肿瘤组织的特性,对软骨组织造成进行性破坏。因此延缓甚至抑制滑膜细胞异常增殖与诱导其凋亡将成为治疗RA的主要策略之一,具有十分重要的意义[15]。近几年,有关TRAIL或TRAIL相关制剂应用于RA的治疗已有一些研究。陈金[16]研究发现重组人肿瘤坏死因子相关凋亡诱导配体(hTRAIL)可体外诱导RASFs凋亡。周剑锁等[17]研究发现EPB可以上调死亡受体DR4、DR5,增强FLS对TRAIL和AD5-10的敏感性,从而为RA治疗提供了新的策略。
臧凤琳等[5]认为c-FLIP很可能是TRAIL治疗肿瘤的选择性标志物,即对TRAIL 耐药的肿瘤细胞首先要检测c-FLIP 表达水平。如果c-FLIP 高表达,可以应用特异性降低c-FLIP联合TRAIL的方法;如果c-FLIP低表达,说明TRAIL对该肿瘤治疗无效,需要改换其他治疗手段。本研究RA患者外周血单个核细胞中,肿瘤坏死因子相关凋亡诱导配体TRAIL、c-FLIP、caspase-8等基因表达水平总体趋势增加,有望为TRAIL或TRAIL相关制剂应用于RA治疗或其他RA临床诊治的后续研究提供实验参考。
参考文献:
[1] Kourilovitch M,Galarza-Maldonado C,Ortiz-Prado E,etal.Diagnosis and classification of rheumatoid arthritis[J].J Autoimmun,2014(48-49):26-30.
[2] Audo R,Calmon-Hamaty F,Baeten D,etal.Mechanisms and clinical relevance of TRAIL-triggered responses in the synovial fibroblasts of patients with rheumatoid arthritis[J]. Arthritis Rheum,2011,63(4):904-913.
[3] 吴凤霞,杨明辉,刘宁涛,等.Fas相关死亡区样白介素1转换酶抑制蛋白在类风湿关节炎患者滑膜组织中的表达[J].第四军医大学学报,2008,29(21):1987-1989.
Wu FX,Yang MH,Liu NT,etal.Expression of FLIP in synovial tissue from patients with rheumatoid arthritis[J].J Fourth Military Med Uni,2008,29(21):1987-1989.
[4] Kim Y,Suh N,Sporn M,etal.An inducible pathway for degradation of FLIP protein sensitizes tumor cells to TRAIL-induced apoptosis[J].J Biol Chem,2002,277(25):22320 -22329 .
[5] 臧凤琳,孙保存.c-FLIP在凋亡增殖中的双向调节作用及与肿瘤预后和治疗关系的研究[J].中国肿瘤临床,2013,40(24):1573-1576.
Zang FL,Sun BC.Research progress on the dual regulation of c-FLIP in apoptosis and proliferation and the relationship between c-FLIP and tumor prognosis,chemotherapy,and TRAIL treatment in cancers[J].Chin J Clin Oncol,2013,40(24):1573-1576.
[6] 陈瑞林,黄文辉,黄成辉,等.PPAR-γ 在类风湿关节炎患者外周血单个核细胞中的表达及与疾病活动度的关系[J].实用临床医药杂志,2015, 19(7) :65-90.
Chen RL,Huang WH,Huang CH,etal.Expression of peroxisome proliferator-activated receptor-γ in peripheral blood mononuclear cells of patients with rheumatoid arthritis and its relationship with disease activity[J].J Clin Med Pract,2015,19(7) :65-90.
[7] 张卓莉.类风湿关节炎诊断与治疗载入新里程[J].中国医学前沿杂志(电子版),2011,3(2):39-42.
Zhang ZL.Diagnosis and treatment of rheumatoid arthritis load new mileage[J].Chin J Med Sci(Electronic Version) ,2011,3(2):39-42.
[8] 马 芳,尹 林,熊华伟,等.分血时间对外周血单个核细胞蛋白质表达谱的影响[J].实用医学杂志,2012,28(7):1058-1061.
Ma F,Yin L,Xiong HW,etal.Effects of different isolation time spacing on proteome profiles of peripheral blood mononuclear cells[J].J Practical Med,2012,28(7):1058-1061.
[9] 吕 丹,金 迪,王柏山,等.IL-18BP阻断由IL-18诱导大鼠胶原性关节炎对滑膜细胞凋亡表达的影响[J].中国免疫学杂志,2017,33(8):1161-1163.
Lü D,Jin D,Wang BS,etal.Effects of IL-18BP blockade on apoptosis of synovial cell in IL-18-induced mice with Collagen-induced-arthritis[J].Chin J Immunol,2017,33(8):1161-1163.
[10] 陈安平,袁国华,罗雄燕,等.类风湿关节炎滑膜组织及关节液中DCR3表达的研究[J].中国免疫学杂志,2013,29(8):825-828.
Chen AP,Yuan GH,Luo XY,etal.Expression of human decoy receptor 3 in the synovium of patients with rheumatoid arthritis[J].Chin J Immunol,2013,29(8):825-828.
[11] Nakajima T,Aono H ,Hasunuma T,etal.Apoptosis and functional Fas antigen in rheumatoid arthritis synoviocytes[J] .Arthritis Rheum,1995,38:485-491.
[12] Bisgin A,Terzioglu E,Aydin C,etal.TRAIL death receptor-4,decoy receptor-1 and decoy receptor-2 expression on CD8+T cells correlate with the disease severity in patients with rheumatoid arthritis[J]. BMC Musculoskelet Disord,2010, 11:192.
[13] Geserick P,Drewniok C,Hupe M,etal.Suppression of cFLIP is sufficient to sensitize human melanoma cells to TRAIL-and CD95L-mediated apoptosis[J].Oncogene,2008,27(22):3211-3220.
[14] Manzo F,Nebbioso A,Miceli M,etal.TNF-related apoptosis-inducing ligand:Signalling of a ‘smart’molecule[J].Int J Biochem Cell Biol,2009,41(3):460-466.
[15] 张群燕,赵智明,姚茹冰,等.青藤碱抑制类风湿关节炎滑膜细胞增殖与诱导凋亡的研究[J].中华中医药学刊,2017,(1):53-55.
Zhang QY,Zhao ZM,Yao RB,etal.Sinomenine suppresses proliferation and induces apoptosis of RA synovial cells[J].Chin Archi Traditional Chin Med,2017,(01):53-55.
[16] 陈 金,赵福涛.肿瘤坏死因子相关凋亡诱导配体对类风湿关节炎滑膜细胞的影响[J].中华临床医师杂志(电子版),2012,6(17):5034-5038.
Chen J,Zhao Futao.The effect of TRAIL in the apoptosis of rheumatoid arthritis synovial fibroblasts[J].Chin J Clinicians(Electronic Edition),2012,6 (17):5034-5038.
[17] 周剑锁,史 娟,朱洁卿,等.AD5-10与表阿霉素联合作用治疗类风湿性关节炎[J].中国医学科学院学报,2011,33(4):367-370.
Zhou JS,Shi J,Zhu JQ,etal.Combination of AD5-10 and epirubicin in treating rhumatoid arthritis[J].Acta Academiae Med Sinic 2011,33(4):367-370.