His标记STAT4(565-748氨基酸)肽段融合蛋白原核表达及纯化①
2018-05-25姚芳玲
贺 美 徐 艳 姚芳玲 邹 纯 于 颍 黎 明
(中南大学基础医学院免疫学系,长沙 410078)
信号转导和转录活化蛋白4(Signal transducer and activator of transcription 4,STAT4)属于STAT核转录因子家族,最初是通过与其他STAT基因交叉杂交克隆获得[1]。
多种细胞因子如IL-12、IFN-α/β、IL-23及IL-17等与细胞膜相应受体结合,使与受体结合的酪氨酸激酶JAK2和Tyk2活化,后者使STAT4的693位酪氨酸残基发生磷酸化,导致STAT4从受体-JAK-STAT4复合物上脱落,发生同源二聚化,移位入核,与DNA结合,发挥其促转录活性,启动下游靶基因的转录和翻译,介导一系列细胞生物学效应[2],包括Th细胞、NK细胞、肥大细胞和树突状细胞的分化、IFN-γ分泌等等,也与自身免疫性疾病如类风湿性关节炎、系统性红斑狼疮、系统性硬化病的发生及发展密切相关[3-9]。研究发现STAT4在蛋白水平的修饰除开C-端693位发生酪氨酸磷酸化外,还可以在721位发生丝氨酸磷酸化[10,11]。因此,以STAT4 C-端多肽为底物,通过体外激酶实验有可能发现一些新的蛋白激酶,从而有可能发现新的信号转导途径,进一步探讨这一新的信号转导途径的生物学意义,将有助于探讨细胞生物学行为,为疾病预防、诊断、治疗提供新的分子靶标。
我们根据STAT4的功能域结构、通过PCR扩增获得STAT4 C-端编码565-748氨基酸(Amino acid,aa)多肽的截短基因片段,将之亚克隆到pET-28a(+)载体中,将重组质粒转化感受态大肠杆菌BL21并诱导融合蛋白表达,通过变性和复性策略,从包涵体中获得目的蛋白,最后采用亲和层析、透析的方法获得纯化蛋白,为后续体外激酶实验等研究提供实验材料。
1 材料与方法
1.1实验材料、试剂 核酸工具酶购自NEB和Qiagen公司;抗His标签兔单克隆抗体购自Millipore公司;DNA快速纯化/回收试剂盒、Plasmid mini kit质粒抽提试剂盒均购自Omega Bio-Tek公司;His标签蛋白纯化试剂盒来自碧云天公司;辣根过氧化物酶标记的山羊抗兔IgG购自Santa Cruz Biotechnology;ECL发光试剂盒来自Pierce Chemical 公司;其他试剂均为进口或国产分析纯。感受态大肠杆菌DH5α和感受态大肠杆菌BL21购自碧云天公司。使用的质粒包括:pET-28a(+)、pEGFP-STAT4。pEGFP-STAT4质粒已经测序验证[12]。
1.2方法
1.2.1引物设计 根据Genbank公布的STAT4的cDNA系列(基因登录号:NM_003151.3 ),设计并合成PCR扩增编码STAT4(565-748aa)肽段的基因的上下游引物,上游引物:5′-CGGGATCCATTC-TTCCCCTTTG-3′,下游引物:5′-CCGCTCGAGTTTC-AGCAGAATAAGG-3′。下划线部分为BamHⅠ和XhoⅠ酶切接头。
1.2.2目的基因的获取 以测序鉴定正确的pEGFP-STAT4[12]为模板,以pfu 为高保真多聚酶,用PCR方法扩增STAT4(565-748aa)基因片段,命名为STAT4-4。PCR扩增条件:98℃ 30 s预变性,94℃ 30 s,64℃ 30 s,72℃ 60 s,共30个循环,之后72℃链延伸8 min,16℃保存。PCR产物用1%琼脂糖凝胶电泳。按凝胶DNA回收试剂盒说明书进行切胶回收。
1.2.3pET-28a-STAT4-4表达载体的构建及鉴定 使用BamHⅠ和XhoⅠ限制性内切酶将载体pET-28a(+)和STAT4-4基因PCR产物分别进行双酶切,电泳后胶回收,用T4 DNA 连接酶连接。将连接产物转化至感受态大肠杆菌DH5α,挑取细菌克隆扩增,提取质粒进行双酶切鉴定并送华大基因公司测序。序列正确的质粒即为原核表达质粒pET-28a-STAT4-4。
1.2.4融合蛋白His-tagged-STAT4(565-748aa)的诱导表达 将测序正确的重组质粒转化至感受态大肠杆菌BL21中,挑取单克隆菌至5 ml含有10 μg/L卡那霉素的LB液体培养基中,置于摇床上220 r/min,37℃过夜。以1∶50的比例转接细菌至50 ml含卡那霉素的LB培养基中,37℃振荡培养至A600达到0.5~0.7之间,加入不同浓度的IPTG,放置摇床上25℃或37℃、220 r/min诱导培养4 h,取菌液沉淀加5×上样缓冲液,100℃煮沸5 min,行SDS-PAGE凝胶电泳,考马斯亮蓝染色检测融合蛋白的表达。
1.2.5目的蛋白诱导条件的选择 将表达菌pET-28a-STAT4-4 37℃、220 r/min振荡培养过夜,次日以1∶50转接,振荡培养至A600为0.5左右,取培养的菌液15 ml,加入不同浓度的IPTG,37℃或25℃继续培养4 h,4℃ 10 000 r/min离心5 min,收集菌液,200 μl PBS重悬细菌,加入50 μl 5×上样缓冲液,超声粉碎,超声功率为30%~40%,每次超声10 s,间隔10 s,共超声处理10次。加热煮沸5 min,10 000 g离心5 min,取上清和沉淀各10 μl进行10%SDS-PAGE凝胶电泳,考马斯亮蓝染色并脱色。
1.2.6包涵体的复性及纯化 将表达菌以1∶50转接500 ml LB培养液,200 r/min振荡培养至A600为0.5左右,加入IPTG至终浓度为0.1 mmol/L,25℃ 下诱导表达4 h。离心收集IPTG诱导培养的细菌,用预冷PBS洗2遍,去上清,在沉淀中加入非变性裂解液(50 mmol/L NaH2PO4,300 mmol/L NaCl,pH8.0)3 ml,充分重悬菌体,再加入溶菌酶至终浓度为1 mg/ml,冰上放置30 min。冰上超声裂解细菌。超声功率为30%~40%,每次超声10 s,间隔10 s,共超声处理10次。4℃、10 000 g离心10 min,去上清,沉淀即为包涵体蛋白。加入2 ml变性缓冲液(pH8.0、50 mmol/L Tris-HCl,8 mol/L尿素),37℃摇床振荡过夜后,4℃ 8 800 r/min×30 min离心,留上清。采用逐级稀释法复性:将上清逐滴加入复性液(pH8.0、50 mmol/L Tris-HCl,0.5 mmol/L EDTA,50 mmol/L NaCl)中,边加边缓慢搅拌,10 min 后再加第二滴,如此反复滴加,滴加完毕后继续搅拌4 h以充分复性,此即复性混合液。整个操作4℃进行。
将复性的融合蛋白进行纯化。步骤为:取0.5 ml 50% BeyoGoldTM-His-tag纯化凝胶,平衡后加入上述复性混合液,4℃在摇床上缓慢摇过夜。将摇过夜的混合物装入亲和层析柱管中,将纯化柱底部盖子打开,在重力的作用下使柱内的液体流出,加入0.5 ml非变性洗涤液,洗柱5次,用0.5 ml非变性洗脱液(50 mmol/L NaH2PO4、300 mmol/L NaCl、50 mmol/L 咪唑)洗脱目的蛋白,洗脱6~10次。将每次的洗脱液分别收集到不同的离心管中,以备后续分析用,最后将洗脱液合并装入透析袋,用透析液(pH8.0 50 mmol/L Tris-HCl)4℃透析过夜,收集透析后的洗脱液即为纯化的His-tagged-STAT4(565-748aa)蛋白样品,最后进行SDS-PAGE电泳、考马斯亮兰染色和免疫印迹分析鉴定。
1.2.7免疫印迹法鉴定融合蛋白 纯化的蛋白产物经SDS-PAGE胶电泳分离后,将融合蛋白转移至PVDF膜上,5%脱脂牛奶-TBST(pH7.6,0.02 mol/L Tris-HCl,0.14 mol/L NaCl,0.1% 吐温 20,5%脱脂牛奶)室温封闭1 h,加入兔抗HisG抗体,4℃孵育过夜,0.1% 吐温 20-TBS (pH7.6,0.02 mol/L Tris-HCl,0.14 mol/L NaCl,0.1% 吐温20)洗膜4次,每次5 min,再加入辣根过氧化物酶标记的山羊抗兔IgG,室温孵育2 h,0.1% 吐温20-TBS洗膜3次,TBS洗膜1次后ECL化学发光显色。
2 结果
2.1原核表达质粒pET-28a-STAT4-4的构建 结合STAT4功能域,设计引物,以pEGFP-STAT4为模板[12],采用PCR方法获得编码STAT4 565-748氨基酸肽段的基因片段,命名为STAT4-4,将之亚克隆到pET-28a(+)载体中,获得的重组质粒进行双酶切鉴定,在1.0%琼脂糖凝胶电泳,可见大小约550 bp插入片段及5.3 kb的载体条带(图1A),与理论值相符,将质粒进行DNA序列测定(图1B ),表明重组质粒构建成功,将其命名为pET-STAT4-4。
2.2His-tagged-STAT4(565-748aa)融合蛋白诱导表达条件摸索 诱导融合蛋白表达的条件为:诱导时间为4 h、诱导温度分别为25℃和37℃、诱导剂IPTG浓度分别为0.1 mmol/L和0.8 mmol/L。将细菌裂解液进行SDS-PAGE电泳和考马斯亮蓝染色,结合STAT4-4分子量大小,结果发现融合蛋白的分子量约为21 kD,符合理论值大小;还发现目的蛋白表达量在上述条件下,被诱导高表达(图2)。
2.3融合蛋白His-tagged-STAT4(565-748aa)的诱导表达 将IPTG诱导前后的菌液进行超声粉碎,收集上清和沉淀,进行SDS-PAGE凝胶电泳和考马斯亮蓝染色检测。结果发现在温度为25℃和37℃、IPTG浓度为0.1 mmol/L和0.8 mmol/L,诱导时间为4 h的诱导条件下所表达His-tagged-STAT4(565-748aa)融合蛋白以包涵体的形式存在于菌体沉淀中(图3)。最终选择IPTG为0.1 mmol/L、诱导温度25℃、诱导时间4 h作为融合蛋白诱导表达条件进行后续实验。
2.4重组包涵体蛋白的复性和纯化 将包涵体变性和复性、用BeyoGoldTM-His-tag纯化树脂对复性蛋白进行纯化,进行SDS-PAGE电泳及考马斯亮蓝染色,结果显示获得了融合蛋白,纯度尚可(图4A)。将洗脱蛋白合并,用透过分子量35 kD以上分子的透析膜将洗脱液进行透析,再行SDS-PAGE电泳和考马斯亮蓝染,结果显示获得了纯化的融合蛋白,纯度大于90%(图4B)。
2.5His-tagged-STAT4(565-748aa)融合蛋白的免疫印迹分析鉴定 将透析纯化的融合蛋白最后进行SDS-PAGE电泳,以抗HisG多克隆抗体为一抗进行免疫印迹分析。结果证实融合蛋白为His-tagged-STAT4(565-748aa)(图4C)。

图1 pET-STAT4-4质粒鉴定分析Fig.1 Identification of pET-STAT4-4 plasmidNote:A.Electrophoresis map of recombinant plasmids of pET-STAT4-4 digested by XhoⅠ and BamHⅠ.1.DNA marker:1 kD DNA ladder;2.Recombinant plasmids pET-STAT4-4 digested by XhoⅠ and BamHⅠ.Vector is 5.3 kb long.Inserted fragment is 0.55 kb long;3.DNA marker:DL1000 DNA marker;B.Map of DNA sequencing of STAT4-4.The red box shows the BamHⅠ and XhoⅠ cleavage joints.
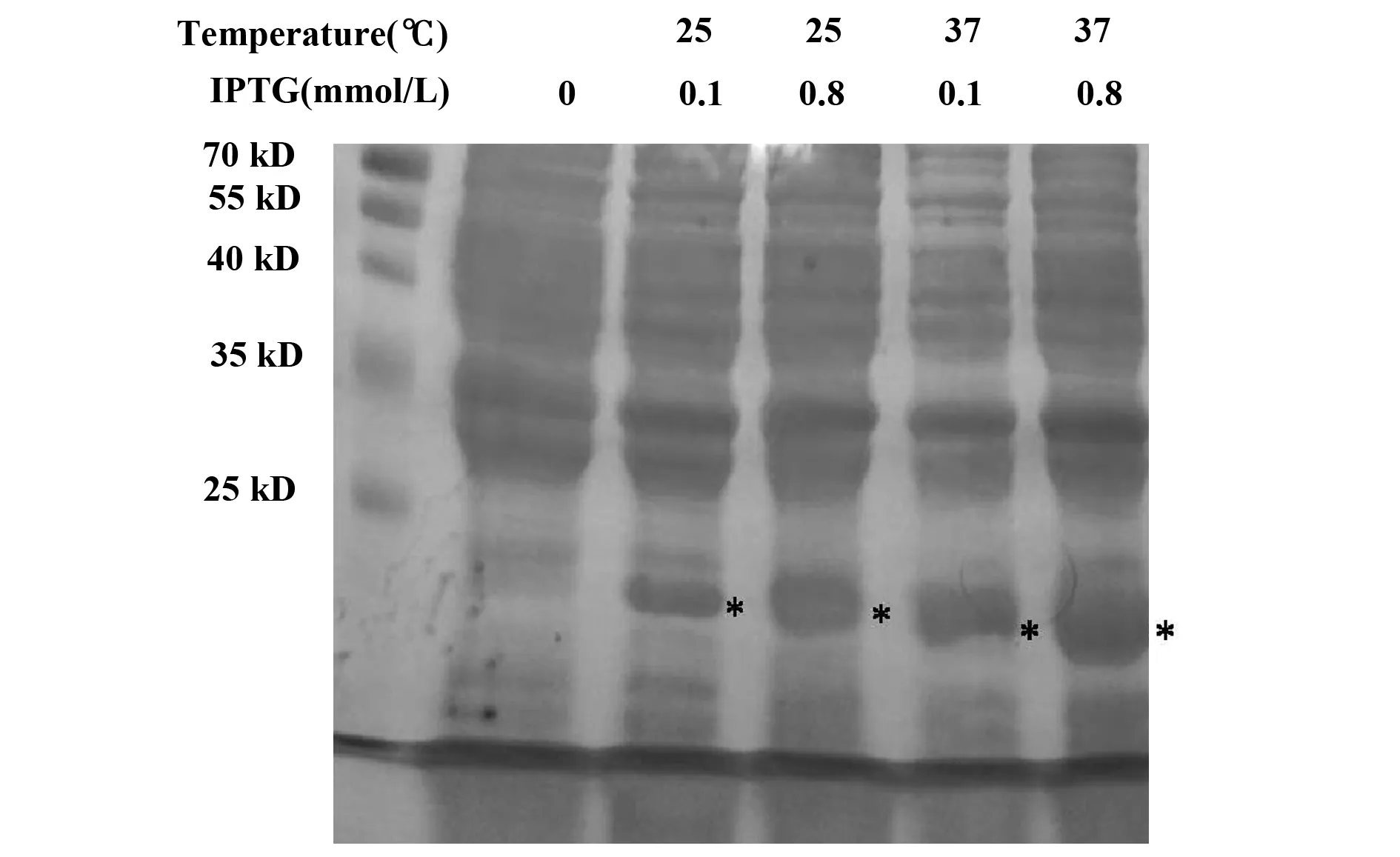
图2 不同条件诱导融合蛋白表达的SDS-PAGE电泳分析Fig.2 SDS-PAGE electrophoresis map of fusion protein induced under different conditionsNote:0.The lysate without induction by IPTG.*.Fusion protein.

图3 His-tagged-STAT4(565-748aa)融合蛋白的表达定位分析Fig.3 Localization of His-tagged-STAT4(565-748aa) fusion protein expressed in E.coliNote:*.His-tagged-STAT4(565-748aa) fusion protein.

图4 融合蛋白纯化及免疫印迹分析Fig.4 Purification and identification of fusion proteinNote:A.Electrophoresis map of the purified fusion protein.Marker:protein molecular weight marker.1-8.The collected elusion buffer at the 1st-8th time to elute the refolding fusion protein.*:Fusion protein;B.Electrophorsis map of the dialyzed fusion protein;C.Western blot analysis of dialyzed His-tagged-STAT4(565-748aa) fusion protein by using anti-HisG as the primary antibody.
3 讨论
研究报道通过经典的JAK/STAT途径,在细胞因子刺激下,STAT4的C-端693位酪氨酸残基发生磷酸化而被活化;进一步研究发现IL-12刺激的T细胞,还可以通过MKK6/p38途径活化STAT4,使STAT4发生693位酪氨酸磷酸化同时发生721位丝氨酸磷酸化,Ser721磷酸化能增强STAT4的转录活性[10,11]。在HTLV-1转化的T细胞系MT-2、MT-4及HUT102中STAT4也可同时发生Ser721和Tyr693磷酸化,并与STAT3形成异二聚体,反式激活高亲和力顺式可诱导原件(high-affinity sis-inducible element,hSIE)[13]。上述发现提示在STAT4蛋白C-端的丝氨酸或苏氨酸位点的磷酸化与STAT4活性高度相关。
对信号转导途径的研究有助于探讨细胞生物学行为机制、为疾病的发生、预防及治疗提供分子靶标。信号转导的常见方式是蛋白激酶介导的酶促级联反应,因此研究蛋白与蛋白间的相互作用,尤其研究酪氨酸激酶或丝氨酸/苏氨酸蛋白激酶与下游靶分子的相互作用是发现新的信号转导通路的有效策略。Grossmann采用酵母双杂交系统,以蛋白-蛋白相互作用启动核转录因子转录功能为原理,以含有SH2功能域和磷酸化的酪氨酸残基为钓饵,筛选能与之结合的可能的蛋白激酶。结果发现了一系列新的潜在的酪氨酸激酶[14]。本研究旨在通过原核表达系统获得STAT4 C-端包含SH2和含有Ser721和Tyr693的TAD功能域的肽段,拟以之为底物,通过体外激酶实验,探讨活化STAT4的潜在蛋白激酶,以进一步探讨STAT4活化的新的可能机制和潜在的生物学意义。
本研究采用基因克隆的方法克隆了STAT4编码565-748氨基酸肽段的基因片段,将之亚克隆到原核表达载体中,将此重组质粒转化感受态细胞,诱导融合蛋白表达,结果发现融合蛋白被表达在包涵体中,利用尿素变性溶解包涵体、逐级稀释复性、BeyoGoldTM-His-tag纯化树脂亲和层析结合低温透析四个步骤在大肠杆菌包涵体中成功纯化纯度达到90%以上的目的蛋白。本研究为STAT4潜在的新的功能研究准备了实验材料。
参考文献:
[1] Kaplan MH.STAT4:a critical regulator of inflammation in vivo[J].Immunol Res,2005,31(3):231-242.
[2] Horvath CM.STAT proteins and transcriptional responses to extracellular signals[J].Trends Biochem Sci,2000,25(10):496-502.
[3] 张 薇,杨林花.STAT4多态性与自身免疫性疾病相关性研究进展[J].中国免疫学杂志,2014,30(1):141-144.
Zhang W,Yang LH.Research progress on the correlation between STAT4 polymorphism and autoimmune diseases[J].Chin J Immunol,2014,30(1):141-144.
[4] Lupov IP,Voiles L,Han L,etal.Acquired STAT4 deficiency as a consequence of cancer chemotherapy[J].Blood,2011,118(23):6097-6106.
[5] Piotrowski P,Lianeri M,Wudarski M,etal.Contribution of STAT4 gene single-nucleotide polymorphism to systemic lupus erythematosus in the Polish population[J].Mol Biol Rep,2012,39(9):8861-8866.
[6] Lee YK,Landuyt AE,Lobionda S,etal.TCR-independent functions of Th17 cells mediated by the synergistic actions of cytokines of the IL-12 and IL-1 families[J].PLoS One,2017,12(10):e0186351.
[7] Wang Y,Qu A,Wang H,etal.Signal transducer and activator of transcription 4 in liver diseases[J].Int J Biol Sci,2015,11(4):448-455.
[8] Barnes J,Agarwal SK.Targeting STAT4 in systemic sclerosis:a promising new direction[J].Exp Rev Clin Immunol,2011,7(4):445-448.
[9] Zhang Y,Zhang Y,Gu W,etal.TH1/TH2 cell differentiation and molecular signals[J].Adv Exp Med Biol,2014,841:15-44.
[10] Morinobu A,Gadina M,Strober W,etal.STAT4 serine phosphorylation is critical for IL-12-induced IFN-gamma production but not for cell proliferation[J].Proc Natl Acad Sci U S A,2002,99(19):12281-12286.
[11] Ferreli C,Lai C,August S,etal.STAT4 expression and activation is increased during mitosis in vitro and in vivo in skin-and mucosa-derived cell types:implications in neoplastic and inflammatory skin diseases[J].J Eur Acad Dermatol Venereol,2017,31(10):1663-1673.
[12] 黄玉梅,文亚平,李轩岸,等.STAT4的DNA结合域中395~416位氨基酸残基序列参与IL-12介导的STAT4入核[J].生理学报,2012,64(4):372-378.
Huang YM,Wen YP,Li XA,etal.Amino acids 395-416 in DNA binding domain of STAT4 is involved in IL-12-induced nuclear import of STAT4[J].Acat Physiologica Sinica,2012,64(4):372-378.
[13] Higashi T,Tsukada J,Yoshida Y,etal.Constitutive tyrosine and serine phosphorylation of STAT4 in T-cells transformed with HTLV-I[J].Genes Cells,2005,10(12):1153-1162.
[14] Grossmann A,Benlasfer N,Birth P,etal.Phospho-tyrosine dependent protein-protein interaction network[J].Mol Syst Biol,2015,11(3):794-808.