额部孤立性纤维性肿瘤1例
2018-05-22徐秋实王莉芬
徐秋实,陶 娟,张 丽,田 娟,王莉芬,彭 芳
(1.孝感市中心医院 神经外科,湖北 孝感 432000;2.大连医科大学附属第二医院 病理科,辽宁 大连 116027;3.大连医科大学附属第二医院 影像科,辽宁 大连 116027)
1 临床资料
患者,女,43岁,因“双下肢乏力1年,发现额叶占位2 d”,于2016年7月19日到大连医科大学附属第二医院就诊。患者1年前,无明显诱因久坐后,出现双下肢乏力,双腿行走困难,未诊治;近期自觉上述症状发生频繁,遂于2016年7月17日于他院门诊行颅脑CT检查,示额叶占位,该处可见一类圆形团块状稍高密度影,界尚清,大小约4.36 cm×3.82 cm,其内密度欠均,病变跨越中线,周围可见片状低密度影,邻近侧脑室前角明显受压,见图1A。患者既往无高血压病史。为进一步诊治到我院就诊,入院后专科查体,神志清楚、语言流利,血压106/64 mmHg,嗅觉正常,视力视野正常,双侧瞳孔等大正圆,直径3.0 mm,对光反射灵敏。四肢肌力5级,肌张力适中。深浅反射存在,病理征阴性。双侧指鼻实验准确,快速轮替动作协调,跟膝胫实验稳准。实验室检查未见明显异常。2016年7月20日行颅脑MRI增强检查,示额部占位性病变,呈长T1短T2信号影,大小约4 cm×5 cm×5 cm,强化明显,边界尚清,可见肿瘤附着点位于前颅窝底及大脑镰,另于大脑镰可见另一点状强化病灶,大小约4 mm×5 mm,考虑脑膜瘤可能性大,见图1B~D。由于肿瘤较大,位于前额近前颅窝底,向后近冠状缝,向下推挤胼胝体膝部、体部,下丘脑受压,术前诊断为双额大脑镰旁脑膜瘤。遂于2016年7月20日行大脑镰旁脑膜瘤切除术。术中见肿瘤横跨双额,最大径达8 cm,肿瘤质硬,色红,血运丰富,边界尚清,肿瘤全部切除送病检。
肉眼观不整形组织多块,大小共10 cm×9 cm×3 cm,部分组织表面附片状硬脑膜,组织切面灰白色、实性、质韧。镜下见肿瘤细胞丰富,簇状或束状交错排列,细胞间可见较多嗜酸性胶原束,局部可见薄壁的分支的小血管;细胞稀疏区肿瘤细胞呈束状、小片状分布于黏液样变或玻璃样变的胶原束中。肿瘤细胞呈卵圆形或梭形,胞质少,细胞界限不清,染色质散在分布,核分裂象罕见,未见出血、坏死及非典型病变,见图2。免疫组织化学染色示肿瘤细胞CD34(+)、STAT6(+)、Bcl-2(+)、Vimentin(+)、Ki67增殖指数局灶10%,上皮膜抗原EMA(-)、S-100(-)、CD99(-)、胶质纤维酸性蛋白GFAP(-)、CD21(-)、平滑肌肌动蛋白SMA(-)、广谱上皮标记物AE1/AE3(-),PAS染色(-),见图3。病理诊断:额部孤立性纤维性肿瘤伴细胞增生活跃。
术后患者一般情况良好,无头晕、头痛、恶心及呕吐,无肢体活动不灵、感觉障碍及肢体抽搐,于2016年8月24日出院。2016月11月21日和2017年7月13日在大连医科大学附属第二医院复查颅脑MRI,显示肿瘤未复发,于2018年1月11日电话随访,该患者身体状态佳,无明显不适症状。
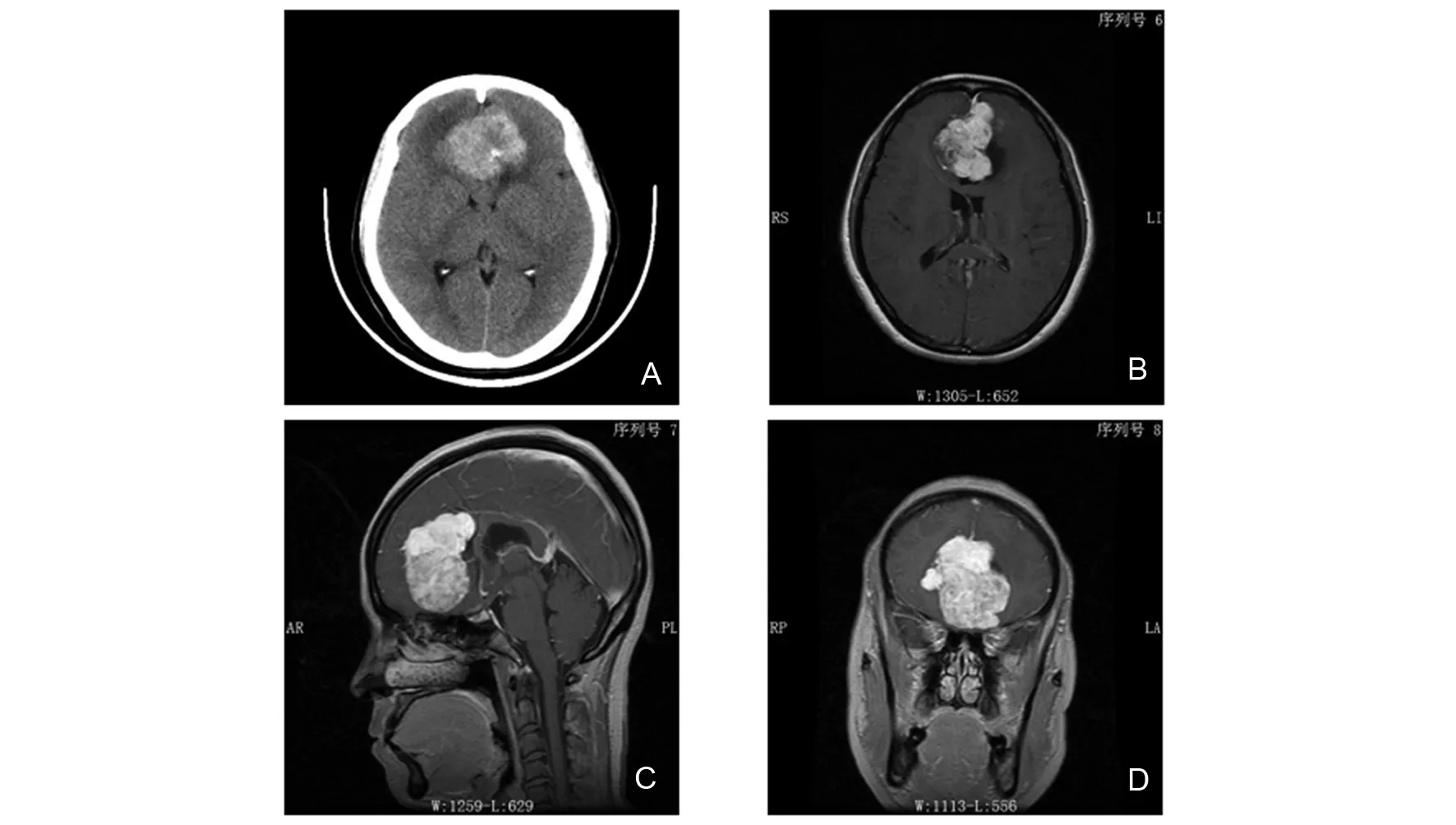
A:2016年7月17日头颅平扫CT图像示双侧额叶一类圆形团块状稍高密度影,边界尚清,大小约4.36 cm×3.82 cm;B-D:2016年7月20日头颅MRI增强图像。分别为轴位(B)、矢状位(C)、冠状位(D),示前颅窝底及大脑镰处一长T1短T2信号影,边界尚清,大小约4 cm×5 cm×5 cm,强化明显;B局部可见“脑膜尾”征图1 术前头颅影像Fig 1 Preoperation imagings of the skull
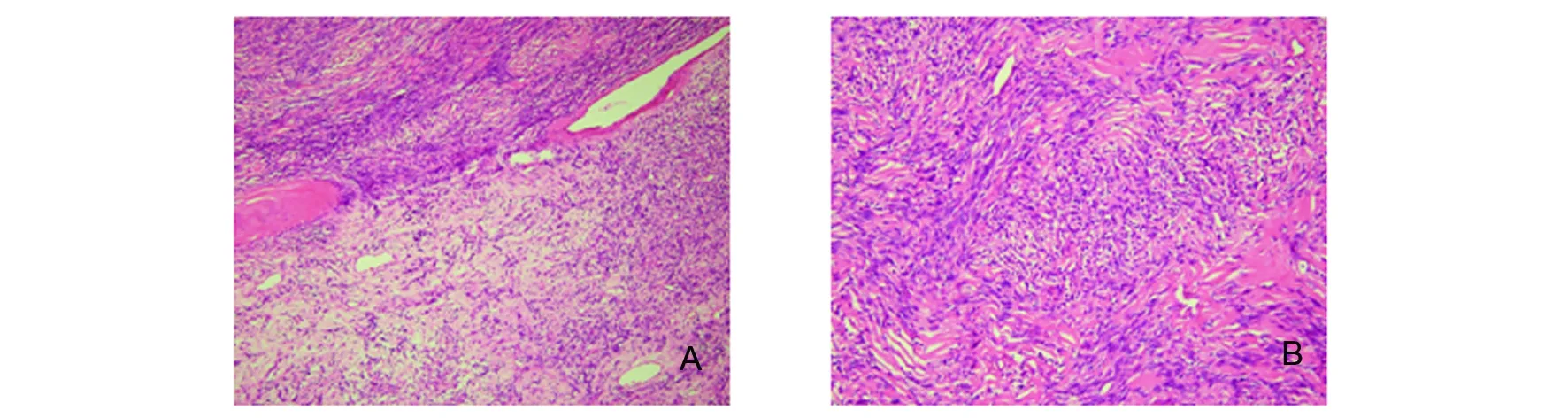
A: 肿瘤组织由细胞稀疏区(右下角)和细胞丰富区(左上角)构成(HE ×100);B: 肿瘤细胞间可见嗜酸性胶原和血管外周细胞瘤样小血管。肿瘤细胞呈卵圆形或梭形,胞质少,细胞界限不清(HE ×200)图2 脑膜孤立性纤维性肿瘤的组织形态特点Fig 2 Histological morphological characteristics of the meningeal solitary fibrous tumor
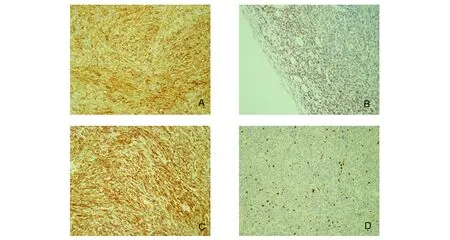
A:CD34蛋白免疫组化,肿瘤细胞膜弥漫强阳性(×200);B:STAT6蛋白免疫组化,肿瘤细胞核阳性(×200);C:Bcl-2蛋白免疫组化,肿瘤细胞膜/浆弥漫强阳性(×200);D:Ki67蛋白免疫组化,肿瘤细胞核阳性,指数约10%(×200)图3 脑膜孤立性纤维性肿瘤的免疫组化染色Fig 3 Immunohistochemical staining of the meningeal solitary fibrous tumor
2 讨 论
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一种间叶组织来源的少见的梭形细胞肿瘤,在1931年由Klemperer和Rabin[1]最先描述,该病常见于胸膜,少数病例发生在胸膜外,而发生在中枢神经系统十分少见,不足原发性中枢神经系统肿瘤的1%[2]。有数据显示,在2014年美国脑肿瘤登记中心统计每年每10万人中SFT/HPC的发病率是0.08例[2-3]。1995年Carneiro等[4]首次报道了起源于中枢神经系统脑膜的孤立性纤维性肿瘤。本病好发于中老年人(40~60岁),男性略多于女性[2]。本例是发生在大脑镰上的43岁女性患者,十分少见,与文献报道较一致。
SFT临床表现通常与肿瘤的发生部位、肿瘤的大小及压迫脑组织产生移位引起的颅内高压征有关。一般情况下,患者多以头痛为主要症状,其次是眩晕、视觉障碍、下肢乏力等[5-7]。本例患者以双下肢乏力,行走困难为主要症状就诊,行颅脑CT检查后,发现颅内占位性病变。该肿瘤体积较大,生长缓慢,横跨双额,位于前颅窝底大脑镰旁,CT扫描局部有“脑膜尾”征,易与纤维性脑膜瘤混淆。
SFT病理诊断需根据组织结构、细胞形态及免疫组化表达结果进行综合判断,孤立性纤维性肿瘤由细胞丰富区和细胞疏松区构成,梭形或卵圆形肿瘤细胞呈簇或束状交错排列,间质中可见较多嗜酸性胶原及黏液样变,可有血管外皮细胞瘤样的分支状血管。SFT免疫组化染色肿瘤细胞CD34(约80%~90%病例)和Vimentin蛋白弥漫强阳性,可表达Bcl-2蛋白(约30%病例)、CD99蛋白(约70%病例),这4项指标是诊断SFT和鉴别其他梭形细胞肿瘤的有效指标,但无特异性,因它们在隆突性皮肤纤维肉瘤、胃肠道间质瘤、神经源性肿瘤均可表达。偶尔灶状表达上皮膜抗原EMA(约30%病例)、平滑肌肌动蛋白SMA(约20%病例),一般情况下不表达S-100和CK[8]。本例病例Bcl-2、CD34和vimentin蛋白呈弥漫强阳性表达,而未表达CD99蛋白,这与Takenouchi和Bisceglia等[6-7]的报道略有差异,可能是由肿瘤的异质性引起。在少数病例中CD34蛋白表达阴性,此时可用另外一种特异性蛋白——STAT6进一步诊断。有文献报道SFT存在NAB2-STAT6基因转位,即神经生长因子诱导基因A结合蛋白2(nerve growth factor induced gene A binding protein 2,NAB2)和信号转导转录激活因子6(signal transducer and activator of transcriptin 6,STAT6)基因转位后形成融合基因,其只能通过传统的染色体分布和荧光原位杂交分析得出。近来研究证实,通过免疫组织化学染色检测STAT6蛋白,可以推断该融合基因的存在,该STAT6蛋白是诊断SFT及与其他疾病鉴别的高灵敏度和特异的指标[9-11]。本例中STAT6蛋白在肿瘤细胞胞核阳性表达,进一步支持SFT的诊断。
具有恶性潜在可能的SFT诊断标准如下:(1)肿瘤体积大小>5 cm;(2)存在远处转移;(3)向邻近组织浸润;(4)细胞密度增高;(5)细胞核具有多形性;(6)肿瘤细胞上CD34蛋白表达减少;(7)肿瘤坏死,局灶出血;(8)细胞核分裂象增多(核分裂象>4个/10个高倍视野);(9)细胞增殖指数>5%~10%[7-8]。
本例孤立性纤维性肿瘤需要与一组具有梭形细胞形态的肿瘤进行鉴别,如纤维型脑膜瘤、神经鞘瘤等。纤维型脑膜瘤的细胞核呈长梭形旋涡状或席纹状排列,大多伴有砂粒体及钙化形成,当缺乏典型组织特征需要进一步应用免疫组化染色鉴别,脑膜瘤肿瘤细胞表达上皮膜抗原EMA,一般不表达CD34、Bcl-2、S-100[12],可表达STAT6蛋白,但其在肿瘤细胞中的核(呈弱阳性)或胞浆(呈阳性)表达[13]。神经鞘瘤有梭形细胞构成的致密区和星芒状细胞构成的稀疏区,致密区的细胞核呈栅栏状结构排列,细胞核梭形,两端尖,强阳性表达S-100,一般不表达EMA、CD34、Bcl-2[14]。SFT有血管外周细胞瘤样的血管,故还需与血管外周细胞瘤鉴别,在WHO2008年中枢神经系统肿瘤分类中,SFT和血管外皮细胞瘤是两个独立的肿瘤,而在最新版本的WHO视为同一肿瘤,可能由于两者的遗传学改变相同(在12q13位点断裂,出现NAB2和STAT6基因融合,两者在蛋白表达水平上相似),但在组织形态上两者略有差异,HPC组织结构类似SFT中的细胞丰富区,肿瘤细胞核呈卵圆至圆形(甚至是上皮样),且有较多薄壁分支状或鹿角状的血管[7],而SFT中的血管相对较少或不典型。
另外,本例稀疏区局部伴有黏液样变,需与黏液样变的脊索瘤、脊索样脑膜瘤、黏液样变神经鞘瘤鉴别,但这样的病变范围较小,结合病变组织结构、细胞形态、免疫组化染色及PAS染色结果,可以排除上述疾病。
本例患者无明显恶性潜能指征,肿瘤已完全切除,故未行放疗。伴有症状的中枢神经系统SFT,通常采取手术治疗。对于SFT是否必须放疗,仍有争议[7,15]。但目前认为对于中枢神经系统的SFT有复发和转移的风险或者由于需要保留周边重要组织的功能而行肿瘤部分切除者,可以进行适当的局部放疗[7,16]。
颅内的SFT在中枢神经系统发生率低,为少见的实体肿瘤,缺乏大宗随访支撑对预后的评价,它们的生物学过程和预后目前尚不清楚。过去认为中枢神经系统(CNS)中SFT在肿瘤完全切除情况下,无恶性指征时,其性质呈良性,但最近有复发和转移的报道[6,17-18]。复发原因可能是该肿瘤自身就存在一定侵袭性,无法达到真正意义上的完全切除。最近有一研究对孤立性纤维性肿瘤转移风险进行了分层评估,认为可通过患者的年龄、肿瘤的大小、核分裂象计数/10个高倍视野及坏死4个指标进行分层分析并评分,其能较好地预测是否会发生远处转移[19]。若患者存在上述恶性潜能指征时,应对其给予高度重视、长期随访。本例患者无明显恶性潜能指征,且肿瘤已经完全切除,经过一年半的随访,该患者身体状态佳,无不适症状,复查头颅MRI未见肿瘤复发。从病理学角度看,本例SFT发生在中枢神经系统大脑镰旁,组织细胞形态较温和,核分裂象罕见, 未见出血、坏死及非典型病变,但是该肿瘤体积较大、细胞密度较高、局部区域Ki67增殖指数约10%,这在一定程度上提示有低度恶性潜能。因此我们会继续随访观察,为今后颅内SFT的预后转归补充数据。
参考文献:
[1] Klemperer P, Rabin CB. Primary neoplasms of the pleura: report of five cases[J]. Arch Pathol,1931,11: 385-412.
[2] Louis DN, Ohgak H, Wiestlter OD, et al. WHO classification of tumors of the central Nervous system[M]. Revised 4th. Edition. Maestro 38330 Saint-Ismier, France: International Agency for Research on Cancer(IARC),2016:248-254.
[3] Ostrom QT, Gittleman H, Liao P, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2007-2011[J]. Neuro Oncol, 2014,16 (Suppl 4):iv1-63.
[4] Carneiro SS, Scheithauer BW, Nascimento AG, et al. Solitary fibrous tumor of the meninges: a lesion distinct from fibrous meningioma. A clinicopathologic and immunohistochemical study[J].Am J Clin Pathol,1996,106(2):217-224.
[5] Chen YQ, Wei JJ, Wang RZ, et al. A Case of Intracranial Solitary Fibrous Tumor[J]. Chin Med J (Engl), 2016,129(22):2767-2768.
[6] Takenouchi T, Pannullo SC, Stieg PE, et al. Solitary fibrous tumor with multiple intracranial and spinal lesions: case report[J]. Neurosurgery, 2011,68(4):E1148-1151.
[7] Bisceglia M, Dimitri L, Giannatempo G, et al. Solitary fibrous tumor of the central nervous system: report of an additional 5 cases with comprehensive literature review[J].Int J Surg Pathol, 2011,19(4):476-486.
[8] Castellani D, Sebastiani G, Maurelli S, et al. Solitary fibrous tumor/hemangiopericytoma of the penis: Report of the first case[J].Urologia,2015,82(2):127-129.
[9] Doyle LA, Vivero M, Fletcher CD, et al. Nuclear expression of STAT6 distinguishes solitary fibrous tumor from histologic mimics[J].Mod Pathol,2014,27(3):390-395.
[10] Rekhi B, Shetty O, Tripathi P, et al. Molecular characterization of a series of solitary fibrous tumors, including immunohistochemical expression of STAT6 and NATB2-STAT6 fusion transcripts, using Reverse Transcriptase(RT)-Polymerase chain reaction(PCR) technique: An Indian experience[J]. Pathol Res Pract, 2017, 213(11):1404-1411.
[11] 张夏玲,程海霞,包芸,等.STAT6免疫组织化学染色在孤立性纤维性肿瘤/脑膜血管外皮瘤诊断中的应用价值探讨[J].中华病理学杂志,2016,45(2):97-101.
[12] Hakan T, Türk CC, Aker FV.Tentorial solitary fibrous tumour: case report and review of the literature[J]. Neurol Neurochir Pol, 2009,43(1):77-82.
[13] Schweizer L, Koelsche C, Sahm F, et al. Meningeal hemangiopericytoma and solitary fibrous tumors carry the NAB2-STAT6 fusion and can be diagnosed by nuclear expression of STAT6 protein[J].Acta Neuropathol,2013,125(5):651-658.
[14] Metellus P, Bouvier C, Guyotat J,et al. Solitary fibrous tumors of the central nervous system: clinicopathological and therapeutic considerations of 18 cases[J].Neurosurgery, 2007,60(4):715-722.
[15] Macfarlane RG, Galloway M, Plowman PN, et al. A highly vascular intracranial solitary fibrous tumor treated with radiotherapy and toremifene: case report[J].Neurosurgery,2005,56(6):E1378.
[16] Bisceglia M, Galliani C, Giannatempo G, et al. Solitary fibrous tumor of the central nervous system: a 15-year literature survey of 220 cases (August 1996-July 2011)[J]. Adv Anat Pathol,2011,18(5):356-392.
[17] Gessi M, Gielen GH, Roeder-Geyer ED,et al. Extracranial metastasizing solitary fibrous tumors (SFT) of meninges: histopathological features of a case with long-term follow-up[J].Neuropathology,2013,33(1):68-74.
[18] Osuga T, Hayashi T, Ishiwatari H, et al. Pancreatic metastasis from a solitary fibrous tumor of the central nervous system[J].JOP,2014,15(1):58-62.
[19] Demicco EG, Wagner MJ, Maki RG, et al. Risk assessment in solitary fibrous tumors: validation and refinement of a risk stratification model[J].Mod Pathol, 2017,30(10):1433-1442.
