基于倾向性评分匹配法的经导管肝动脉化疗栓塞联合高强度聚焦超声治疗肝癌的生存情况分析
2018-05-19龚建平
马 荣,朱 辉,龚建平
1. 重庆医科大学附属第二医院肝胆外科,重庆 400010;
2. 重庆医科大学附属第二医院海扶中心,重庆 400010
原发性肝癌是肝脏常见的恶性肿瘤,在全世界癌症相关死因中位列第二,在发展中国家发病率最高,但在发达国家中也呈上升趋势[1-2]。原发性肝癌患者早期一般无明显症状,发现时常已为中晚期,失去手术机会,预后较差[3]。对于极早期和早期肝癌而言,手术切除无疑是首选的治疗方案[4],但对于已失去手术机会的中晚期肝癌或其他社会原因拒绝手术的患者,则宜进行个体化综合治疗[5],目前临床上仍以经导管肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)为主的化疗为首选方法,同时TACE也是非手术治疗原发性肝癌中运用最广泛的治疗方法[6]。高强度聚焦超声(high intensity-focused ultrasound,HIFU)是一种非侵入性治疗实体肿瘤的新技术,利用超声波在体外发射,并在体内靶组织聚焦,焦点区域形成瞬时高温至肿瘤细胞死亡,它主要通过焦点处产生的热效应、空化效应及机械效应等机制杀死肿瘤细胞。体外高强度聚焦超声是近年来兴起的用于治疗原发性肝癌的一种新型非手术治疗方式,单独应用即可取得一定治疗效果[7-8],而联合HIFU与经典非手术治疗方式TACE治疗肝癌更是近年来的研究热点,但对于联合治疗的具体治疗效果仍有待进一步评价[9]。因此,本文回顾总结了重庆医科大学附属第二医院两年间HIFU与TACE治疗的患者资料,尝试对HIFU联合TACE治疗原发性肝癌的疗效进行评价。
1 资料和方法
1.1 一般资料
收集重庆医科大学附属第二医院2015年1月—2016年8月收治的161例原发性肝癌患者的临床资料,根据以下标准进行筛选。纳入标准:① 临床、影像学资料或病理检查明确诊断为原发性肝癌的患者;② 接受TACE联合HIFU治疗或单纯TACE治疗连续两次或以上的患者;③ 有完整的患者资料及随访资料。排除标准:① 除进行HIFU、TACE治疗外,还进行了射频消融、无水乙醇灌注等其他治疗;② 治疗后复查资料缺失;③ 伴有其他器官恶性肿瘤;④ 卡氏评分(Karnofsky Performance Status,KPS)对功能状态进行评分[10]小于70、有严重肝功能障碍或其他严重器官功能障碍者。本研究获得本院伦理委员会批准, 并取得患者知情同意书。
根据上述纳入排除标准,被排除的患者40例,最后收集患者121例,其中男性105例,女性16例,年龄28~78岁,平均(53.7±11.0)岁。所有患者均根据美国国立综合癌症网(National Comprehensive Cancer Network,NCCN)诊断标准[11-12]确诊:在肝硬化或者慢性肝病基础上发现肝脏占位性病变,且3期增强的影像学检查如CT、MRI、超声造影(contrast-enhanced ultrasound,CEUS)出现两种典型的强化方式或者穿刺活检组织学检查确诊为原发性肝癌。排除相关禁忌证,告知患者及家属以上两种治疗方式利弊后,患者自愿选择其中一种治疗方案,遂将121例患者由此分为2组,55例患者采取TACE联合HIFU治疗(HIFU组),66例患者仅采取TACE治疗(TACE组)。
1.2 仪器与方法
所有患者均完善相关检查,排除相关治疗禁忌证。HIFU组:首先行TACE治疗,6~28 d后行HIFU治疗(中位时间为10 d),两次治疗均在一次住院周期中完成。TACE组:行两次TACE治疗,两次治疗间隔1~6个月(中位时间为2个月),两次治疗在两次住院周期中分别完成。TACE治疗:局部麻醉后采用Seldinger穿刺技术经右股动脉穿刺插管,采用DSA动脉造影,将导管插入肝动脉入口处,造影以明确肝癌的位置、大小、数量及肝动脉血供情况,必要时可选用微导管超选插入肝右动脉及肝左动脉,尽量插管至肿瘤供血动脉。导管插入成功后,将化疗药物(洛铂、雷替曲塞、博来霉素、丝裂霉素及吡柔比星等)适当稀释后,经导管缓慢灌入,灌注时间在20 min以上;化疗后栓塞,将超液化碘油与化疗药物充分混合后的乳剂,经微导管选择插入肿瘤的供血支,灌入靶血管。HIFU治疗:使用重庆医科大学附属第二医院海扶中心的聚焦超声肿瘤治疗系统,全身麻醉下通过B超探头定位肿瘤组织,并勾勒出其轮廓,在计算机系统中重建肿瘤的三维形态,准确定位病灶后按5 mm层距将病灶分为若干连续切面,从深至浅逐层治疗,直至完全覆盖靶区(频率0.8 MHz,焦距135.0和160.0 mm,直线扫描3 mm/s,功率120~240 W,时间85~300 min)。
分析两组患者治疗前后的临床资料,观察以下指标:临床症状的改善情况;肝功能(谷丙转氨酶、白蛋白及胆红素)的变化;凝血功能变化凝血酶原时间(prothrombin time,PT);肿瘤标志物甲胎蛋白(alpha fetoprpteon,AFP)的变化;术后不良反应发生情况;术后生存时间(随访方案:门诊及电话随访,治疗后1、3和6个月门诊复查AFP、肝功、凝血常规、上腹部CT或MRI,1年后电话随访生存情况)。根据治疗前基线资料的不均衡性,本研究采取倾向性评分匹配法(propensity score matching,PSM)均衡基线资料,即通过模型估计倾向指数后,从TACE组中选出与HIFU组倾向指数相同或相近的个体进行配对,以达到均衡组间协变量的目的[13-14]。采用1∶1最近邻居匹配法,卡钳值取0.02,以HIFU组为基准组匹配成功后[15],再利用匹配后新样本对治疗有效率及生存率进行分析。
1.3 统计学处理
采用SPSS 22.0统计分析软件进行统计学处理,计量资料采用x±s表示,数据符合正态分布、方差齐性,组间比较采用t检验;数据非正态分布,组间比较则用Mann-WhitneyU检验;计数资料采用率值表示,组间比较采用χ2检验或Fisher精确检验;利用寿命表法计算无进展生存及总生存患者比率,采用Kaplan-Meier法比较两组生存曲线,利用多因素COX回归分析评估影响无进展生存时间(progression-free survival,PFS)及总生存期(overall survival,OS)预后因素;当单因素分析时变量P<0.05,则纳入为多因素分析[16];所有检验均为双侧,P<0.05为差异有统计学意义;再利用SPSS 22.0进行倾向性评分匹配,得到新样本。
2 结 果
2.1 组间基线资料比较
两组患者匹配前后一般资料比较见表1,有无门静脉癌栓及甲胎蛋白水平差异有统计学意义(P<0.05),其他指标差异均无统计学意义(P>0.05)。将两组患者进行倾向性匹配,两组共46对匹配成功。是否有门静脉癌栓和AFP水平在两组间不平衡的协变量经匹配后均达到平衡(P>0.05)。
2.2 治疗后临床疗效观察
2.2.1 治疗后症状缓解情况
对治疗前有明显临床症状(主要为肝区隐痛、腹胀、乏力)的患者进行观察,两种治疗方式治疗后患者症状均有不同程度的缓解,但两组均有5%~6%的患者出院前有轻度不适。
2.2.2 治疗后各指标变化及不良反应
患者两次治疗前后查血指标见表2,与治疗前比较,其他指标均有轻度增高或降低,差异无统计学意义(P>0.05)。两组间比较,仅AFP水平组间比较差异有统计学意义(P<0.05)。匹配后患者治疗前后及组间比较差异无统计学意义(P>0.05)。治疗后不良反应见表3,HIFU组不良反应发生率为83.6%,TACE组为66.7%,但差异无统计学意义(P>0.05),两组患者治疗后肝区疼痛、腹胀、发热均较常见,头晕、纳差、乏力等表现均较少见,恶心、呕吐、反酸、腹泻等胃肠道反应TACE组较多见,HIFU组出现皮肤肿胀、麻木2例,肺炎、胸腔积液1例,严重并发症肋骨骨折1例,而在TACE组均未观察到。出院前,以上并发症经治疗后均完全缓解。

表 1 基线资料比较(匹配前后)Tab. 1 Baseline data comparison (before and after matching)

表 2 治疗后指标(匹配前后)Tab. 2 Post-treatment indexes (before and after matching)

表 3 不良反应Tab. 3 Side effects[n(%)]
2.2.3 生存分析
本次研究随访终点为治疗后1年或者死亡,到截止日期仍存活或随访中断者,生存分析时以删失值处理。PFS曲线、OS曲线见图1。HIFU组3个月、6个月和1年累积生存率为98.0%、95.0%和92.0%,TACE组分别为91.0%、84.0%和73.0%,组间OS差异有统计学意义(P<0.05,HR=0.311,95%CI:0.108~0.901),PFS差异无统计学意义(P>0.05,HR=0.088,95%CI:0.570~1.386)。匹配后两组PFS曲线、OS曲线见图2。HIFU组3个月、6个月和1年累积生存率为97.0%、94.0%和94.0%,TACE组分别为92.0%、84.0%和75.0%,组间OS差异有统计学意义(P<0.05,HR=0.245,95%CI:0.064~0.937),PFS差异无统计学意义(P>0.05,HR=0.930,95%CI:0.525~1.554)。单因素分析结果显示,有腹水为PFS、OS危险因素(P<0.05),而纳入多因素COX比例风险分析后,有腹水并不是OS、PFS的独立危险因素(P>0.05)。
3 讨 论
原发性肝癌在我国发病率较高,目前仍以手术为最佳治疗方式。但就无法外科手术的中晚期肝癌及其他原因无法接受手术的早期肝癌而言,仍有TACE、射频消融、无水乙醇灌注、HIFU等治疗方式可供选择,其中,TACE是目前公认的首选治疗方式。TACE是通过肝动脉将栓塞剂和化疗药物直接注入,阻断肿瘤血供,使该组织缺血坏死。但是,由于肝癌由肝动脉及门静脉双重供血,TACE并不能彻底阻断肝癌血供,这往往导致肝癌复发。HIFU是将超声波作为能源聚焦在体内,将声波转换成热能,使靶组织升温致肿瘤细胞凝固性坏死。有研究发现,对于肿瘤直径在4 cm以下且血管较少的原发性肝细胞癌或转移性肝癌,HIFU治疗可提高患者的近期生存率,对中晚期肝癌亦有一定疗效。单独应用TACE和HIFU治疗肝癌均不能取得理想的效果。
本研究结果表明,无论倾向性匹配前后,组间PFS差异均无统计学意义,1年OS率在TACE联合HIFU治疗组有明显优势,说明TACE联合HIFU治疗原发性肝癌对提高患者短期生存率是明显有效的。既往大量研究[17-20]表明,TACE联合HIFU治疗中晚期肝癌有显著疗效,但其在早期肝癌的治疗尚未有研究涉及。本研究20.7%的患者为早期肝癌患者,虽然首选治疗方案为手术切除,但均因不同原因拒绝外科手术,自愿选择TACE或联合HIFU治疗。研究结果表明,相较于单纯TACE,TACE联合HIFU治疗早期肝癌也是有优势的。HIFU通过局部消融可使病灶达完全坏死[21]。有研究[18]发现,TACE所运用的碘化油对HIFU有增效作用,对减少靶组织血供具有增效作用,并且能明显减少HIFU治疗中所需能量,遂于HIFU治疗前率先进行TACE治疗是有理论依据的。但如治疗前及治疗中检查均不能发现的微小病灶,其最大直径小于超声换能器有效焦距,HIFU就可能错过微小肿瘤,从精确诊断发现极微小病灶的层面上看,TACE有其明显优势。另外,如为多发病灶,HIFU治疗只能分次逐批治疗,周期较长。长期反复多次进行HIFU联合TACE治疗才能真正发挥HIFU与TACE的协同作用,这使得其在长期生存率上有明显获益。在治疗后严重并发症方面,既往研究证实,TACE治疗后可能发生肝衰竭、肝脓肿、肝性脑病、感染性休克、坏死性胰腺炎及脑碘油栓塞等[22-25],HIFU治疗后可能发生肋骨骨折、脏器穿孔损伤、胸腔积液、癌灶破裂出血以及皮肤重度烧伤等严重并发症[26-29],而本研究除HIFU组观察到肋骨骨折及胸腔积液患者各1例外,未见其他严重并发症。

图 1 患者的无进展生存时间曲线、总生存曲线Fig. 1 The PFS and OS curves of the patients
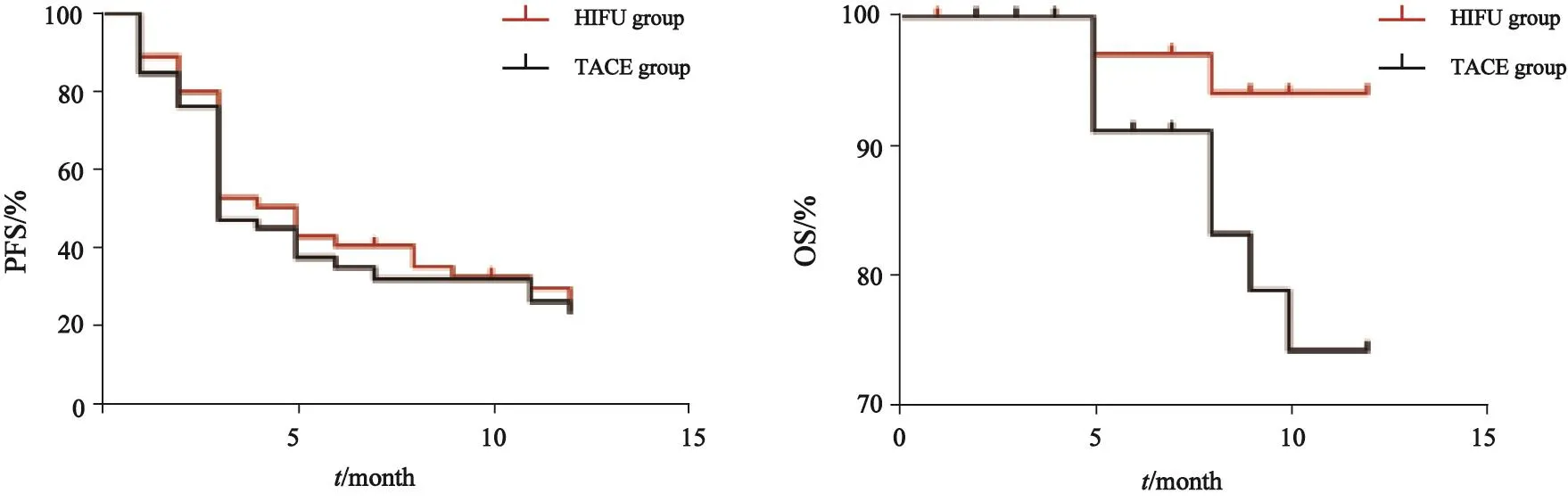
图 2 匹配后患者的无进展生存时间曲线、总生存曲线Fig. 2 The matched PFS and OS curves of the patients
当然,本研究也有一些不足之处。首先,资料进行倾向性匹配前有无门静脉癌栓及AFP水平组间有明显差异,但随后在资料匹配后取得了组间平衡,并且多因素分析证实它们均不是影响预后的危险因素。其次,本研究中大部分患者未取得病理学活检结果,难免有误诊患者,但这种比例应该是相当低的。最后,本研究为单中心研究,研究结果还需大规模、多中心、随机临床试验进一步证实,更需要长期随访以明确远期疗效。
[参 考 文 献]
[1] CIDON E U. Systemic treatment of hepatocellular carcinoma:past, present and future[J]. World J Hepatol, 2017, 9(18):797-807.
[2] RIAZ A, GABR A, ABOUCHALEH N, et al. Radioembolization for hepatocellular carcinoma: statistical confirmation of improved survival in responders by landmark analyses[J].Hepatology, 2017, doi: 10.1002/hep.29480.
[3] FORNER A, REIQ M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245-1255.
[4] WONG R J, WANTUCK J, VALENZUELA A, et al. Primary surgical resection versus liver transplantation for transplanteligible hepatocellular carcinoma patients[J]. Dig Dis Sci,2014, 59(1): 183-191.
[5] MOON H, CHOI J E, LEE I J, et al. All-treatment array of hepatocellular carcinoma from initial diagnosis to death:observation of cumulative treatments[J]. J Cancer Res Clin Oncol, 2017, 143(11): 2327-2339.
[6] HUO Y R, ESLICK G D. Transcatheter arterial chemoembolization plus radiotherapy compared with chemoembolization alone for hepatocellular carcinoma:a systematic review and meta-analysis[J]. JAMA Oncol,2015, 1(6): 756-765.
[7] DIANA M, SCHIRALDI L, LIU Y Y, et al. High intensity focused ultrasound (HIFU) applied to hepato-bilio-pancreatic and the digestive system-current state of the art and future perspectives[J]. Hepatobiliary Surg Nutr, 2016, 5(4): 329-344.
[8] SHE W H, CHEUNG T T, JENKINS C R, et al. Clinical applications of high-intensity focused ultrasound[J]. Hong Kong Med J, 2016, 22(4): 382-392.
[9] ZHAO J, ZHANG H, WEI L, et al. Comparing the longterm efficacy of standard and combined minimally invasive procedures for unresectable HCC: a mixed treatment comparison[J]. Oncotarget, 2017, 8(9): 15101-15113.
[10] SUH S Y, LEBLANC T W, SHELBY R A. Longitudinal patientreported performance status assessment in the cancer clinic is feasible and prognostic[J]. J Oncol Pract, 2011, 7(6): 374-381.
[11] CASSINOTTO C, AUBEE C, DOHAN A. Diagnosis of hepatocellular carcinoma: an update on international guidelines[J]. Diagn Interv Imaging, 2017, 98(5): 379-391.
[12] MASTERS G A, KRILOV L, BAILEY H H, et al. Clinical cancer advances 2015: annual report on progress against cancer from the American Society of Clinical Oncology[J]. J Clin Oncol, 2015, 33(3): 1-27.
[13] MORGAN C J. Reducing bias using propensity score matching[J]. J Nucl Cardiol, 2017, doi: 10.1007/s12350-017-1012-y.
[14] GARRIDO M M, KELLEY A S, PARIS J, et al. Methods for constructing and assessing propensity scores[J]. Health Serv Res, 2014, 49(5): 1701-1720.
[15] HAUKOOS J S, LEWIS R J. The propensity score[J]. JAMA,2015, 314(15):1637 -1638.
[16] LIU H, WANG Z G, FU S Y, et al. Randomized clinical trial of chemoembolization plus radiofrequency ablation versus partial hepatectomy for hepatocellular carcinoma within the Milan criteria[J]. Br J Surg, 2016, 103(4): 348-356.
[17] LI C, ZHANG W, ZHANG R, et al. Therapeutic effects and prognostic factors in high-intensity focused ultrasound combined with chemoembolisation for larger hepatocellular carcinoma[J]. Euro J Cancer, 2010, 46(13): 2513-2521.
[18] WU F, WANG Z B, CHEN W Z, et al. Advanced hepatocellular carcinoma: treatment with high-intensity focused ultrasound ablation combined with transcatheter arterial embolization[J].Radiology, 2005, 235(2): 659-667.
[19] 金成兵, 伍 烽, 王智彪, 等. 高强度聚焦超声联合动脉栓塞化疗治疗晚期肝癌的初步临床研究[J]. 中华肿瘤杂志,2003, 25(4): 401-403.
[20] CAO H, XU Z, LONG H, et al. Transcatheter arterial chemoembolization in combination with high-intensity focused ultrasound for unresectable hepatocellular carcinoma: a systematic review and meta-analysis of the Chinese literature[J]. Ultrasound Med Biol, 2011, 37(7):1009-1016.
[21] HAN Y, HOU G Y, WANG S, et al. High intensity focused ultrasound (HIFU) focal spot localization using harmonic motion imaging(HMI)[J]. Phys Med Biol, 2015, 60(15): 5911-5924.
[22] SUN W, XU F, LI X, et al. A case series of liver abscess formation after transcatheter arterial chemoembolization for hepatic tumors[J]. Chin Med J (Engl), 2017, 130(11): 1314-1319.
[23] TORO A, BERTINO G, ARCERITO M C, et al. A lethal complication after transarterial chemoembolization with drugeluting beads for hepatocellular carcinoma[J]. Case Rep Surg, 2015, 2015: 873601.
[24] TU J, JIA Z, YING X, et al. The incidence and outcome of major complication following conventional TAE/TACE for hepatocellular carcinoma[J]. Medicine (Baltimore), 2016,95(49): e5606.
[25] CHU H J, LEE C W, YEH S J, et al. Cerebral lipiodol embolism in hepatocellular carcinoma patients treated with transarterial embolization/chemoembolization[J]. PLoS One, 2015, 10(6):e0129367.
[26] MALONEY E, HWANG J H. Emerging HIFU applications in cancer therapy[J]. Int J Hyperthermia, 2015, 31(3): 302-309.
[27] 吴 阳, 李 捷, 张水军, 等. 高强度聚焦超声联合经动脉化疗栓塞治疗原发性肝细胞癌的疗效观察[J]. 中华外科杂志, 2012, 50(8): 691-694.
[28] JUNG S E, CHO S H, JANG J H, et al. High-intensity focused ultrasound ablation in hepatic and pancreatic cancer:complications[J]. Abdom Imaging, 2011, 36(2):185-195.
[29] MA W H, HO W Y, LAI A S, et al. Characteristic uptake pattern of bone scintigraphy in patients with hepatocellular carcinoma following treatment with high-intensity focused ultrasound[J].Nucl Med Mol Imaging, 2013, 47(4): 273-277.
