茅苍术叶片蛋白提取方法的比较
2018-05-18张文明巢建国陆奇杰侯皓然
张文明,巢建国,谷 巍,陆奇杰,侯皓然
(南京中医药大学药学院,江苏南京210023)
茅苍术[Atractylodes lancea(Thunb.)DC.]为菊科多年生草本,其根茎具有燥湿健脾、祛风散寒、明目之功效[1]。近年来,由于种种环境胁迫和人为因素等对茅苍术的品质和资源储量造成了严重影响,已被江苏省列为珍稀濒危药用植物之一。曾燕等研究结果表明,30℃以上的高温胁迫会限制茅苍术的生长,但有利于其主要活性成分挥发油的积累[2]。顾永华等研究结果表明,果后期对茅苍术进行适宜的涝渍胁迫有利于提高其根茎生长及挥发油含量[3]。目前,对茅苍术这些抗逆机制的研究尚未见报道。因此,从蛋白质角度能更好了解逆境对茅苍术各种生化和信号途径的影响[4],对弄清茅苍术的一系列抗逆分子机制具有重要意义。而蛋白质的提取是茅苍术蛋白质水平研究的重要一步,对这方面研究尚未报道。本试验以茅苍术叶片为原料,对茅苍术叶片蛋白质的提取方法及工艺条件进行研究,并运用SDS-PAGE法对其进行分析,在此基础上建立适宜茅苍术叶片蛋白提取和SDS-PAGE的一套方法,以期为茅苍术蛋白质组学研究提供参考依据。
1 材料与方法
1.1 材料与试剂
试验材料为江苏省镇江茅山地区的茅苍术,种植于南京中医药大学药用植物园内。经南京中医药大学中药资源与鉴定系巢建国教授鉴定为菊科植物茅苍术。
彩虹245广谱蛋白Maker,胆酰胺基丙基二甲基铵基丙磺酸盐(CHAPS),乙二胺四乙酸(EDTA),聚乙烯吡咯烷酮(PVP,北京索莱宝科技有限公司);二硫苏糖醇(DTT,上海阿拉丁生化科技有限公司);牛血清白蛋白(上海惠兴生化试剂有限公司);三羟甲基氨基甲烷(Tris),盐酸(HCl)等试剂均为分析纯,水为双蒸水。
1.2 仪器设备
Mini Trans-BlotCell型电泳槽和 PowerPac Basic系列电泳仪,美国Bio-Rad公司;UV-1800PC紫外可见分光光度计,上海美谱达仪器有限公司;SIGMA3-18K高速冷冻离心机,北京博劢行仪器有限公司;Tanon-5200Multi多功能成像系统,上海天能科技有限公司。
1.3 蛋白质提取方法
1.3.1 直接提取法 取0.2 g茅苍术叶片,按其鲜质量的10%加入 PVP,按 1 g∶1 mL加入蛋白提取液(50 mmol/L Tris-HCl,pH值 7.0),在 0℃ 低温下研碎,于 4℃、12 000 r/min离心 20 min,取上清液作为待测蛋白上样液[5]。
1.3.2 TCA-丙酮法 取0.2 g茅苍术叶片加入液氮研磨完全,加入2 mL预冷的含体积分数10%TCA、0.07%β-巯基乙醇(β-Me)丙酮溶液,混匀完全后于-20℃静置2 h,4℃、12 000 r/min离心20min,弃上清液。于沉淀物中加入2mL含0.07%β-Me预冷丙酮溶液,在-20℃下静置2 h,于4℃、12 000 r/min条件下离心20 min,重复漂洗2次。最后加入2 mL预冷的80%丙酮溶液洗涤沉淀物,在4℃、12 000 r/min条件下离心20min,于-20℃下挥干,即得蛋白粉末[6]。
1.3.3 Tris-丙酮法 取0.2 g茅苍术叶片于液氮中研磨完全,立即加入 2 mL提取缓冲液[0.04 mol/L Tris-base,5 mol/L尿素、2 mol/L硫脲、20 mg/mL CHAPS、50 mg/mL PVP,20 mg/mLβ-Me],完全混匀后在 4℃、12 000 r/min离心20 min,取上清液,加入4倍体积预冷的含 0.07% β-Me的丙酮溶液进行漂洗,在-20℃冰箱中静置2 h后于4℃、12 000 r/min下离心20 min,得沉淀,然后用预冷的含0.07%β-Me丙酮溶液漂洗沉淀,振荡混匀,-20℃下静置2 h,于4℃、12 000 r/min下离心20 min,收集沉淀,重复漂洗3次。收集的沉淀物在-20℃下挥干,即得蛋白粉末[7-8]。
1.3.4 Tris-饱和酚法 称取0.2 g茅苍术叶片加液氮充分研磨,加 1 mL蛋白提取液[0.1 mol/L Tris-HCl(pH值8.8)、0.01 mol/L EDTA、4%β-Me、0.9 mol/L蔗糖]和 1 mL Tris-饱和酚(pH值8.5),研磨30 s,转入离心管。4℃混匀,于4℃、12 000 r/min离心20 min。取上层酚相0.4 mL至无菌离心管中,加入4倍体积预冷的含0.1 mol/L的乙酸铵甲醇溶液,混匀,-20℃放置2 h,4℃、12 000 r/min离心20min,弃上清。沉淀依次用预冷的含 0.1 mol/L乙酸铵、0.01 mol/L DTT的甲醇溶液和预冷的含0.01 mol/L DTT的80%甲醇溶液各清洗2次,所得沉淀 -20℃ 挥干,即得蛋白粉末[9-10]。
1.4 蛋白提取液的裂解和含量测定
分别取上述提取所得的蛋白粉末70 mg,加入700μL裂解液(8 mol/L尿素、2 mol/L硫脲、40 mg/mL CHAPS、1%DTT),在25℃超声清洗器中超声处理,每次5 min,间隔期间振荡30 s,超声处理 40 min后,于 4℃、12 000 r/min离心20 min,移取上清液至新的离心管,即为待测蛋白上样液[8]。用Bradford法[11]作标准曲线测定蛋白含量。
1.5 凝胶制备
用PowerPac Basic系列电泳仪进行SDS-PAGE分析,分离胶浓度12%,浓缩胶浓度5%,电极缓冲液为pH值8.8的Tris-甘氨酸缓冲液。将待测蛋白上样液与SDS-PAGE蛋白上样缓冲液(6×)混匀后,100℃加热5 min,以充分变性蛋白。每条泳道上样量均是20μL,先于90 V恒压电泳30min,再120 V恒压电泳约60 min,当溴酚蓝指示剂距胶板下缘约1 cm时结束电泳。凝胶板浸于0.1%考马斯亮蓝R250中染色约2 h,再换成脱色液,摇床上脱色至背景基本无色。
1.6 图像分析
胶板用Tanon-5200Multi多功能成像系统拍照,使用Quantity One软件进行图谱分析。
2 结果与分析
2.1 不同提取方法蛋白终产物的比较
对4种蛋白质提取方法得到的茅苍术叶片蛋白的呈现形式、颜色、提取时间、蛋白含量进行比较,从表1可以看出,直接提取法虽然耗时较短,但是所得终产物颜色是绿色,蛋白含量偏低,可能是由于茅苍术叶片含有较多色素未被完全分解;TCA-丙酮法、Tris-丙酮法蛋白含量较高,但提取时间过长,操作繁琐。同时,TCA-丙酮法提取的蛋白经多次漂洗后颜色仍呈淡黄色,这可能是由于茅苍术叶片中的某些成分和蛋白共沉淀,造成提取的蛋白不纯。Tris-饱和酚法加入裂解液后易溶解,提取的蛋白挥干后呈白色,对非蛋白物质去除有很好的效果,且提取时间相对较短。
2.2 不同提取方法所得蛋白含量的比较
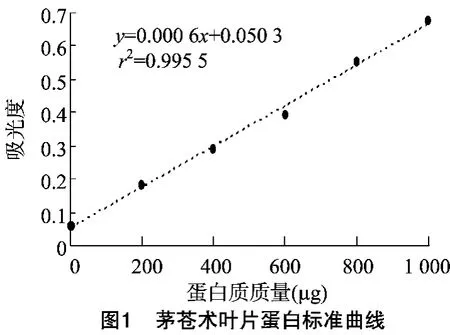
以牛血清蛋白作为标准蛋白,待测蛋白上样液浓度采用Bradford法作标准曲线测定蛋白含量,标准曲线见图1。测得TCA-丙酮法提取获得的蛋白干粉质量为(3.05±0.133)g、Tris-丙酮法提取获得的蛋白干粉质量为(4.23±0.098)g、Tris-饱和酚法提取所获得的蛋白干粉质量为(3.31±0923)g,表明3种提取方法在蛋白干粉质量上没有达到明显差异。

表1 不同提取方法对茅苍术叶片蛋白终产物的影响
2.3 不同提取方法SDS-PAGE电泳图谱分析
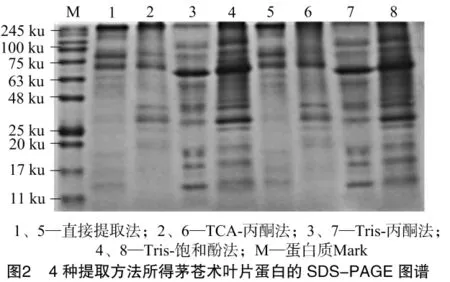
从图2可以看出,直接提取法、TCA-丙酮法有8、7条标准蛋白谱带,蛋白条带均着色较浅,且小分子蛋白条带缺失严重,均不适合茅苍术叶片的电泳分析。Tris-丙酮法获得的标准蛋白谱带为11条,背景颜色较为清晰,条带亦可清楚辨认,但在25~80 ku范围内缺失部分蛋白,测得蛋白种类不全。Tris-饱和酚法获得的标准蛋白谱带为14条,与Tris-丙酮法的蛋白谱带模式相似,在17~245 ku的范围内分布较为均匀,条带可清晰辨别。
3 讨论与结论
理想蛋白样品的制备在蛋白质组学的研究中具有重要作用,同时由于植物个体、器官、组织化学成分等差异造成其蛋白提取方法各不相同[12-13]。本研究从蛋白含量、纯度、提取时间方面,运用SDS-PAGE技术对茅苍术叶片蛋白提取方法进行比较。结果表明,不同提取方法得到的蛋白纯度和含量有明显不同,对蛋白条带的形成产生了直接影响。直接提取法虽然提取时间最短,但其蛋白含量和纯度较低,条带着色浅难以鉴别。TCA-丙酮法耗时最长,得到的蛋白沉淀为淡黄色,溶解性较差,可能是由于高含量的蛋白中掺入了较多杂质。Tris-丙酮法提取蛋白纯度较高,且谱带背景清晰,但在25~80 ku范围内缺失部分蛋白,可能是由于CHAPS与蛋白结合后未能去除完全的原因。Tris-饱和酚法提取的蛋白条带和Tris-丙酮法相比虽然背景色较深,但在17~245 ku范围内分布较为均匀,条带仍可清晰辨别。其次在提取时间和蛋白纯度上Tris-饱和酚法均有良好效果,这与饱和酚的性质有很大关系。饱和酚良好的溶解性,能使茅苍术叶片中可溶性杂质溶解在水中,而蛋白质和脂类溶解在饱和酚中,同时利用乙酸铵甲醇溶液对其沉淀纯化,亦避免新离子的加入[14],更适合茅苍术叶片蛋白质的提取。本研究结果可为逆境胁迫下茅苍术分子机制在蛋白质水平下的变化研究提供基础资料。
参考文献:
[1]国家药典委员会.中国药典(一部)[M].北京:中国医药科技出版社,2015:204.
[2]曾 燕,郭兰萍,陈保冬,等.不同温度对茅苍术生长发育及挥发油组分的影响[J].世界科学技术(中医药现代化),2010,12(5):773-778.
[3]顾永华,冯 煦,夏 冰.水分胁迫对茅苍术根茎生长及挥发油含量的影响[J].植物资源与环境学报,2008,17(3):23-27.
[4]陈 飞,周 彤,魏宇佳,等.茅苍术质膜蛋白的制备及其双向电泳蛋白质组学平台的构建[J].生物技术通报,2016,32(9):72-82.
[5]谷瑞升,刘群录,陈雪梅,等.木本植物蛋白提取和SDS-PAGE分析方法的比较和优化[J].植物学通报,1999,16(2):171-177.
[6]华贵煌,董 燕,易 浪,等.鱼腥草叶片总蛋白的提取及双向电泳体系的建立[J].广州中医药大学报,2013,30(3):375-378.
[7]Xiang F,Xu L,Wang Y,et al.Effective method of leaf protein extraction for proteomic analysis in radish[J].Molecular Plant Breeding,2012,10(6):756-760.
[8]陈富成,祁建民,徐建堂,等.圆果种黄麻功能叶总蛋白提取方法及双向电泳体系的优化[J].作物学报,2011,37(2):369-373.
[9]张 宁,孙晓丽,端木慧子,等.野生大豆叶片蛋白质组双向电泳技术体系的优化研究[J].大豆科学,2015,34(5):874-880.
[10]刘 楠,高 飞,周宜君,等.蒙古沙冬青根蛋白的提取及双向电泳体系的建立[J].北京师范大学学报(自然科学版),2013,49(4):365-368.
[11]丁金鹏,张 娜,李 群.独行菜属植物种子总蛋白4种提取方法的比较[J].新疆农业科学,2017,54(7):1305-1312.
[12]沈少炎,吴玉香,荣俊冬,等.两种花吊丝竹叶片蛋白提取方法的2-DE比较[J].福建农林大学学报(自然科学版),2017,46(1):50-57.
[13]Alam M,Ghosh W.Optimization of a phenol extraction-based protein preparation method amenable to downstream 2-DE and MALDI-MSbased analysis of bacterial proteomes[J].Proteomics,2014,14(2/3):216-221.
[14]高 芳.雪莲组织中蛋白质提取方法比较[J].中国实验方剂学杂志,2013,19(15):32-34.
