4种园林绿化植物根际对土壤养分的富集效应
2018-05-18蒋跃军方秉俊
史 伟,杨 群,蒋跃军,方秉俊
(成都农业科技职业学院,四川成都611130)
德国微生物学家Lorenz将根际(rhizosphere)定义为根际周围受根际生长影响并且能够从微环境中吸收大量养分的土体[1-2]。根际土是围绕根际进行生物地球化学循环最活跃的区域,是土壤-植物根际-微生物三者相互作用的场所和各种物质循环、能量流动的门户,对生态系统养分动态分布与循环、植物种间作用等发挥着重要作用,根际诱导产生根际土壤养分的变化已被证实[3-4]。良好的土壤养分环境是植物赖以生存的基础,能否吸取充足的养分更得益于优质的植物根际微环境[5-7]。由于根际是土壤-植物根际-微生物生态系统物质交换的活跃界面,植物根际直接不断地摄取养分,土壤养分通过质流和扩散的方式向根表皮迁移,加上根际分泌作用的影响,使根际微区的养分状况在浓度、形态与分布等方面的变化都较为复杂,根际过程对于认识植物对土壤中养分的利用及适应显得非常重要。
土壤是人类赖以生存的自然资源和基础,作为生态系统中的重要组成部分,在生态系统的物质循环和能量流动方面起着重要作用[8-9]。绿化植物是城市、自然和景观复合生态系统中具有重要自净功能的组成部分,在减少阳光辐射、净化空气、重金属修复、改善城市生态环境等方面有着重要的作用[10]。绿化植物“根际效应”及根际对养分的截留效应的影响较为明显,其根际土壤特征可能是有效吸收、利用土壤养分和适应环境的最直接表征之一,而绿化植物根际土壤特征及对环境的适应中所起的作用等科学问题尚未得到充分的认识[11-12]。国内对根际的研究开始于20世纪80年代初,大部分集中在农作物和森林等生态系统和对农作物和树木的根际养分、毒害离子、根际微生物、根际分泌物、簇根等方面,而对于绿化植物根际土壤养分富集效应的研究还少见报道。研究不同植物根际与非根际土壤养分分布特征与动态变化及其根际养分的富集作用,对于揭示绿化植物对土壤养分的保护、有效利用机制具有重要生态学意义。鉴于此,本试验研究了不同植物根际土壤养分等指标,旨在探究不同绿化植物根际养分的差异以及是否存在显著的根际效应,以期从根际微环境方面揭示不同绿化植物对土壤环境的适应及根际和非根际土壤养分的差异。
1 材料与方法
1.1 研究区概况
成都市绿化植物具有分布零散、结构形式多样等特点,目前国内外对植物绿量的研究虽取得了很大成就,但对绿化植物的研究总体较少。本试验以成都市4种常见绿化植物为主要对象进行了绿量相关研究。为了使研究结果更加具有科学性和说服性,通过对成都市主要街道的绿化现状详细调查,研究对象必须能够代表和反映成都市的自然生态环境,同时考虑到4种环境对植物生长的影响,在遵循树种选择的多样性以及各树种在4种样地内都有分布原则的基础上,尽可能减少选样误差。笔者通过对成都市绿地现状分布的全面调查,最后确定在成都市的主要街道选取主要的绿化植物大叶女贞、广玉兰、木芙蓉和夹竹桃。
1.2 样品采集
2016年9月中旬,对成都市主要的公园绿地、道路绿地以及各高校校园绿地等城市绿地进行实地调查,分别在不同街道采集上述4种绿化植物,按照其长势依次分为大、中、小各3株,3次重复,共27株,采集的绿化植物的形态特征和生长状况见表1。不同绿化植物根际土壤样品采集采用抖落法[1]。挖取具有完整根际的土体(根际主要分布的范围),先轻轻抖落大块不含根际的土壤,用小刀取下附在根际周围的土壤为非根际土(S),装入塑料袋内混匀,然后用刷子刷下黏附在根围的土壤(距离根围0~5 mm)作为根际土(R),取根际土尽量减少损害植物根际,对于混杂于根际土中的根系彻底去除。每种植物分别随机采集3株大、中、小植物根际、非根际土壤(排除植物个体大小对根际的影响),每种植物采集27株,总共采集到植物108株和216个土样(根际和非根际土,质量≥0.5 kg),刚采集的新鲜土样塑封袋盛装在保温箱内4℃保存,以测定土壤重金属含量,另一部分自然条件风干20 d后去除有机碎片,磨细,过2 mm筛,用以测定土壤养分。

表1 不同绿化植物生长特点
1.3 测定方法
1.3.1 土壤养分的测定[9]土壤 pH值:采用水浸提,pH计电位法测定;土壤有机碳:采用重铬酸钾容量法-外加热法测定;土壤全氮:采用半微量凯氏定氮法测定;土壤碱解氮:采用碱解扩散法测定;土壤全磷:采用HClO4-H2SO4法测定;土壤速效磷:采用 0.05 mol/L HCl和 0.025 mol/L(1/2 H2SO4)法测定;土壤全钾:采用原子吸收火焰光度法测定;土壤速效钾:采用乙酸铵浸提-火焰光度法测定。
1.3.2 土壤微生物数目的测定[13]采用稀释平板法对土样中的细菌、真菌和放线菌进行分离计数。细菌培养采用牛肉膏蛋白胨琼脂培养基,真菌培养采用马丁氏培养基,放线菌培养采用高氏1号培养基。培养细菌、放线菌的土壤悬液稀释104倍,培养真菌的土壤悬液稀释102倍,用表面涂抹法进行平板接种。
1.4 数据处理
试验所测数据用Microsoft Excel 2010和SPSS 18.0进行显著差异分析、方差及相关性分析(平均数间的多重比较采用 Duncans检验方法,P<0.05表示差异显著)。
根际富集率E(enrichment ratio)反映养分的富集程度,E值的大小反映土壤性状值在植物根际的富集程度,同时也反映了植物根际效应的强弱,计算公式如下:
E=[(根际含量-非根际含量)/非根际含量]×100%。
2 结果与分析
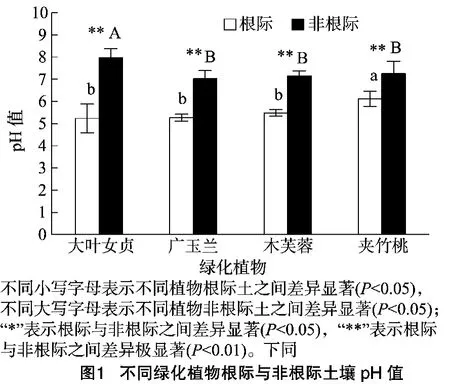
2.1 不同绿化植物根际与非根际土壤pH值
不同种植物表现出不同的根际效应,pH值作为根际微环境中最活跃因素之一,不仅受生物因素的影响,还受气温、降雨、母质因素等影响。从图1可以看出,不同绿化植物根际土壤pH值均极显著低于非根际的土壤(P<0.01)。不同树种根际pH值降低程度不同,其中,大叶女贞、广玉兰的根际与非根际土壤pH值的差异最大,其根际pH值比非根际分别低2.13和1.86。根际pH值,其大小依次表现为大叶女贞<广玉兰<木芙蓉<夹竹桃,大叶女贞、广玉兰、木芙蓉根际pH值差异不显著,显著低于夹竹桃;非根际pH值,其大小依次表现为广玉兰<木芙蓉<夹竹桃<大叶女贞,广玉兰、木芙蓉、夹竹桃非根际pH值差异不显著,显著低于大叶女贞。造成根际土壤pH值低于非根际可能是因为:(1)植物根际呼吸作用产生二氧化碳溶于水,对土壤酸度有很重要的作用;(2)植物吸收土壤中阳离子使土壤酸度降低;(3)植物根系分泌有机酸对土壤pH的影响。
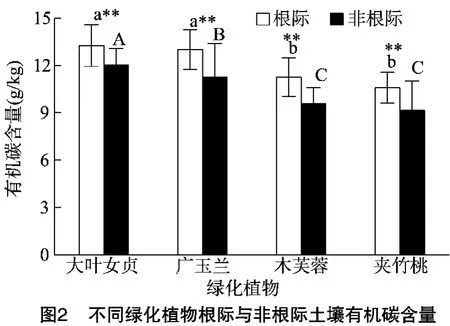
2.2 不同绿化植物根际与非根际土壤有机碳含量
土壤中有机碳含量及其动态平衡是反映土壤质量或土壤健康的一个重要指标,直接影响土壤肥力和作物产量的高低。从土壤有机碳含量分析结果来看(图2),绿化植物根际土壤有机碳含量均极显著高于非根际土壤,根际土壤有机碳含量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,其中大叶女贞和广玉兰根际土壤有机碳含量差异不显著,木芙蓉和夹竹桃根际土壤有机碳含量差异不显著;非根际土壤有机碳含量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,其中木芙蓉和夹竹桃非根际土壤有机碳含量差异不显著,显著低于大叶女贞和广玉兰。
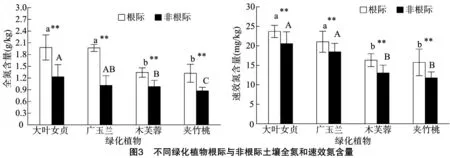
2.3 不同绿化植物根际与非根际土壤氮素含量
对根际和非根际土壤全氮素含量分析(图3)表明,绿化植物根际土壤全氮含量都高于非根际土壤全氮,差异极显著。不同绿化植物根际和非根际土壤全氮含量也都存在一定的差异。4种绿化植物根际土壤全氮比较,大叶女贞根际土壤全氮含量最高,为1.98 g/kg,夹竹桃根际土壤全氮含量最低,为1.32 g/kg;非根际土壤全氮比较,大叶女贞非根际土壤全氮含量最高,为1.23 g/kg,夹竹桃非根际土壤全氮含量最低,为0.87 g/kg。不同绿化植物根际和非根际土壤速效氮含量分析结果显示,不同绿化植物根际土壤速效氮含量和非根际速效氮含量差异极显著。4种不同绿化植物根际土壤速效氮含量分析显示,大叶女贞根际土壤速效氮含量最高,夹竹桃根际土壤速效氮含量最低,分别为 23.69 mg/kg和 15.74 mg/kg;植物非根际土壤速效氮含量比较,大叶女贞非根际土壤速效氮含量最高,夹竹桃非根际土壤速效氮含量最低,分别为20.56 mg/kg和 11.74 mg/kg。氮素是植物生长发育所必需的营养元素,每种植物对氮素的吸收也不尽相同。
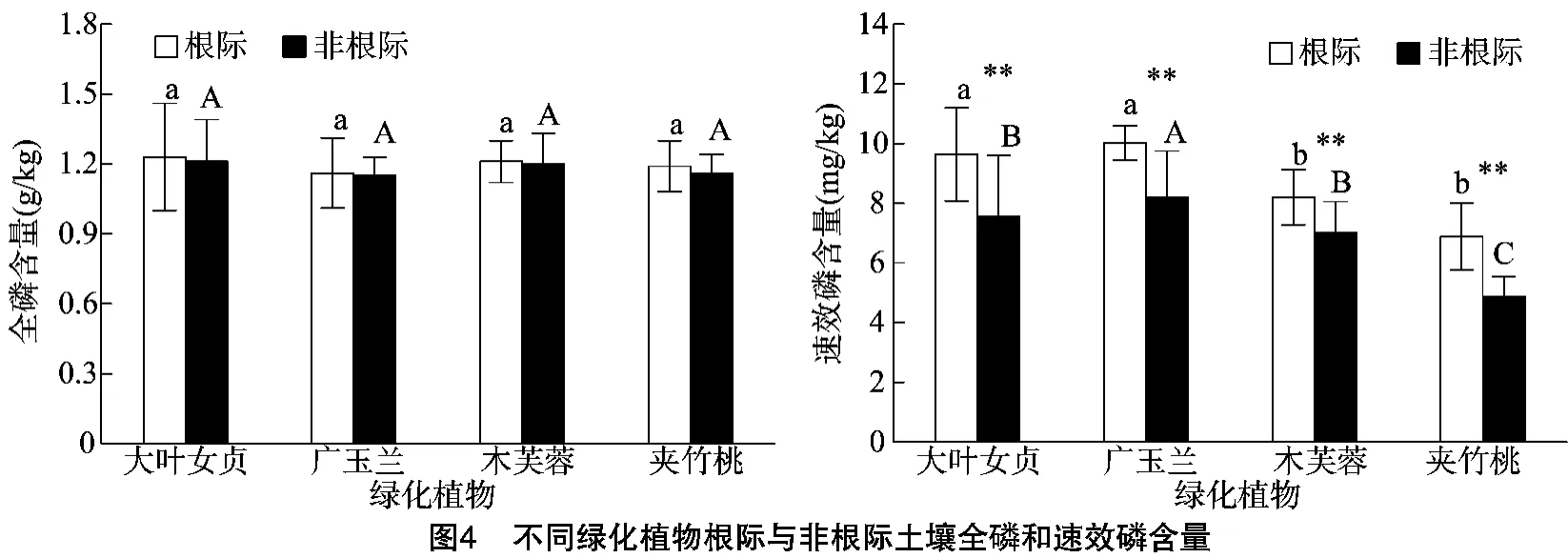
2.4 不同绿化植物根际与非根际土壤磷素含量
不同绿化植物根际和非根际土壤全磷含量比较分析结果(图4)显示,不同绿化植物根际土壤全磷含量均大于非根际土壤全磷含量,但差异不显著。不同绿化植物之间比较,根际和非根际土壤全磷含量都存在差异,依次表现为大叶女贞>木芙蓉>广玉兰>夹竹桃。植物根际土壤全磷含量比较分析显示,大叶女贞根际土壤全磷含量最高,为1.23 g/kg,广玉兰根际土壤全磷含量最低,为1.19 g/kg;非根际土壤全磷含量比较分析显示,大叶女贞非根际土壤全磷含量最高,为1.21 g/kg,广玉兰全磷含量最低,为 1.16 g/kg。不同绿化植物根际和非根际土壤速效磷含量分析表明,大叶女贞和广玉兰、木芙蓉和夹竹桃根际土壤速效磷含量差异不显著,依次表现为广玉兰>大叶女贞>木芙蓉>夹竹桃。植物根际土壤速效磷含量比较分析结果表明,广玉兰根际土壤速效磷含量最高,为 10.02 mg/kg,夹竹桃速效磷含量最低,为 6.89 mg/kg;同时比较分析非根际土壤速效磷含量,广玉兰非根际土壤速效磷含量最高,为8.21 mg/kg,夹竹桃速效磷含量最低,为487 mg/kg。
2.5 不同绿化植物根际与非根际土壤钾素含量
从图5可以看出,不同绿化植物根际和非根际土壤之间全钾含量差异极显著,依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,其中木芙蓉和夹竹桃根际全钾含量差异不显著,显著低于大叶女贞和广玉兰;非根际土壤全钾含量依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,其中木芙蓉和夹竹桃非根际全钾含量差异不显著,显著低于大叶女贞和广玉兰。不同绿化植物根际和非根际土壤速效钾含量比较分析显示,4种绿化植物根际土壤速效钾含量比较,大叶女贞最高,为236.6 mg/kg,夹竹桃最低,为 198.3 mg/kg;非根际土壤速效钾分析,大叶女贞最高,为 213.5 mg/kg,夹竹桃最低,为169.3 mg/kg。


2.6 不同绿化植物根际与非根际土壤微生物数量
土壤是微生物生长和繁殖的天然培养基,微生物也是土壤养分循环和转化的动力,通常会通过微生物的数量来表征根际活动的强弱。土壤中微生物的分布一方面可以反映土壤物质能量的转化循环程度,另一方面也可以反映出土壤肥力状况。从图6可以看出,绿化植物根际土壤微生物总数、细菌、真菌和放线菌数量均显著或极显著高于非根际土壤。根际和非根际土壤微生物总数,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,其中大叶女贞和广玉兰根际土壤微生物总数差异不显著,广玉兰、木芙蓉和夹竹桃根际土壤微生物总数差异不显著。根际土壤细菌数量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,不同绿化植物根际土壤细菌数量差异均显著;非根际土壤细菌数量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,夹竹桃显著低于其他3种绿化植物。根际土壤真菌数量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,广玉兰和木芙蓉根际土壤真菌数量差异不显著;非根际土壤真菌数量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,不同绿化植物根际土壤真菌数量差异均显著。根际土壤放线菌数量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,大叶女贞和广玉兰差异不显著,木芙蓉和夹竹桃差异不显著;非根际土壤放线菌数量,其大小依次表现为大叶女贞>广玉兰>木芙蓉>夹竹桃,不同绿化植物根际土壤放线菌数量差异均显著。

表2 不同绿化植物土壤养分平均值和富集率
2.7 不同绿化植物土壤养分平均值和富集率
植物根系在从外界环境吸收养分的过程中,主要是受根际吸收的影响,不同的根际吸收速率导致根际养分亏缺或者富集。从表2可以看出,不同植物根际与非根际土壤养分含量差异均显著(全磷除外),不同植物根际土壤养分含量均高于非根际土壤,根际土壤pH值显著低于非根际土壤。由于根系呼吸分泌有机酸,同时也释放CO2,进而导致微生物活动加强,大量分泌和产生有机酸致使根际土壤酸化,而根际土壤pH值的降低能够提高多种矿质养分的有效性和促进养分有效性的转化和活化,本研究中土壤pH值平均低1.03个单位,从而保证了绿化植物对营养元素的吸收。综合来看,不同绿化植物根际对土壤养分表现出明显的富集和截存效应,其中放线菌数量对根际的富集和截存效应表现得最敏感。
2.8 不同绿化植物土壤养分相关性分析
土壤是对微生物产生显著影响的生态微环境,如土壤养分、水分、物理性状等因子直接或间接影响着微生物结构与活性,而微生物从另一方面又对土壤肥力改善与稳定性产生作用。土壤微生物与土壤养分之间关系密切,土壤微生物可以促进土壤有机碳的积累,土壤养分的积累又可增强微生物活性,为微生物提供碳源。从表3可以看出,土壤有机碳、全氮、速效氮、全磷和速效磷与土壤微生物数量均有不同程度的相关性,微生物数量的变化可能是导致根际和非根际土壤养分发生变化的原因之一,其中细菌和真菌的数量变化与土壤养分的相关关系更为密切。有机碳和速效钾含量是影响微生物数量与生物量碳、氮含量的主要因素,与微生物各指标呈显著正相关。全氮与微生物总数、细菌、放线菌、生物量碳呈显著正相关,pH值和速效磷含量与微生物总数、细菌、放线菌、生物量碳呈显著负相关,速效氮含量与细菌数量呈显著正相关;全磷与微生物各指标相关性程度均不显著。
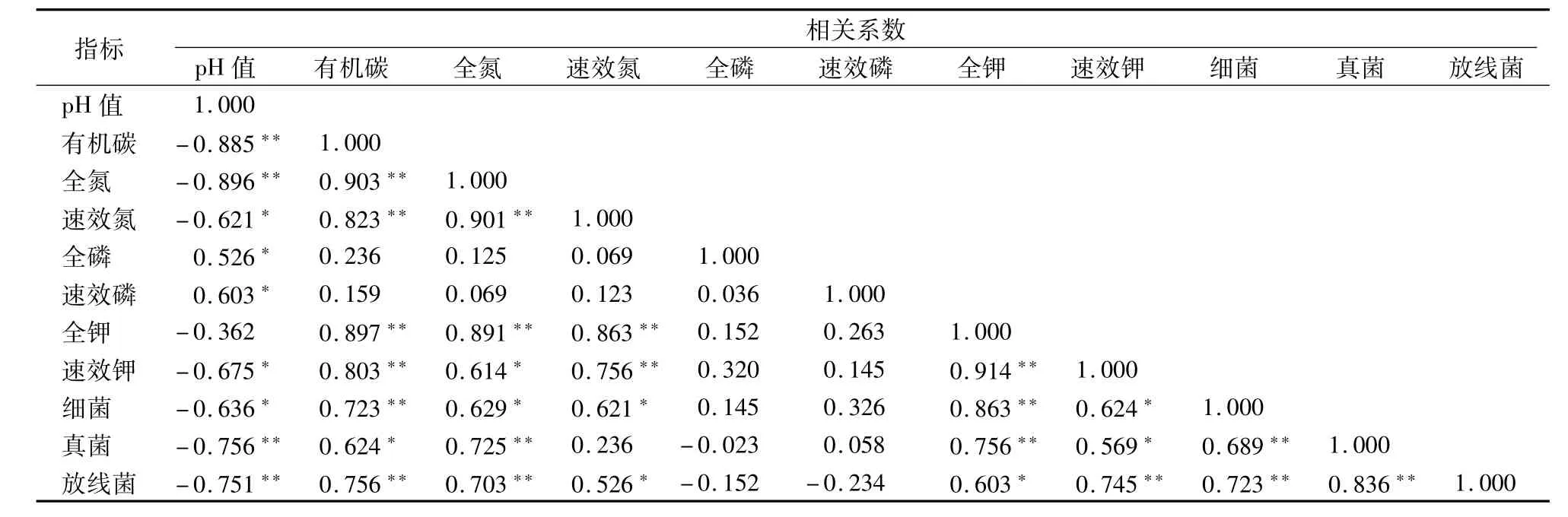
表3 绿化植物与根际土壤养分相关性分析
3 讨论与结论
目前根际土壤pH值的研究是根际特征研究重要部分之一,大多数学者都认为,根际土壤pH值的变化是由根系呼吸作用释放CO2,在离子的主动吸收、根尖细胞伸长过程中分泌质子和有机酸以及外界生态系统环境所致[14-15]。Chen等对根际微生态系统和微生物及其与植物营养的关系研究也表明,根系通过呼吸释放CO2、根系分泌有机酸、根际微生物活动所产生有机酸和CO2等作用来降低根际土壤pH值[16]。本研究中,不同绿化植物根际和非根际土壤pH值差异显著,根际土壤pH值显著小于非根际土壤pH值,这是通过根际效应、根系系统调节作用来降低根际pH值。另一方面,相关性分析结果表明,土壤pH值与土壤中氮素和钾素含量呈负显著相关,pH值越小越有利于促进矿质养分有效性的转化和活化,改善根际周围土壤的碱性环境,也利于绿化植物根系对土壤中养分的吸收。
根系周围有机物质的变化绝大部分是来源于植物在生长期间的活跃代谢作用,有时也认为是根系释放到根际的光合产物以及死亡根系的分解[17]。本试验数据显示不同绿化植物根际土壤有机碳含量显著高于非根际土壤有机碳含量,植物根系土壤有机碳含量也具有一定的差异,这说明不同植物根系分泌的有机和无机物质是不同的,这种不同必然会引起其根际有机碳数量上的差异。另外,大叶女贞根系统发达,繁密程度远大于其他植物,这为根系周围有机碳的产生提供有利条件,表现出较高的养分含量和明显的根际养分富集效应。一般认为,根系分泌物及根产物等引起根际土壤养分富集效应。值得注意的是,在本研究中,不同绿化植物根际全磷出现很小程度的亏缺现象。秦嗣军等研究发现,由于植物根系和微生物对磷元素的吸收利用强烈,而当土壤磷缓冲能力较强的时候,非根际土壤中的磷无法迅速运输至根际,土壤固定磷解吸附作用较弱,造成植物根际磷元素出现了不同程度的亏缺[18]。因此,认识和调控根际沉积及养分的流量和方向对于建立根际环境中养分的合理分配模式具有重要作用。
本研究中绝大部分绿化植物根际土壤中氮素都显著高于非根际土壤,这可能是由于植物在生长发育过程中,根系代谢活跃,产生的光合产物(主要是氮碳类化合物)多分泌到土壤中,使得根际土壤中氮素含量增加[19]。根系要汲取周围土壤中营养元素来维持绿化植物的正常生理生长,这离不开土壤中磷等养分的支持,因此根系周围磷含量要低于非根际土壤[20]。土壤肥力指标也显示,不同绿化植物根际和非根际土壤中有机碳、氮磷含量表现为亏缺,而土壤中钾素表现为富裕,土壤中钾素的供应状况与土壤pH值、含水量、根系分泌物的多少以及植物生长发育时期相关。此外,可通过一系列措施来减少根际养分损失、缓解环境的胁迫,也能通过地下根际的可塑性分配适应土壤养分有效性的改变。
总之,根际土壤中的养分的富集与亏缺是植物、土壤和土壤生物之间复杂的相互作用的结果,不同的绿化植物表现出不同程度的根际效应,也与植物体自身的生理特征、生活型、根系特征及环境对植物的反馈作用相关。为了有助于绿化植物的生理生长,要制定适宜的施肥机制,主要是施用氮磷肥,合理利用周围的生态环境,才能持续发展。综上所述,本研究初步表明绿化植物土壤养分在根际存在一定的富集,它们通过降低根际pH值可以提高根际养分含量,有利于土壤养分的有效利用。
参考文献:
[1]Mohamed M A N,Elsebai T N M,Hartmann A. Effect of co-enrichment,soybean rhizosphere and p-hydroxybenzoic acid,on microbialmetabolic diversity and p-HBA degradation[J].Research Journal of Agriculture&Biological Sciences,2009,5(4):301-309.
[2]李廷轩,张锡洲,王昌全,等.根系CEC、ATP酶活性和根际微生物对籽粒苋富钾能力的影响[J].四川农业大学学报,2002,20(4):354-356.
[3]郁珊珊,王 浩,王亚军,等.南京市不同园林植物根际土壤养分和重金属富集特征[J].水土保持学报,2016,30(3):120-127.
[4]Calvaruso C,Collignon C,Kies A,et al.Seasonal evolution of the rhizosphere effect on major and trace elements in soil solutions of Norway spruce(Piceaabies Karst)and beech(Fagus sylvatica)in an acidic forest soil[J].Open Journal of Soil Science,2014,4(9):323-336.
[5]倪方方,彭三妹,徐建中,等.通过改变土壤pH及菌群结构缓解杭白菊连作障碍[J].中药材,2017,40(4):762-768.
[6]Maltais-Landry G,Scow K,Brennan E.Soil phosphorusmobilization in the rhizosphereof cover cropshas little effecton phosphorus cycling in California agricultural soils[J].Soil Biology& Biochemistry,2014,78:255-262.
[7]Singh S K,Reddy V R,Sharma M P,et al.Dynamics of plant nutrients,utilization and uptake,and soil microbial community in crops under ambient and elevated carbon dioxide[M].Springer India,2015:381-399.
[8]Huston M.Soil nutrients and tree species richness in costa rican forests[J].Journal of Biogeography,1980,7(2):147-157.
[9]Schlesinger W H,Raikes J A,Hartley A E,et al.On the spatial pattern of soil nutrients in desert ecosystems[J].Ecology,1996,77(2):364-374.
[10]Mercado-Díaz J A,Gould W A,González G.Soil nutrients,landscape age,and Sphagno - Erioporetum vaginati plant communities in arctic moist-acidic tundra landscapes[J].Open Journal of Soil Science,2014,4(4):375-387.
[11]Gilliland K,Huntly N,Knudsen J.The relationships between human settlement,soil nutrients,plant diversity and productivity,and grazing in a tundra landscape[C]//Ecological Society of America Annual Meeting.2005.
[12]阚丽艳,奚霄松,何晓颖,等.有机覆盖物对城市园林植物土壤养分状况的影响[J].上海交通大学学报(农业科学版),2014,32(1):79-88.
[13]Gyaneshwar P,Kumar G N,Parekh L J,et al.Role of soil microorganisms in improving P nutrition of plants[J].Plant and Soil,2002,245(1):83-93.
[14]Tiquia S M,Lloyd J,Herms D A,et al.Effects of mulching and fertilization on soil nutrients,microbial activity and rhizosphere bacterial community structure determined by analysis of TRFLPs of PCR-amplified 16S rRNA genes[J].Applied Soil Ecology,2002,21(1):31-48.
[15]Moritsuka N,Yanai J,Kosaki T.Effect of plant growth on the distribution and forms of soil nutrients in the rhizosphere[J].Soil Science and Plant Nutrition,2000,46(2):439-447.
[16]Chen Y L,Guo Y Q,Han S J,et al.Effect of root derived organic acids on the activation of nutrients in the rhizosphere soil[J].Journal of Forestry Research,2002,13(2):115-118.
[17]Das A C,Mukherjee D.Effect of insecticides on the availability of nutrients,nitrogen fixation,and phosphate solubility in the rhizosphere soil of rice[J].Biology and Fertility of Soils,1994,18(1):37-41.
[18]秦嗣军,吕德国,李作轩,等.樱桃根际土壤酶活性与土壤养分动态变化及其关系研究[J].土壤通报,2006,37(6):1175-1178.
[19]Mueller K E,Shann JR.Effectsof tree root-derived substrates and inorganic nutrients on pyrenemineralization in rhizosphere and bulk soil[J].Journal of Environmental Quality,2007,36(1):120-127.
[20]Wang ZY,Kelly JM,Kovar JL.Depletion ofmacro-nutrients from rhizosphere soil solution by juvenile corn,cottonwood,and switchgrass plants[J].Plant&Soil,2007,270(1/2):213-221.
