仙女湖及入湖河流浮游植物功能类群与环境因子的相互关系
2018-05-16陈宏文
于 晨 张 萌 陈宏文 周 慜 王 韬 李 超 张 敏
(1. 华中农业大学水产学院, 淡水水产健康养殖湖北省协同创新中心, 池塘健康养殖湖北省工程实验室, 武汉 430070;2. 江西省环境保护科学研究院, 南昌 330039; 3. 江西省环境保护工程技术研究中心, 南昌 330039)
浮游植物对人类和生态系统的健康有着潜在的重大影响。浮游植物还是食物链的重要组成部分, 是湖泊生态系统的重要指标生物及生产者[1]。浮游植物对周围环境变化十分敏感, 环境条件的改变将直接或间接地影响到浮游植物的群落结构, 因此, 其种类的组成和分布变化对水生态系统环境监测具有良好的指示作用[2]。叶绿素a作为浮游植物光合作用的主要色素及生态学的基本参数, 是估算浮游植物现存量的良好指标, 可以较直观的反映出浮游植物群落大小的增减[3]。浮游植物的种类和生物量还是水环境监测的重要监测指标。一些浮游植物物种是造成水体毒性问题、皮肤过敏问题、水气味和表面浮渣问题等的重要原因。浮游植物生物量的增长是由于化学、生物和物理因素和气象条件综合影响的结果[4]。影响浮游植物群落结构及分布特征的因素一般为上行效应和下行效应, 上行效应主要影响温度、光照、营养盐、水动力等因素, 下行效应则通过影响浮游动物和滤食性鱼类的摄食等方面影响浮游植物群落分布[5]。浮游植物对整个水生态系统的物质循环和能量流动具有重要意义, 但其过度增殖易形成水华, 并威胁湖泊生态系统的健康、稳定[6]。而在湖泊中控制浮游植物的主要生物和非生物因素, 对调控及管理淡水生态系统必不可少。
浮游植物种群的功能特征有许多不同, 如浮游植物对环境变化的应答反应主要包括它们对资源获取方式(光和营养元素)的改变, 以及避免死亡的能力。正是浮游植物的功能特征反映了种群生态位的不同, 最终, 这些功能结合起来可以达到描述浮游植物物种栖息地环境特征的效果。浮游植物功能分组在生态学的解释与预测的研究中始终占据着优势地位, 然而能直观反应浮游植物功能性质对环境应答的方法仍相对缺乏。因此, 通过简单的形态标准作为功能特征的指示剂以研究浮游植物对环境的应答反应, 是描述浮游植物生态学中的一条捷径。目前研究浮游植物功能群划分的主要方法为Reynolds的FG (Morpho-Functional Groups)[10],Kruk的MBFG (Morphology-Based Functional Groups)和Weithoff的PFT (Plant Functional Types)[11]等研究方法。与其他功能分类法需要大量不易获得物种信息和生理特征相比, Kruk等[7]2010年提出的浮游植物群落的功能组分析方法是定义在七组浮游植物物种组形态、生理和生态基础上的一种新颖的研究方法; 其优点为客观性、分类关系的独立性和形态特征易测量性, 并与浮游植物的功能特性有明显的关系[8]。因此, Kruk的浮游植物功能分组方法对于水质监控、理解和预测浮游植物群落组成显然具重要参考价值。
综上, 对不同环境条件下浮游植物群落的分布规律及功能特征进行调查研究, 一方面有助于认识不同环境条件下浮游植物群体的响应机制, 另一方面对调控及管理淡水生态系统提供科学指导。本文通过仙女湖及入湖河流浮游植物的时空变化规律与功能分组特征, 旨在揭示影响仙女湖及入湖河流浮游植物时空分布规律以及功能分组特征的关键环境因子, 对掌握仙女湖流域的水质现状以及富营养化趋势提供更为广泛和精确的科学依据均有重要意义。
1 材料与方法
1.1 研究地点概况
仙女湖 (江口水库) 是江西省四大水库之一, 地处新余城区西南16 km, 北纬27°33′—28°05′, 东经114°29′—115°24′, 水面面积50 km2, 控制流域面积达3900 km2, 约占袁河流域总面积的60.13 %, 平均水深12 m, 年平均蓄水量达3.2×108m3, 属不完全年调节型湖泊水库, 是我国南方一座亚热带大型山地丘陵型湖泊[12]。仙女湖湖体共分两个子湖和一条峡谷, 上游为钤阳湖, 下游为舞龙湖, 中间连接峡谷为钟山峡, 约长10 km。已有研究表明, 仙女湖大部分湖区处于轻度富营养状态[13]。
根据仙女湖核心流域生态环境及水文特点, 共设置27个采样点。为了深入了解仙女湖核心流域入水、出水及中心区等不同生境特征, 根据前人研究结果[9], 采用UPGMA聚类分析并结合湖区具体情况对仙女湖流域不同湖区生境进行分类, 共将仙女湖入湖河流及湖体划分为11个生境(图 1、表 1):钤阳湖进水区(L1), 钤阳湖湖心区(L2), 钟山峡入口区(L3), 舞龙湖进水区(L4), 舞龙湖湖湾区(L5), 舞龙湖出水口(L6), 入库支流: 杨桥河(R1)、袁河上游(R2)、松山河(R3)、苑坑河(R4)、九龙山河(R5)11个生境[14]。
1.2 样品采集
2014—2015年于不同季节(2014年7月、2014年10月、2015年1月和2015年5月)分别在仙女湖入湖河流与湖体的11个生境区域的27个采样点采集浮游植物样品。浮游植物样品用2.5 L有机玻璃采水器分别于水面以下0.5 m处采集水样2.5 L,将水层的水样充分混匀后, 取水样100 mL于棕色玻璃瓶中, 现场用鲁哥试剂固定, 并带回实验室进行分析鉴定。
1.3 分析方法
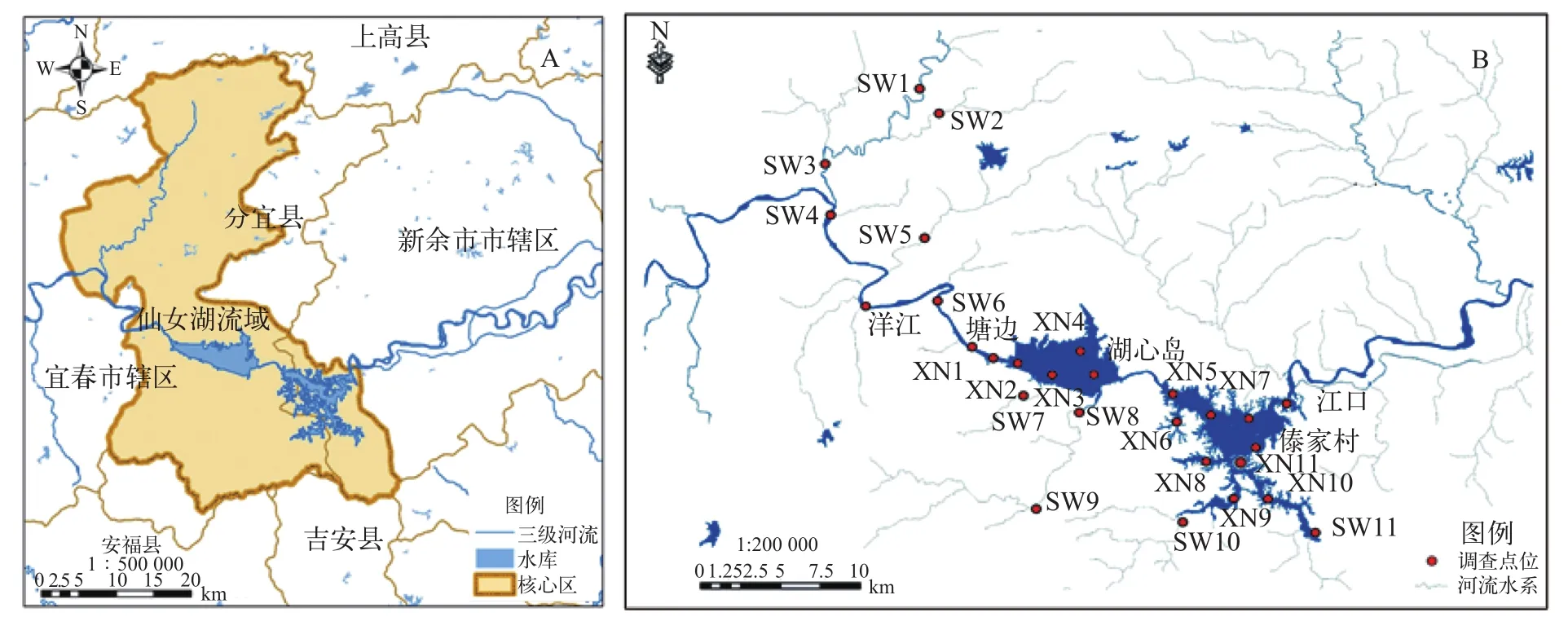
图 1 仙女湖的区域位置(A)以及湖体与入湖河流采样点分布图(B)Fig. 1 The location of Lake Xiannü (A) and sampling sites in lake and inflow rivers (B)
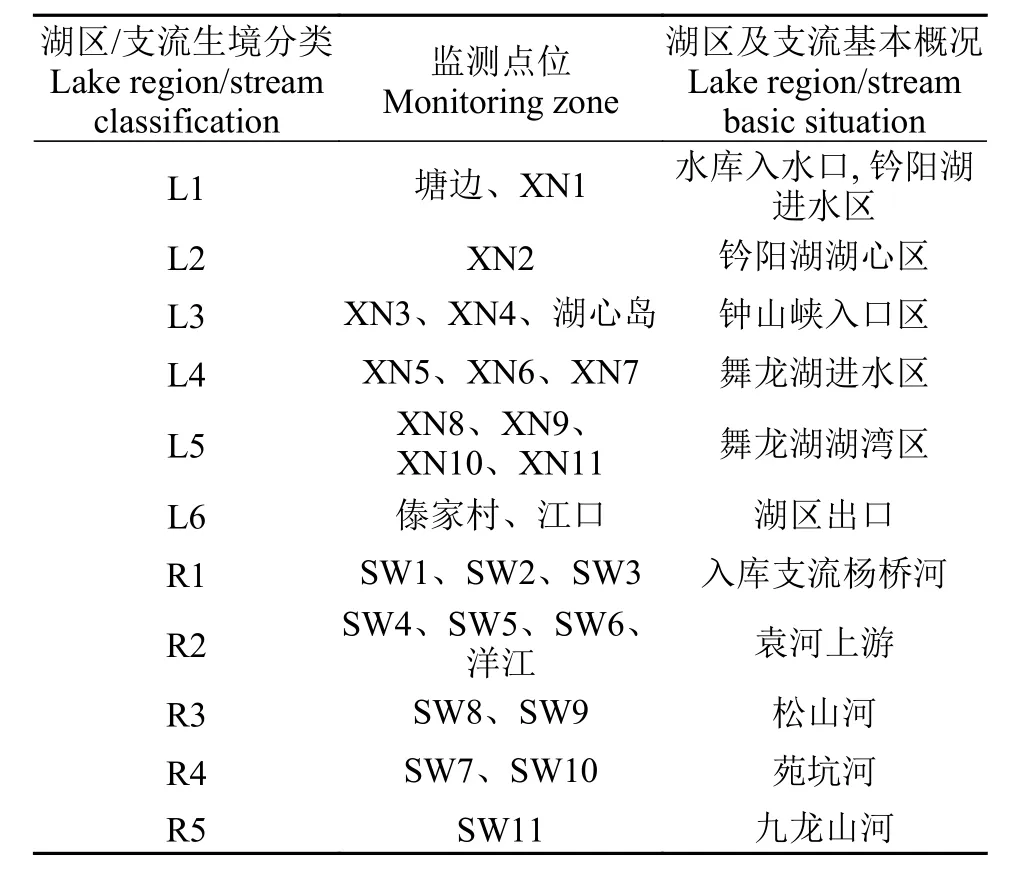
表 1 仙女湖及入湖河流采样点分区[14]Tab. 1 Distribution of sampling sites in Lake Xiannü and inflow rivers
用哈希(pHC10103/LDO10103/HQ40d)水质分析仪现场测定水体溶解氧、电导率和pH; 用浊度仪(WGZ-2B)各采样点水体的浊度; 水体中总磷(Total phosphorus, TP)采用过硫酸钾消解-钼锑抗分光光度法测定; 用碱性过硫酸钾消解-紫外分光光度法测定水体中总氮(Total nitrogen, TN)的含量; 正磷酸盐(-P)采用钼锑抗分光光度法测定; 硝态氮(-N)采用紫外分光光度法测定; 氨态氮(-N)采用纳氏比色法测定[15]。其中, 湖区生境分区各理化指标为该指标在该区域内各采样点的均值。
水体中叶绿素a含量用Whatman GF/C滤膜抽滤1 L水样, 滤膜剪碎后用90%丙酮于4℃冰箱中, 提取叶绿素a约24h, 萃取后于低速离心机下4000 r/min离心8min, 分光光度法测定叶绿素a的含量[16]。
浮游植物样品带回实验室后在倒置显微镜(Olympus SZ-40)下进行种类鉴定和计数。浮游植物计数时, 样品要充分摇匀, 然后用移液枪定量吸5 mL充分摇匀样品注入5 mL沉降杯计数框中, 盖好盖玻片, 静置4h后根据目镜视野法计数。优势种由Mcnaughton优势度指数(Y)[12]确定,Y>0.02则为优势种。公式如下:
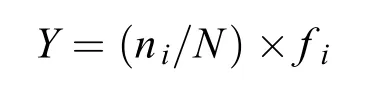
式中,ni为第i种在某次采样中各个采样点的总个体数,N为该次采样中各个采样点所有浮游植物的总个体数,fi为第i种在各个采样点的出现的频率。
通过皮尔逊相关系数(Pearson Correlation Coefficient)判断环境因子与浮游植物功能分组的相互关系。
2 结果
2.1 仙女湖及入湖河流水体理化特征
仙女湖及入湖河流的水温变化范围为10—25℃, 平均值为17.75℃, 夏季达到最大值, 冬季最低;pH区域变化范围在7.17—7.88波动, 平均值为7.66,整个仙女湖及入湖河流中以河流生境中R4区域pH最低, 其值为6.99, 湖泊生境中以L3区域的pH最高(7.88); 仙女湖及入湖河流浊度在6.859—73.967 NTU之间变动, 平均浊度为19.34NTU, 整个区域中浊度的最大(L2)与最小值(L5)均出现在湖泊生境中; 仙女湖及入湖河流水体中DO含量在6.12—6.40 mg/L之间变化, 平均值为6.19 mg/L, 河流生境中以R4区域水体中DO含量值最低, 湖泊生境中以L6区域水体中DO含量最高; 叶绿素a的浓度为5.499—34. 646 mg/m3, 叶绿素a浓度的季节平均值为20.82 mg/m3, 仙女湖及入湖河流以河流生境中R2区域水体叶绿素a浓度最高, 湖泊生境中L1区域含量最低; TP浓度为0.028—0.303 mg/L, 平均值为0.068 mg/L, 河流生境中水体TP平均含量(0.116 mg/L)较湖泊生境中水体TP平均含量高(0.035 mg/L);TN浓度为0.97—1.446 mg/L, 季节平均值为1.22 mg/L;氨氮浓度为0.238—0.816 mg/L, 季节平均值为 0.42 mg/L。河流生境中TN与氨氮的含量在各区域中最高。此外, pH、DO、TP、TN、氨氮浓度的最高点均出现在夏季。而叶绿素a浓度及浊度的最高峰则出现在春季(表 2)。
2.2 仙女湖及入湖河流浮游植物种类组成
2014—2015年按春夏秋冬四季对仙女湖(水库)及入湖河流浮游植物的调查中, 共发现水体中浮游植物82种(属), 包括蓝藻15种(属), 绿藻32种(属), 硅藻24种(属), 甲藻3种(属), 裸藻5种(属), 隐藻2种(属), 金藻1种(属) (附表 1)。
其中河流型生境R1区域记录到47种, 河流型生境R2区域记录到50种(最高), 河流型生境R3区域记录到43种, 河流型生境R4区域记录到40种, 河流型生境R5区域记录到35种(最低); 湖泊型生境L1区域记录到41种, 湖泊型生境L2区域调查中共出现40种, 湖泊型生境L3区域调查中共出现47种, 湖泊型生境L4区域调查中共出现48种(最高), 湖泊型生境L5区域调查中共出现46种, 湖泊型生境L6区域调查中共出现43种(附表 1)。根据Mcnaughton优势度指数计算, 表明仙女湖及入湖河流浮游植物优势种为: 鱼腥藻(Y=0.725)、平裂藻(Y=0.075)和隐藻(Y=0.056)。
2.3 仙女湖及入湖河流浮游植物密度与生物量的时空分布
在仙女湖及入湖河流的11个生境中, 浮游植物平均密度对数值变动范围为6.45—9.81(平均密度:7.95×106—2.19×109ind./L), 而采样点全年的11个分区中的浮游植物平均生物量的对数值在0.31—2.33(平均生物量: 10.52—792.91 mg/L)波动。调查期间, 各采样点浮游植物平均生物量以夏季R4区域最高, 春季R2区域最低; 而采样点浮游植物季节平均密度以夏季R5区域最高, 春季R2区域最低(图 2)。
2.4 仙女湖及入湖河流浮游植物不同季节各门类密度及生物量百分比特征
仙女湖及入湖河流夏季及秋季L2-L6湖区生境以及夏季R4和R5的河流生境中浮游植物的密度以蓝藻门占绝对优势(超过浮游植物总密度的50%);而湖泊生境中L1区域以及河流生境中R1-R3区域以硅藻、甲藻以及隐藻为主。仙女湖及入湖河流春季及冬季在河流生境中表层浮游植物以硅藻门的密度相对较高; 而在湖泊生境中, 除硅藻门外, 则出现了一定数量的隐藻; 而在冬季, 甲藻门的密度百分比在L3和L4等湖泊生境中的数量显著增加, 有些甚至达到总密度的80%(L4湖区生境), 蓝藻门的数量则相对减少。春季, 藻类复苏, 浮游植物优势门多呈现蓝藻门、绿藻门、硅藻门、隐藻门共存的群落结构特征(图 3)。
仙女湖及入湖河流河流生境R1-R5区域以及湖泊生境中L1区域春季及冬季浮游植物生物量以硅藻门占绝对优势; 春季L2-L6湖区生境中多以隐藻门占优势, 而冬季L3-L6湖区生境多以甲藻门占统治地位。夏季及秋季生物量门类百分比特征则较为复杂, 不同湖区生境具不同优势门类及复杂群落结构特征(图 4)。
2.5 仙女湖及入湖河流浮游植物功能类群分析
将仙女湖及入湖河流水体中82种浮游植物依据形态特征分为七个功能组, 分别为: Ⅰ组具有较大表面积/体积比的小型个体、Ⅱ组具鞭毛与硅质结构的小型个体、Ⅲ组具伪空胞的、较大表面积/体积比的丝状个体、Ⅳ组中等大小、无特殊结构特征的个体、Ⅴ组具鞭毛、中等到大型的单细胞或群体、Ⅵ组具硅质结构的无鞭毛个体、Ⅶ组具胶质鞘、小的表面积/体积比的群体(表 3)。在4个季节中, 对27个采样点按功能分组重新计算生物量,并做成百分比堆积图分析, 发现在春季及冬季R1-R5河流生境中Ⅵ组浮游植物占据主导地位, 而L2-L6湖区生境以V组浮游植物具有明显优势; 同时各不同季节不同生境内Ⅰ组浮游植物相对百分比含量极低; 夏季及秋季不同生境中虽然Ⅴ组浮游植物数量仍然相对较高, 但是Ⅲ组和Ⅶ组浮游植物在某些河流和湖泊生境(如R2-R6以及L4)中的密度百分比含量有所增长(图 5)。
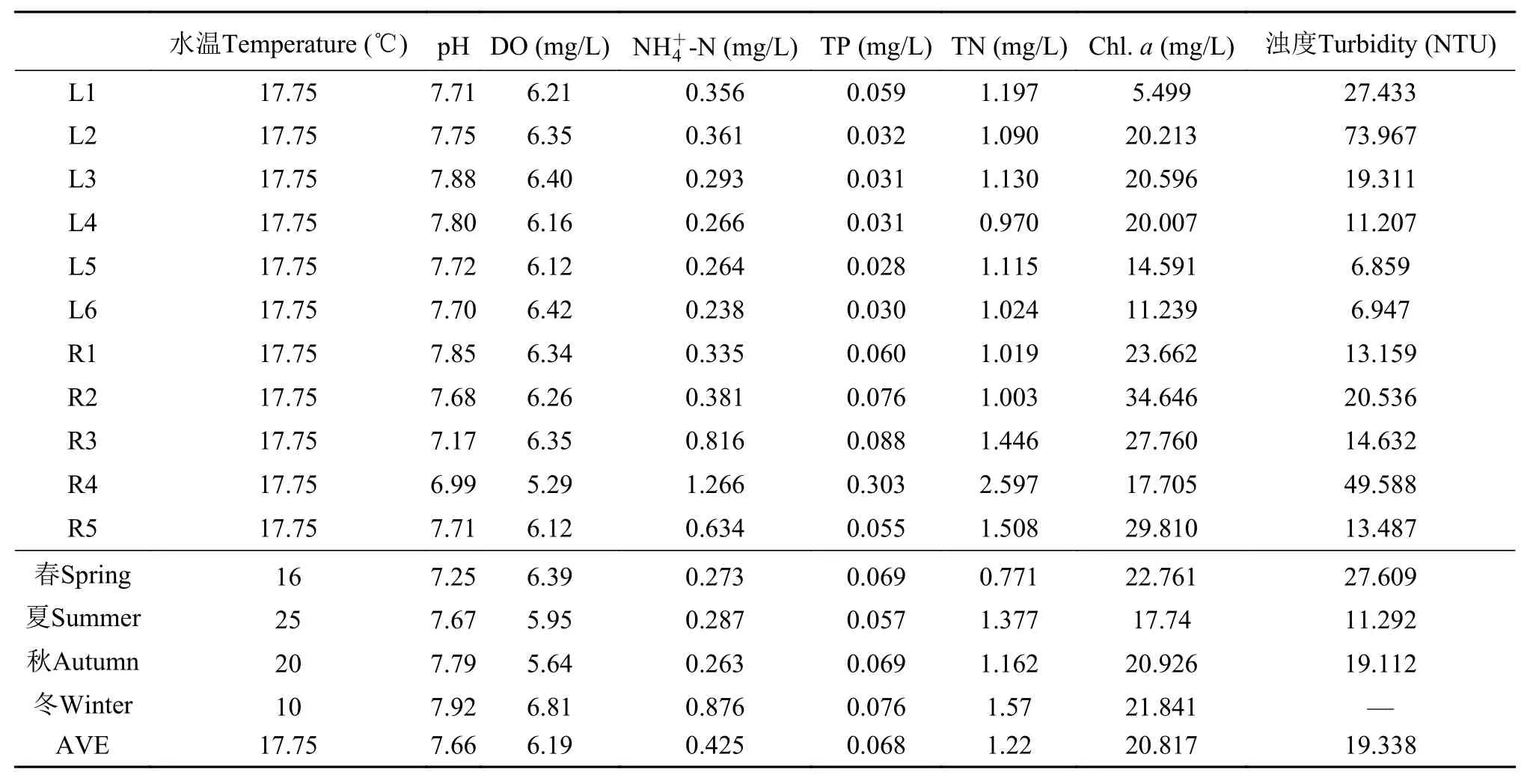
表 2 仙女湖及入湖河流采样点理化指标的季节与空间变化特征Tab. 2 Temporal and spatial variation of environmental factors in Lake Xiannü and inflow rivers
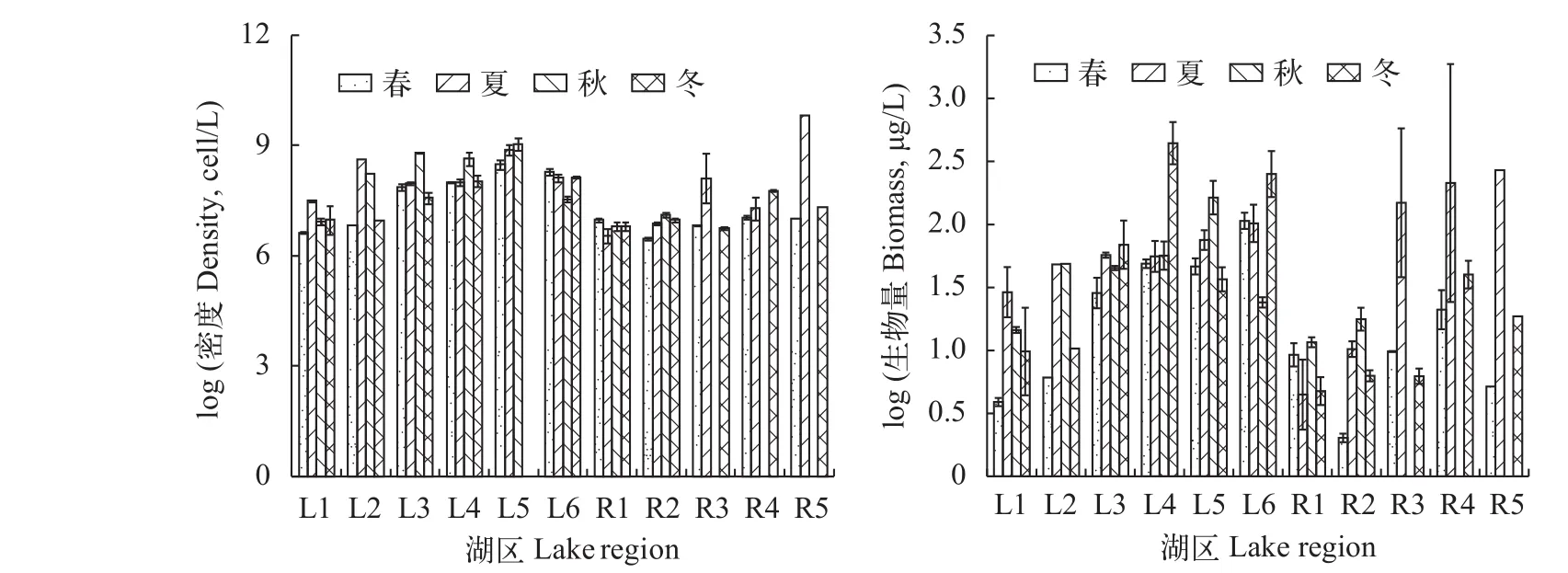
图 2 仙女湖及入湖河流浮游植物总密度和总生物量的时空变化特征Fig. 2 Temporal and spatial dynamics of total phytoplankton density and biomass in Lake Xiannü and inflow rivers
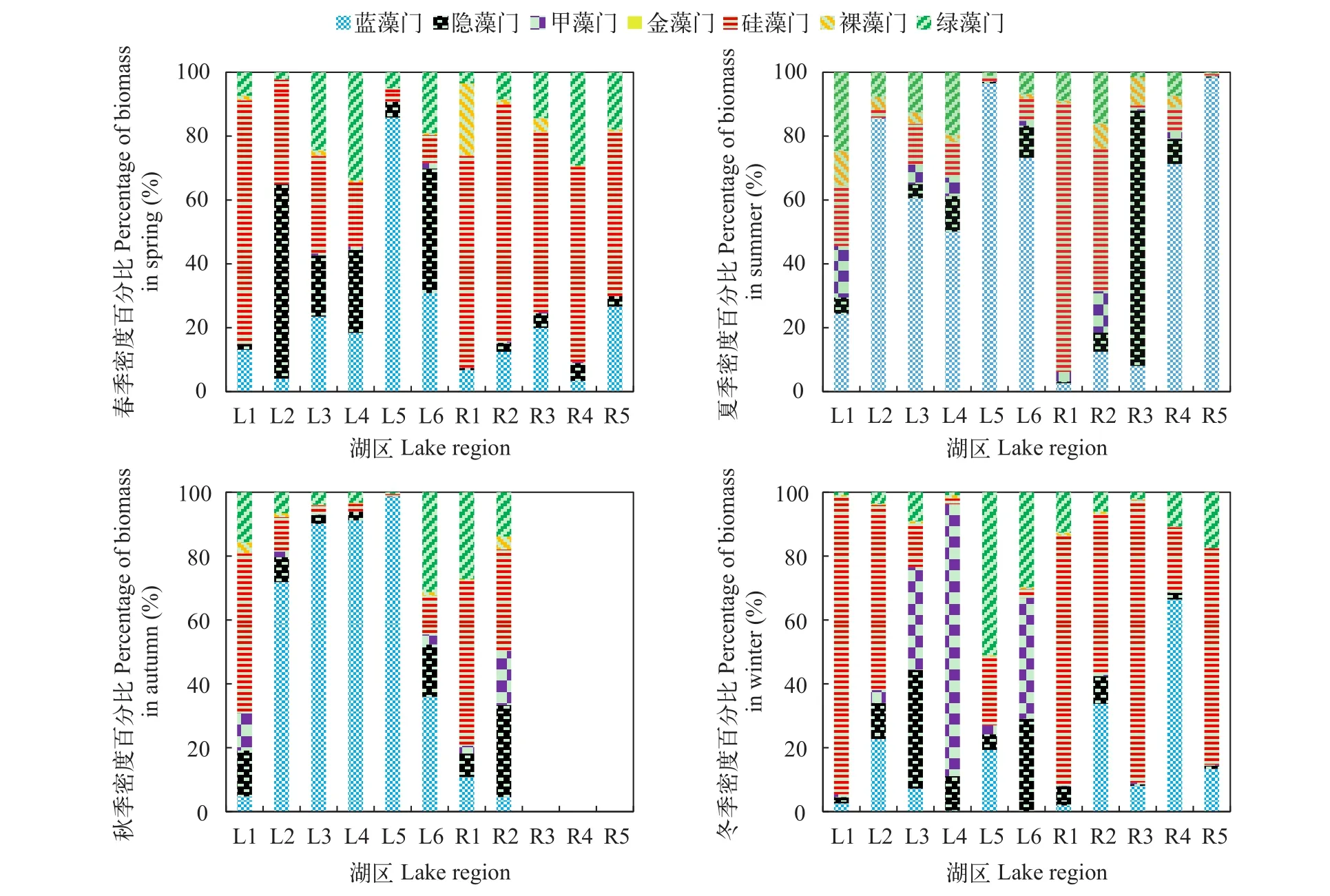
图 3 仙女湖及入湖河流浮游植物各门类密度百分比时空变化特征Fig. 3 Temporal and spatial dynamics of different phytoplankton species density percentage in Lake Xiannü and inflow rivers
图 4 仙女湖及入湖河流表层浮游植物各门类生物量百分比的时空变化特征Fig. 4 Temporal and spatial dynamics of different phytoplankton species biomass percentage in Lake Xiannü and inflow rivers
2.6 仙女湖环境因子与浮游植物功能类群的相互关系
分析结果表明, 温度升高能显著增加Ⅰ组、Ⅲ组Ⅳ组及Ⅶ组的浮游植物生物量, 其中对个体较小, 具有较大表面积/体积比的浮游植物类群影响最为显著; pH对Ⅴ组浮游植物具极显著正相关影响;水体中含量的升高会导致Ⅰ组、Ⅲ组及Ⅳ组浮游植物生物量下降; 同时水体中TP含量与Ⅰ组、Ⅲ组、Ⅳ组及Ⅴ组浮游植物生物量呈现极显著负相关关系; 水体中TN含量升高会导致Ⅰ组浮游植物生物量下降, 但是会显著升高Ⅲ组及Ⅵ组浮游植物生物量; 水体中叶绿素a与Ⅰ组及Ⅲ组浮游植物生物量显著正相关; 此外, 水体中浊度的升高会导致Ⅰ组、Ⅲ组和Ⅶ组浮游植物生物量下降; 水体中DO含量对各功能组影响均不显著(图 6)。
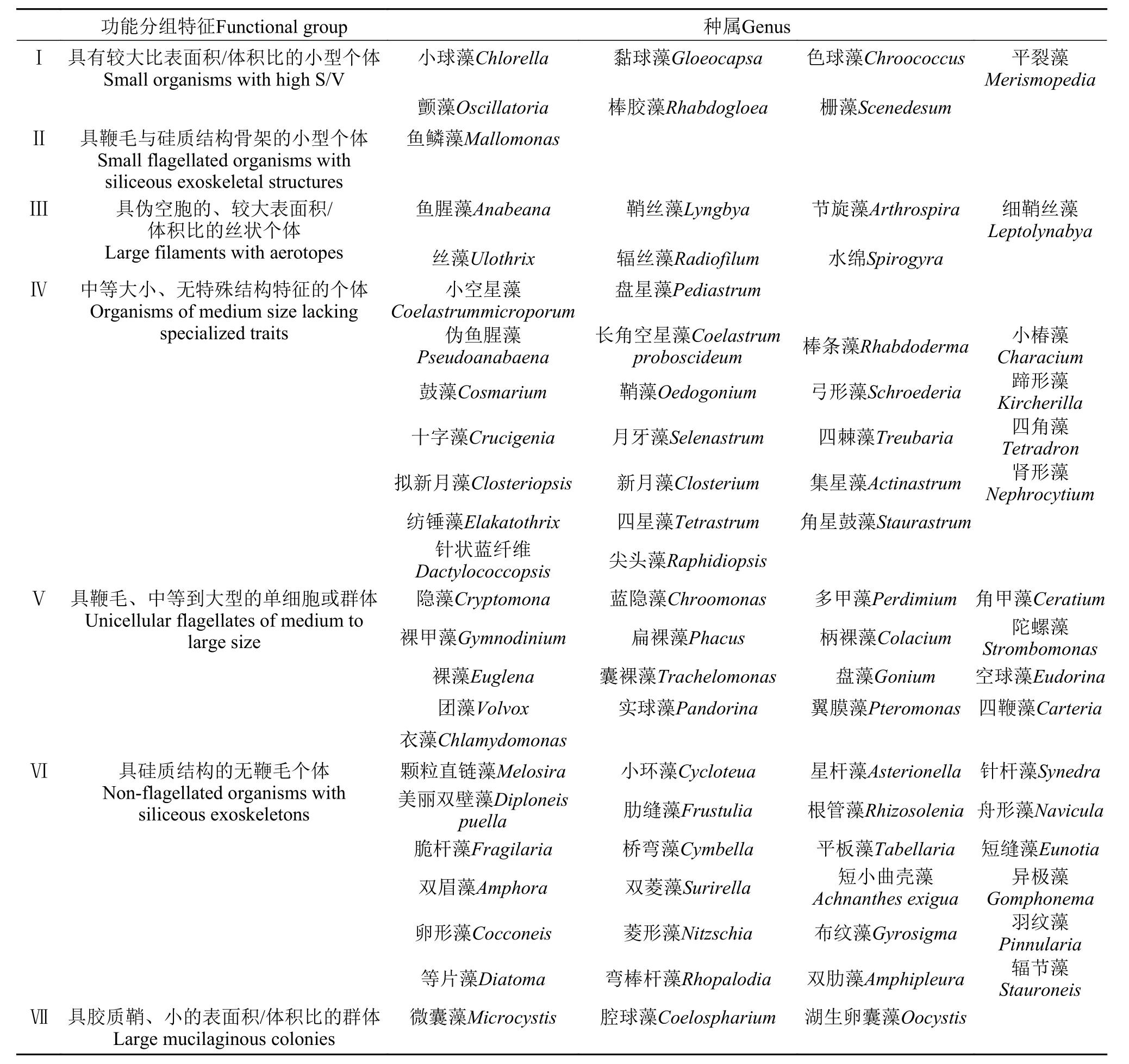
表 3 仙女湖及入湖河流浮游植物功能类群种类特征Tab. 3 Characteristics of the seven morphologically based functional groups (MBFG) of phytoplankton in Lake Xiannü and inflow rivers
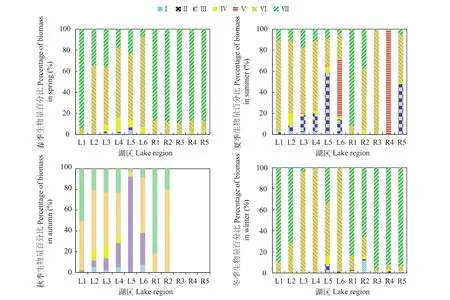
图 5 仙女湖及入湖河流浮游植物功能类群生物量百分比时空变化特征Fig. 5 Temporal and spatial dynamics of phytoplankton functional groups biomass percentage in Lake Xiannü and inflow rivers
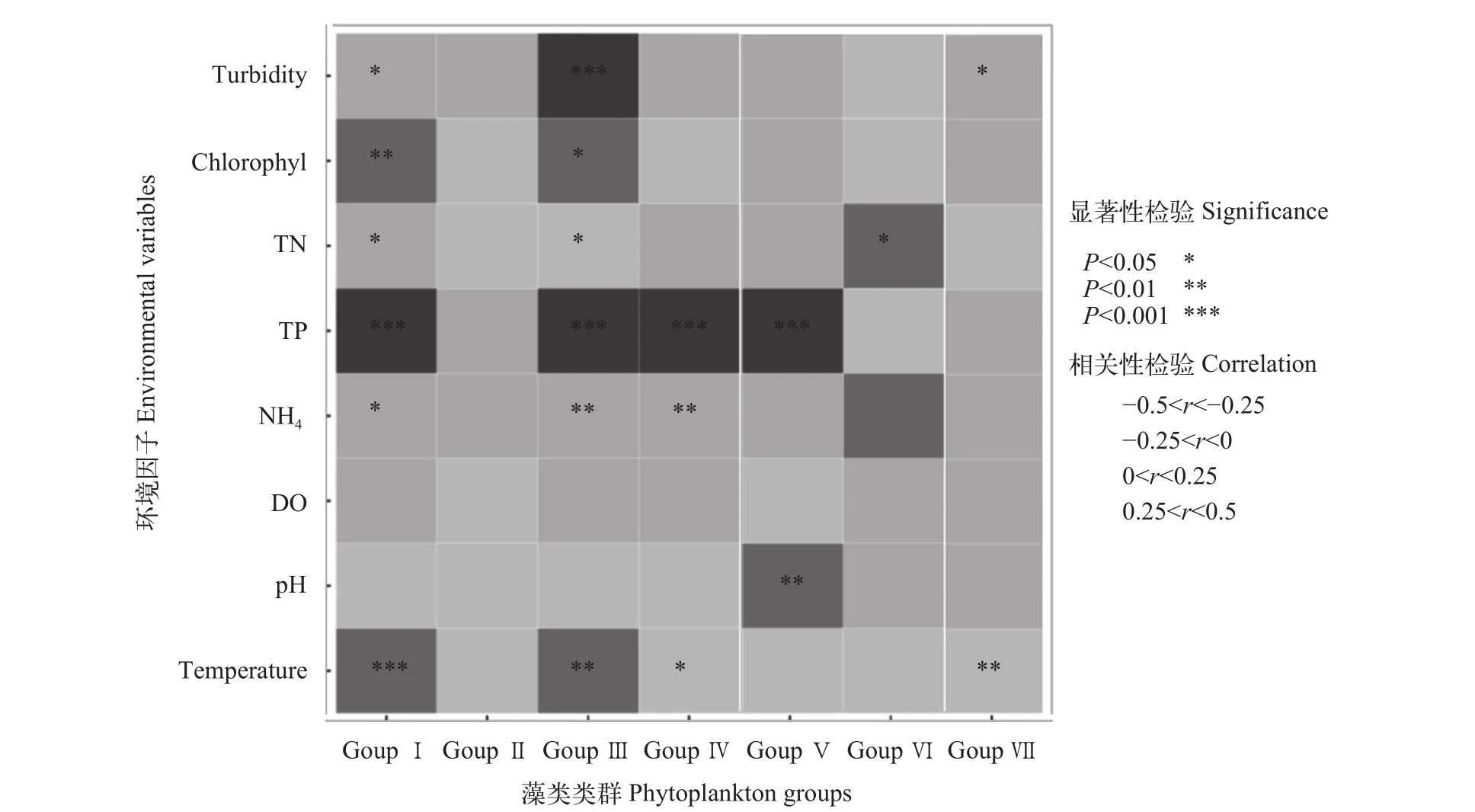
图 6 仙女湖及入湖河流环境因子与浮游植物功能类群的相互关系Fig. 6 The R analysis of the seven morphology-based functional groups (Ⅰ-Ⅶ) of phytoplankton in Lake Xiannü and inflow rivers based on environmental explanatory variables
3 讨论
3.1 仙女湖及入湖河流不同生境浮游植物的比较
仙女湖及入湖河流浮游植物优势种为鱼腥藻(Y=0.725)、平裂藻(Y=0.075)和隐藻(Y=0.056)。但由于蓝藻细胞面积较硅藻细胞小很多[17], 所以从生物量上看, 蓝藻主要在夏季占优, 而冬季硅藻和甲藻的生物量最高, 春季硅藻和隐藻的生物量最高。仙女湖及入湖河流域春季及冬季浮游植物生物量优势门以硅藻门占据R1-R5区域的绝对优势, 这主要是由于硅藻门低温条件下更具竞争优势[18]。春季L2-L6湖区生境多以隐藻门占统治地位, 而冬季L3-L6湖区生境多以甲藻门占统治地位, 可能是与氮、磷失衡, TP浓度偏低, 使具有光合性和非光合性营养方式的甲藻类在浮游植物群落中所占比例大幅攀升有关[19], 而且鞭毛藻类在资源限制条件下更具竞争优势, 因而隐藻也能占据优势地位。夏季及秋季生物量门类百分比特征则较为复杂, 不同湖区生境具不同优势门类及复杂栖息模板, 可能由于夏季气温高、光照强, 适宜浮游植物繁殖[20]。调查中鱼腥藻及平裂藻等被认为是富营养的种类, 在湖区生境及河流生境中均有发现, 且为优势种, 这可能与水质条件受到破坏, 水体富营养化有关。生态系统的一般趋势表明, 温度升高有利于小型生物群体的增长[21—23]。有实验显示, 蓝藻在夏季藻类爆发中占据优势地位[24,25], 蓝藻门藻类丰度可随温度上升而增长[26]。本次调查中R4、R5、L5和L6湖区生境中蓝藻门在夏季浮游植物密度百分比中增长可能与此相关。Moss等[27]提出温度升高作用通过改变蓝藻门藻类群落结构组成, 影响生态系统结构功能, 这与本次调查中蓝藻的增长明显导致R4生境区域水体浊度的升高相吻合。
3.2 仙女湖及入湖河流环境因子与浮游植物功能类群的相互关系
浮游植物可以依据简单的形态标准分为有意义的功能分组。要了解生态系统对环境变化的响应, 包括气候变化和富营养化的相互作用和预测浮游植物群落的变化, 对环境阈值的识别是必要的。
TN和TP是影响Ⅰ组生物量分布规律的重要指标。这类小个体浮游植物具有高效的资源获得能力及较高的比生长率[28], 其生物量与水体营养物的增加息息相关[29], 并能在良好营养条件下在浮游植物群落占优势地位[30]。仙女湖及入湖河流水体中的TN和TP含量处于中营养水平, 浮游植物爆发生长时, 水体营养物质有限, 无法满足高比生长率的Ⅰ组浮游植物生长, 导致Ⅰ组浮游植物生物量与仙女湖及入湖河流TN和TP含量最终呈现负相关关系,可见仙女湖及入湖河流的水体理化环境并不适宜这类浮游植物的增长, 因此该类生物并未能在仙女湖中占据统治地位。
Ⅱ组为具鞭毛和硅质结构的小型个体常在寒冷的贫营养型水体中拥有绝对优势[30,31], 鞭毛的可运动性, 形成了Ⅱ组浮游生物在资源限制条件下的竞争优势, 同时pH及电导率对Ⅱ组浮游生物变化规律具较大影响[32]。在本次调查中Ⅱ组浮游植物生物量同一定范围内水体温度及pH均呈现正相关关系。其中Ⅱ组浮游植物生物量与pH呈现的正相关关系可能与光合作用相关。春季及冬季的水温远低于夏季及秋季, 春季pH略低于其他季节, 环境条件不利于Ⅱ组浮游植物生长。Ⅱ组浮游植物个体偏小, 在适宜蓝藻门藻类爆发生长的夏季[9]处于劣势地位。
Ⅲ组浮游植物为有伪空胞、较大表面积/体积比的丝状个体, 叶绿素a、浊度、温度、TN、TP、均是驱动该组生物量变动的重要因素。Ⅲ组浮游植物常在浑浊的富营养化水体中具生存优势[7]。因此, 位于湖边或为进出水口, 为湖泊沿岸带, 受人类活动影响比较大的L3-L6湖区生境中, 夏季及秋季Ⅲ组浮游植物具有明显优势。此外, Ⅲ组浮游生物生物量与TN浓度呈现显著正相关关系, 夏季及秋季总氮浓度比其他季节高, 更有利于水体的浑浊与富营养化, 从而形成了Ⅲ组浮游植物的竞争优势。
Ⅳ组为中型且缺少特殊结构特征的个体,TN和浮游动物丰度是该类浮游植物增长的主要限制因素[8]。Ⅳ组浮游植物对营养物质资源限制及温度具有较强的忍耐力[7], 如栅藻属在40℃温度下仍能快速增殖[33,34], 导致其生物量与较低的TN浓度呈正相关态势, 且在极端高温条件也能正常生长。在调查的不同季节中, 春季的TN浓度最低, 平均值为0.77 mg/L, 冬季的TN浓度最高, 平均值为1.57 mg/L,Ⅳ组浮游植物呈现与TN浓度相反的趋势, 春季高,冬季低, 可能正是因其生物量与较TN浓度呈负相关态势有关。而Ⅳ组浮游植物在夏季湖区生境中能维持在与春季相似的百分比含量, 与Ⅳ组浮游植物对温度具有较强的忍耐力有关。Ⅳ组浮游植物与TP浓度呈现极显著负相关, 可能是由于Ⅳ组浮游植物生物量与TN浓度负相关关系的间接影响。
Ⅴ组为具有鞭毛、中等到大型的单细胞或群体, 在营养限制条件下具较高资源聚集能力及高抗环境变化导致衰亡的能力[35]。中等单细胞鞭毛个体有相对较高的最大线性尺寸, 具鞭毛的特征有利于该类浮游植物逃避浮游动物捕食, 导致Ⅴ组浮游植物对变暖环境与营养物质资源限制环境具有较强的忍耐力, 资源限制条件下Ⅴ组浮游植物较易在浮游植物群落中占据优势地位[18]。本次调查中Ⅴ组浮游生物与TN、TP、浊度及叶绿素a浓度均呈现负相关关系可能正与此相关。春季及冬季的水温远低于夏季及秋季, 低水温较利于硅藻复苏,而该类浮游生物在变暖的条件下更具竞争优势[8],因此, 春季和冬季湖区L1-L6中多以Ⅴ组浮游植物占据主导地位[8], R1-R5中表现为Ⅵ组浮游生物占优势, 而秋季湖区生境Ⅴ组和Ⅵ组均为优势种类。在夏季Ⅴ组浮游植物不但能在湖区L1-L6中占据优势地位, 且在R2、R3及R5中占优势可能与Ⅴ组浮游植物对变暖环境与营养物质资源限制环境具有较强的忍耐力有关[9]。但Ⅴ组浮游生物不能在富营养化水体中占优势[36]。
Ⅵ组为具硅质结构的无鞭毛个体, 具稳定硅酸盐需求, 这组浮游植物能适应较宽的营养状态阈值[25], 且在低温条件下更具竞争优势[18], 因此Ⅵ组浮游生物在春季及冬季呈现出较高的生物量百分比。且Ⅵ组浮游植物生物量与TN浓度呈正相关态势, 夏季TN浓度相对最高, 因此Ⅵ组浮游植物生物量的峰值出现在夏季, 但Ⅵ组生物量的大量增长可能会导致河流硅酸盐含量的下降[8]。
Ⅶ组为具胶质鞘、小的表面积/体积比的群体,这类浮游植物对资源可获得性较为敏感, 往往在高营养状态湖泊内发现[37]。Ⅶ组浮游植物仅在夏季傣家村和SW7采样点中占据优势地位可能正与此有关。通过不同季节仙女湖及入湖河流水体理化指标的监测结果发现, 大部分湖区处于轻度富营养状态; 以TN和TP含量对湖泊营养水平的评价结果表明, 仙女湖处于中营养水平, 均不属于高营养状态湖泊。因此, 氮磷等营养元素的相对缺乏会限制Ⅶ组浮游植物生物量的增长[38]。因此, 在本次调查过程中这类浮游植物的生物量相对较低。
综上所述, 环境因子与不同浮游植物功能群间存在着不同的相互关系。环境因子主要通过温度以及氮磷等营养物质的浓度变化影响浮游植物群落结构和丰度。因此, Kruk的浮游植物功能特征分组[8]可以间接反映出浮游植物物种栖息地的环境特征, 对于仙女湖流域水质监控、调查和预测浮游植物群落组成变动显然具重要参考价值[8,9]。因此,对于不同环境因子与浮游植物群落结构及功能特征进行相关调查研究十分必要。

附表 1 仙女湖及入湖河流浮游植物种类组成与分布Attached table 1 Species composition and distribution pattern of phytoplankton in Lake Xiannv and inflowing rivers

续附表1
参考文献:
[1] Chen C, Li S J, Hu R,et al. Comparative analysis of four methods for calculating biomass of phytoplankton community [J].Journal of Lake Sciences, 2013, 25(6):927—935 [陈纯, 李思嘉, 胡韧, 等. 四种浮游植物生物量计算方法的比较分析. 湖泊科学, 2013, 25(6):927—935]
[2] Tao M, Wang Y M, Xie B W,et al. Spatio-temporal distribution of plankton and driving environmental factors in the Tuojiang River [J].Acta Hydrobiologica Sinica, 2016,40(2): 301—312 [陶敏, 王永明, 谢碧文, 等. 沱江浮游生物群落时空分布及相关环境因子分析. 水生生物学报,2016, 40(2): 301—312]
[3] Zhou J, Li S N, Wang X J,et al. Spatial distribution characteristics of pico-phytoplankton and its impact factors during wet season in Lake Poyang [J].Journal of Lake Sciences, 2016, 28(3): 537—544 [周建, 李胜男, 王秀娟,等. 丰水期鄱阳湖超微型浮游植物空间分布特征及其影响因子. 湖泊科学, 2016, 28(3): 537—544]
[4] Markensten H. Climate effects on early phytoplankton biomass over three decades modified by the morphometry in connected lake basins [J].Hydrobiologia, 2006,559(1): 319—329
[5] Niu Y, Kong X H, Yu H,et al. Spatial distribution of phytoplankton community during summer stratification in Lake Fuxian [J].Chinese Journal of Ecology, 2016,35(7): 1865—1871 [牛远, 孔祥虹, 余辉, 等. 抚仙湖夏季热分层时期浮游植物空间分布特征. 生态学杂志, 2016,35(7): 1865—1871]
[6] Zhang YH, Li WF, Chen QW. Spatial-temporal variance of the intensity of algal bloom and related environmental and ecological factors in Lake Taihu [J].Acta Ecologica Sinica, 2016, 36(14): 4337—4345 [张艳会, 李伟峰, 陈求稳. 太湖水华程度及其生态环境因子的时空分布特征.生态学报, 2016, 36(14): 4337—4345]
[7] Kruk C, Huszar V L M, Peeters E T H M,et al. A morphological classification capturing functional variation in phytoplankton [J].Freshwater Biology, 2010, 55(3):614—627
[8] Kruk C, SeguraA M. The habitat template of phytoplankton morphology-based functional groups [J].Hydrobiologia, 2012, 698(1): 191—202
[9] Reynolds C S, Huszar V, Kruk C,et al. Towards a functional classification of the freshwater phytoplankton [J].Journal of Plankton Research, 2002, 24(5): 417—428
[10] Salmaso N, Padisák J. Morpho-Functional Groups and phytoplankton development in two deep lakes (Lake Garda, Italy and Lake Stechlin, Germany) [J].Hydrobiologia, 2007, 578(1): 97—112
[11] Weithoff G. The concepts of ‘plant functional types’ and‘functional diversity’ in lake phytoplankton-a new under-standing of phytoplankton ecology [J].Freshwater Biology, 2003, 48(9): 1669—1675
[12] Li W H, Zhang M, Meng J S,et al. Community structure of macrozoobenthos in Xiannv lake basin and assessment of its water [J].Resources and Environment in the Yangtze Basin, 2016, 25(8): 1218—1227 [李文浩, 张萌,门吉帅, 等. 江西仙女湖流域大型底栖动物群落结构及水质评价. 长江流域资源与环境, 2016, 25(8):1218—1227]
[13] Zhang M, Zhu R G, Zhou M,et al. Eutrophication assessment and estimation of water environmental capacity in lake xiannv of Jiangxi [J].Resources and Environment in the Yangtze Basin, 2015, 24(8): 1395—1404 [张萌, 祝国荣, 周慜, 等. 仙女湖富营养化特征与水环境容量核算.长江流域资源与环境, 2015, 24(8): 1395—1404]
[14] Zou B C, Eutrophication evolution, driving mechanism and bloom risk assessment for Xiannv lake [D]. Nanchang University. 2015 [邹斌春. 仙女湖富营养化演变、驱动机制及水华风险评估(学位论文). 南昌大学.2015]
[15] Jin X C, Tu Q Y. Survey Standards of Lake Eutrophication (2nd Edition) [M]. China Environmental Science Press. 1990, 160—175 [金相灿, 屠清瑛. 湖泊富营养化调查规范(第二版). 中国环境科学出版社. 1990, 160—175]
[16] Su XY, Zhang M, Yu C,et al. Effects of temperature elevating on morphology and spring recruitment of bellamya aeruginosa in an outdoor mesocosm experiment[J].Resources and Environment in the Yangtze Basin,2016, 25(10): 1603—1610 [苏溪阳, 张敏, 于晨, 等. 升温对铜锈环棱螺形态及春季个体增补影响的模拟实验研究. 长江流域资源与环境, 2016, 25(10): 1603—1610]
[17] Cui Y, Zhu G W, Li H Y,et al. Spatial and temporal distribution characteristics of water quality in shahe reservoir within tianmuhu reservoir and its relationship with phytoplankton community [J].Journal of Hydroecology,2014, 35(3): 10—18 [崔扬, 朱广伟, 李慧赟, 等. 天目湖沙河水库水质时空分布特征及其与浮游植物群落的关系. 水生态学杂志, 2014, 35(3): 10—18]
[18] Mutshinda C M, Finkel Z V, Widdicombe C E,et al. Ecological equivalence of species within phytoplankton functional groups [J].Functional Ecology, 2016, 30(10):1714—1722
[19] Li Y, Li D J, Tang J L,et al. Phytoplankton distribution and variation in the yangtze river estuary and its adjacent sea [J].Environmental Science, 2007, 28(4): 719—729[李云, 李道季, 唐静亮, 等. 长江口及毗邻海域浮游植物的分布与变化. 环境科学, 2007, 28(4): 719—729]
[20] Wang J Y, Wang Z C, Li C,et al. The spatio-temporal dynamics of phytoplankton community structure in the head region of the three gorges reservoir [J].Acta Hydrobiologica Sinica, 2015, 39(5): 877—884 [王静雅, 汪志聪, 李翀, 等. 三峡水库坝前水域浮游植物群落时空动态研究. 水生生物学报, 2015, 39(5): 877—884]
[21] Daufresne M, Lengfellner K. Global warming benefits the small in aquatic ecosystems [J].Proceedings of the National Academy of Sciences, 2009, 106(31): 12788—12793
[22] Finkel Z V, Beardall J, Flynn K. Phytoplankton in a changing world: cell size and elemental stoichiometry [J].Journal of Plankton Research, 2010, 32(1): 119—137
[23] Morán X A G, Alejandra C D, Li W K W. Increasing importance of small phytoplankton in a warmer ocean [J].Global Change Biology, 2010, 16(3): 1137—1144
[24] Dokulil M T, Teubner K. Cyanobacterial dominance in lakes [J].Hydrobiologia, 2000, 438(1): 1—12
[25] Mooij W M, Hülsmann S, Domis L N D S,et al. The impact of climate change on lakes in the Netherlands: a review [J].Aquatic Ecology, 2005, 39(4): 381—400
[26] Jöhnk K D, Huisman J, Sharples J,et al. Summer heatwaves promote blooms of harmful cyanobacteria [J].Global Change Biology, 2008, 14(3): 495—512
[27] Moss B, McKee D, Atkinson D,et al. How important is climate? Effects of warming, nutrient addition and fish on phytoplankton in shallow lake microcosms [J].Journal of Applied Ecology, 2003, 40(5): 782—792
[28] Jones R I, Reynolds C S. The Ecology of Freshwater Phytoplankton [M]. Cambridge University Press. 1984,221
[29] Bell T, Kalff J. The contribution of picophytoplankton in marine and freshwater systems of different trophic status and depth [J].Limnology & Oceanography, 2001, 46(5):1243—1248
[30] Izaguirre I, Allende L, Marinone M C. Comparative study of the planktonic communities of three lakes of contrasting trophic status at Hope Bay (Antarctic Peninsula) [J].Journal of Plankton Research, 2003, 25(9): 1079—1097
[31] Andersen T. Vegetation Processes in the Pelagic: A model for ecosystem theory [J].Phycologia, 1998, 37(1):70—71
[32] Siver P A, Hamer J S. Multivariate statistical analysis of the factors controlling the distribution of scaled chrysophytes [J].Limnology & Oceanography, 1989, 34(2):368—381
[33] Sanchez J, Fernandez-Sevilla J, Acien F,et al. Biomass and lutein productivity of Scenedesmus almeriensis: influence of irradiance, dilution rate and temperature [J].Applied Microbiology and Biotechnology, 2008, 79(5):719—729
[34] Staehr P, Birkeland M. Temperature acclimation of growth, photosynthesis and respiration in two mesophilic phytoplankton species [J].Phycologia, 2006, 45(6):648—656
[35] Alves D S, González M T, Iriarte J L. Functional groups in marine phytoplankton assemblages dominated by diatoms in fjords of southern Chile [J].Journal of PlanktonResearch, 2008, 30(11): 1233—1243
[36] Segura A M, Kruk C, Calliari D,et al. Use of a morphology-based functional approach to model phytoplankton community succession in a shallow subtropical lake [J].Freshwater Biology, 2013, 58(3): 504—512
[37] Smayda, Theodore J. Harmful algal blooms: Their ecophysiology and general relevance to phytoplankton blooms in the sea [J].Limnology & Oceanography, 1997,42(5): 1137—1153
[38] Rangel L M, Soares M C S, Paiva R,et al. Morphologybased functional groups as effective indicators of phytoplankton dynamics in a tropical cyanobacteria-dominated transitional river-reservoir system [J].Ecological Indicators, 2016, 64: 217—227
