加速流对鲢、鳙幼鱼下行过程中游泳行为的影响
2018-05-16李敏讷朱海峰金志军许家炜李志敏马卫忠石小涛
李敏讷 朱海峰 金志军 罗 佳 许家炜 李志敏 马卫忠 石小涛
(1. 三峡大学三峡库区生态环境教育部工程研究中心, 宜昌 443002;2. 中国电建集团贵阳勘测设计研究院有限公司, 贵阳 550081)
鱼类生态习性复杂, 栖息生境多变, 游泳运动被视为其实现生存繁衍等生命活动的重要基础[1]。拦河设施的修建破坏了河流连续性, 阻隔了洄游性鱼类的正常游泳节律[2], 包括鱼类溯河洄游和降河洄游。其中, 多种幼鱼均有下行洄游需求[3—5]。鱼类主要通过溢洪道、水轮机、过鱼旁路、集运鱼系统、船闸等方式下行, 同时也利用物理阻隔设施(如气泡幕)和行为导鱼设施(如导鱼栅)等方式辅助下行[6], 但部分过鱼措施效果并不理想, 其根本原因是对鱼类下行行为与加速流之间的响应关系缺乏深入研究[7]。
水流速度逐渐增加的加速流是鱼类下行过坝必须面临的一种特征水流, 普遍存在于鱼类下行过坝通道中(如溢洪道、水轮机、过鱼旁路等)[8], 加速流可能引起鱼类下行逃逸行为或造成鱼类因被动卷吸而受到生存威胁[9]。国外学者陆续开展了鱼类下行通过加速流的行为机制研究[4,7,9], 取得了一定成绩, 但整体仍处于起步阶段。国内仅对洄游性鱼类如中华鲟(Acipenser sinensis)的下行行为进行了少量研究[10,11], 目前有关针对鱼类下行过程中应对加速流行为的研究尚未见报道。
在鱼类下行通过加速流的行为学研究中, 流速是建立鱼类游泳行为与水力因子响应关系的重要指标之一[12,13]。相关研究表明鱼类在不同自然生境和室内试验中游泳时会选择相似的流速范围, 即鱼类存在偏好水流速度(Preferred water velocity)[14]。国内外主要采用鱼类在不同流速区域游泳时间百分比衡量其偏好水流速度[15]。鱼类偏好水流速度影响其对栖息地选择、捕食方式以及维持游泳姿态稳定所需耗能[16]。本研究以具有明确下行洄游需求的鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)幼鱼为实验对象, 采用自行设计的断面收缩式水槽装置制造两种不同流态的加速流,探讨加速流对鱼类偏好水流速度以及下行行为的影响, 为鲢、鳙幼鱼下行过坝应对加速流行为研究提供基础资料与参考依据。
1 材料与方法
1.1 实验材料
实验鱼于2016年6月购自湖北宜都渔场, 通过充氧水包运至三峡大学生态水工实验室, 置于圆形玻璃钢暂养水槽(直径2 m, 水深0.5 m)内暂养3d。暂养期间, 水温范围控制在(20.0±1.2)℃, 日换水量约为暂化水体的25%, 24h持续充氧。在暂养结束后, 挑选体重相近、健康活泼的鱼体作为研究对象。其中鲢体长(9.4±1.1) cm, 体重(9.5±3.0) g; 鳙体长(10.13±1.09) cm, 体重(14.68±3.58) g, 统计值均以平均值±标准差(Mean±SD)表示。
实验装置如图 1所示, 其中水箱(A)与整个装置相通, 通过水箱与装置平面产生不同水位差制造不同范围加速流, 紧接着水箱的为平整水流的导流筛板(B), 其后为整流后的均匀流区域(C), 水槽进口设有拦网(D), 通过断面渐缩的渐变水槽(E)制造加速流流场, 其中预实验的空白组实验区如图中虚线所示, 过水断面形状沿程不变用以制造均匀流。摄像机架设在实验区域正上方。
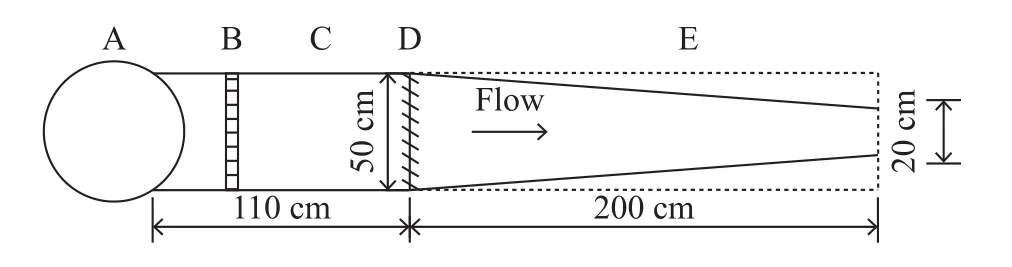
图 1 鱼类偏好水流速度实验装置结构示意图Fig. 1 The structure of device on determining fish preferred water velocity
1.2 实验方法
有研究表明鲢、鳙幼鱼在20℃环境下偏好15.18—27.91 cm/s[17], 预实验空白组流速设为25 cm/s,对照组的加速流进口流速(25 cm/s)与空白对照相同。预实验发现空白组实验鱼未表现下行行为, 但对照组表现出了下行行为, 表明加速流对实验鱼的游泳行为产生了影响。为进一步探索这种影响, 本研究设置了两种不同流态的加速流, 用以对比和验证。
在水温为(20±1)℃环境下, 体长为9.8—12.3 cm的鳙临界游泳速度为(4.58±0.56) BL/S[18], 鲢为(5.87±0.25) BL/S[19]。以往研究, 加速流速度范围一般为0—60 cm/s[15]。为探索幼鱼在加速流中出现下行行为时, 加速流流速特征与幼鱼的偏好流速及临界游泳速度之间的关系, 本实验2种加速流分别设为22—55 cm/s和25—60 cm/s。实验区域按5 cm/s流速差划分为1—8个流速区域: 加速流Ⅰ(1. <25 cm/s,2. 25—30 cm/s, 3. 30—35 cm/s, 4. 35—40 cm/s,5. 40—45 cm/s, 6. 45—50 cm/s, 7. 50—55 cm/s, 8.>55 cm/s), Ⅱ(1. <30 cm/s, 2. 30—35 cm/s, 3. 35—40 cm/s, 4. 40—45 cm/s, 5. 45—50 cm/s, 6. 50—55 cm/s, 7. 55—60 cm/s, 8. >60 cm/s)。在进行结果对比时, 以Ⅱ区域划分为准, 将Ⅰ中第1、2流速区域归并为<30 cm/s, 第8流速区域归并为55—60 cm/s。在2种加速流下, 每次实验随机选择1尾鱼, 依次完成鲢和鳙各30尾。为消除饵料消化影响, 所有实验鱼在实验前禁食24h。实验时先将实验鱼转入装置C区域适应1h, 适应期水流环境与实验期一致, 适应结束后拉开拦网(D)使鱼进入实验区域(E)。同时开启摄像头, 实验时间在每天9:00—19:00。若实验鱼下行通过渐变水槽最末端, 则本次实验结束, 并记录相应实验时间, 每尾实验鱼最长摄像时间为0.5h[3]。在实验中, 总活动时长(从实验开始至鱼体最后一次完全通过水槽最末端的时间)<5min的实验鱼在加速流中未表现出明显停留行为, 视为直接下行。总活动时长为5—30min的实验鱼行为视为非直接下行。在下行通过方式上, 将头部先通过的方式(即顺流而下)视为主动下行, 尾部先通过的方式(即顶流通过)视为被动下行[3]。通过采用实验视频和流场相耦合(图 2)的方法获取实验鱼在2种加速流下游泳行为相关数据并计算得到实验鱼在各速度区域停留时间百分比Ft。式中,Ft为实验鱼在各流速区域停留时间百分比(%),t为实验鱼在各速度区域停留时间(s),T为每尾鱼的总活动时长(s)。
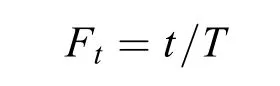
图 2 加速流Ⅰ中视频与流场耦合效果图Fig. 2 Combination figure of accelerating flowⅠvideo and the flow field
1.3 数据处理
实验数据采用SPSS 20.0进行相关数据统计分析, 鱼的种类和速度区域对Ft的影响采用双因素方差分析; 同一鱼种, 不同加速流下各速度区域Ft采用单因素方差(ANOVA)分析, 若组间存在差异则采用多重比较(Duncan)分析差异。统计值均以平均值±标准误(Mean±SE)表示, 显著水平为P<0.05。
2 结果
2.1 鲢、鳙下行率及下行方式比较
实验结果表明(表 1), 2种加速流下鲢、鳙均出现一定比例的直接下行。在加速流Ⅰ中, 鲢的直接下行率高于鳙, 鲢、鳙非直接下行率分别高于相应的直接下行率; 在Ⅱ中, 鳙的直接下行率高于鲢, 且鲢、鳙的直接下行率高于Ⅰ。鲢、鳙在下行方式上也存在一定差异。鲢在2种加速流中主要以头部朝向上游(被动)下行, 而鳙主要以头部朝向下游(主动)方式下行。
2.2 加速流对鲢、鳙偏好水流速度的影响
不同加速流及流速区域对各速度区域停留时间有显著影响。图 3可见鳙在加速流Ⅰ中的第1(<30 cm/s)和第6(50—55 cm/s)流速区域的Ft值显著高于其他流速区域(P<0.05), 且这两组的Ft值无差异(P>0.1), 其他5组的Ft值无差异(P>0.1)。Ⅱ中第1、2速度区域Ft无差异(P>0.1), 第1速度区域Ft值显著高于第3—8流速区域(P<0.05), 且第2—8组流速区域Ft值无明显性差异(P>0.1)。Ⅰ中第6速度区域的Ft显著高于梯度Ⅱ(P<0.05), 但Ⅰ中第2—5流速区域的Ft显著低于Ⅱ(P<0.05)。
鲢在加速流Ⅰ中的低流速区域Ft值显著高于高流速区域(图 4)。其中, 第1流速区域Ft显著高于其他流速区域(P<0.05); 第2流速区域的Ft值显著高于第4—7流速区域(P<0.05)且与第3区域无明显差异(P>0.1); 第3—7流速区域的Ft无显著性差异(P>0.1); 鲢在Ⅱ中的第1流速区域的Ft显著高于其他流速区域(P<0.05), 其他流速区域的Ft值无明显差异(P>0.1)。Ⅰ与Ⅱ相比, 同一流速区域中的Ft无明显性差异。
将2种加速流流速相同区域(图 5)作为重复统一分析发现, 流速区域对Ft有显著影响, 且其影响因鱼的种类而异(交互作用:P<0.001)。其中鲢、鳙在第1、6流速区域的停留时间存在显著性差异(P<0.05), 中间及高流速区域无明显性差异(P>0.1)。另外鲢、鳙在第1流速区域的停留时间显著高于其他区域。
3 讨论
3.1 两种加速流下鲢、鳙下行率与下行方式
鱼类下行应对加速流最终会出现逃逸和通过2种结果, 其轨迹取决于逃逸和适应行为的权衡[20],且鱼类通常不愿通过非自然条件下特定范围加速流[21], 如鲑(Oncorhynchus tschawytscha)幼鱼在特定加速流流场下会表现出强烈的逃避行为[7], 不同种的大西洋鲑(Salmo salar)和七鳃鳗(Lampetra japonicum)分别选择避开突变水流区域[22]。本研究发现鲢、鳙在加速流Ⅰ中非直接下行率高于直接下行, Ⅱ与Ⅰ相比, 鲢、鳙直接下行率有明显上升。Ⅱ中通过视频观察发现随着流速的增大实验鱼表现出了逆流后退和顺流而下的行为, 且会采取反复下行-逃逸的策略来适应并最终通过加速流,这是造成加速流Ⅱ的直接下行率比Ⅰ大的主要原因。相关水利工程可以通过增大流速梯度来提高鲢、鳙的直接下行率, 减少下行时间。另外, 在2种加速流下鲢、鳙下行的通过方式也存在区别, 鳙主要以头部朝向下游(主动下行)的方式通过为主, 鲢主要以头部朝向上游(被动下行)的方式为主, 有研究表明在基本相同的外界条件下, 鲢的克流能力大于鳙[19]。
鳙主动下行方式的可加快下行速度, 节约下行时间, 但这种顺流而下的方式会减少鱼类探寻周围环境的时间, 在下行遇到水流速度障碍时不能及时调整游泳姿态(从顺流而下到逆流而上), 进而增加被挟带到危险区域的风险。相对于鳙, 鲢顶流下行用时较长, 但鲢可通过控制摆尾频率来改变游泳速度和游泳策略, 有相对较多的时间去探寻周围环境[21]。这种差异的产生可能与不同鱼种遗传因素和栖息环境有关[23]。
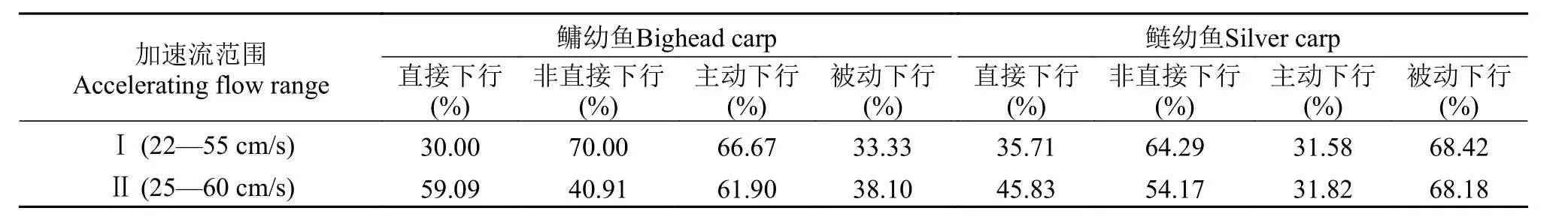
表 1 鲢、鳙在2种加速流中的下行行为比较Tab. 1 The comparison of downstream migration behaviors of silver carp and bighead carp under two types of accelerating flow
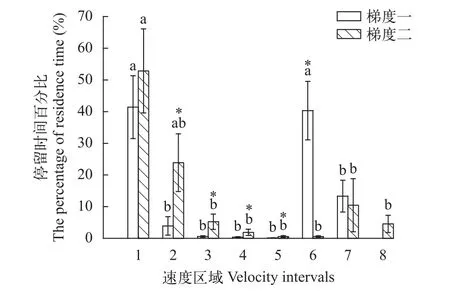
图 3 鳙在2种加速流下的各个速度区域停留时间百分比Fig. 3 The percentage of residence time at different velocity intervals for bighead carp under two types of accelerating flow
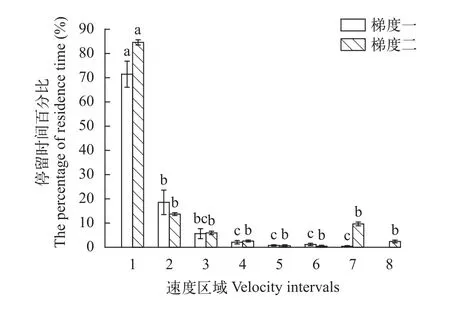
图 4 鲢在2种加速流下的各个速度区域停留时间百分比Fig. 4 The percentage of residence time at different velocity intervals for silver carp under two types of accelerating flow
3.2 加速流对鲢、鳙偏好水流速度的影响
目前已在游泳断面呈扩散形式的流速选择装置中进行了运动能量代谢、营养状况、温度驯化等对鱼类偏好水流速度的影响研究[24—26], 但在游泳断面呈收缩形式的实验装置中研究加速流对鱼类偏好游泳的影响却鲜有报道。
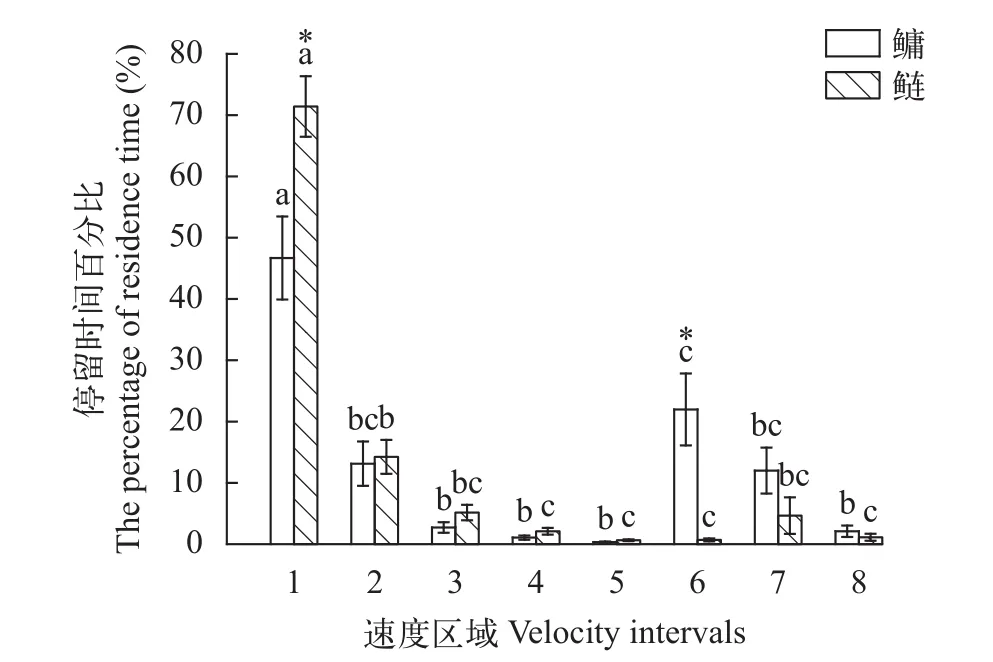
图 5 鲢、鳙在加速流下各个流速区域停留时间百分比Fig. 5 The percentage of residence time at different velocity intervals for silver carpand bighead carp under the accelerating flow
鱼类对水流具有一定的选择性, 可对抗水流而逆流游泳, 亦可通过调节自身游泳姿态来适应水流速度[27]。本研究发现, 在2种加速流下, 鲢在<30 cm/s流速区域Ft值分别为71.43%、84.57%, 鳙分别为41.41%、52.85%, 均显著大于其他流速区域, 说明鲢、鳙在该条件下具有偏好水流速度。这与滤食性鲢和鳙表现出的偏好水流速度为15.18—27.91 cm/s结果吻合[17]。
将2种加速流流速相同区域合并作为重复统一分析发现, 鲢、鳙停留时间除在第1、6流速区域存在显著性差异外(P<0.05), 其他流速区域不存在显著性差异(P>0.1)。视频分析发现, 鳙较鲢更偏好顺流而下至下游高速流区域, 在高流速区域停留时间长短受鱼类游泳能力强弱影响, 当断面流速超过其临界游泳速度时, 由于游泳能力不足, 无法持续使用稳定游泳方式[1], 疲劳后的鳙顺流而下导致鳙在第6流速区域的停留时间显著大于鲢(P<0.05)。鲢和鳙相比, 具有逆流而上的顶流习性[19], 实验开始后并不随水下行, 选择在上游区域持续顶流游泳,导致在第1流速区域鲢的停留时间显著高于鳙(P<0.05)。相关研究表明不同水流速度生境中鱼类游泳能力存在明显差异且所偏好水流速度范围也有所不同[28], 这与鱼类外部形态、内部结构以及水流流态密切相关[29]。加速流Ⅰ与Ⅱ相比, 鳙选择的流速范围有所不同, 表明加速流对鳙幼鱼下行过程中游泳行为产生了影响, 另外鱼类下行游泳行为还会受到发育阶段、昼夜节律、光照等影响[10,17], 如褐鳟(Salmo trutta)主要在夜间下行洄游[30], 光照则通过影响鱼类的视觉信号获取和集群行为产生改变大鳞大马哈鱼(Oncorhynchus tshawytscha)的下行行为[31,32]。由于鱼类行为的复杂性和其同时受内在和外在因素影响的特征, 鱼类下行通过加速流的行为学规律仍有待研究。
鱼类下行与上溯相比, 更依赖于其对突变环境产生的行为策略[4]。鱼类偏好流速选择是一种基于减少耗能的自主生态行为[14], 临界游泳速度一定程度上反应了其有氧游泳能力[1], 这种能力的强弱会影响鱼类在高流速区域顶流游泳时间, 进而影响鱼类偏好流速结果。本研究中的加速流范围包括了实验鱼的临界游泳速度, 研究结果表明实验鱼的偏好流速均小于其临界游泳速度, 其原因可能是鱼类在临界游泳速度下游泳耗能较大, 实验鱼选择了低于临界游泳速度的流速区域以减少游泳耗能。
研究鱼类在下行洄游过程中应对加速流的行为反应, 可为鱼类下行过坝技术提供参考, 如水轮机进水口优化可考虑兼顾过鱼对象下行行为的相关水力学指标、加速流范围及过流断面形式等, 具有积极的现实意义。本研究探索了2种不同加速流下鲢、鳙下行行为与偏好流速的选择, 结果显示2种不同的加速流对鱼类下行行为和流速选择产生了一定的影响, 同时该结果也为其他鱼种下行应对加速流的行为研究提供了一种研究思路。鉴于不同鱼种在应对不同流态时, 鱼类行为反应可能存在差异, 下一步将在此基础上对其他具有下行洄游需求的鱼类, 进一步探索鱼类下行过程中应对不同加速流梯度时的行为反应。
参考文献:
[1] Fu S J, Cao Z D, Zeng L Q,et al. Fish Swimming—Strategy and Adaptive Evolution [M]. Beijing: Science Press. 2014, 1—7 [付世建, 曹振东, 曾令清, 等. 鱼类游泳运动—策略与适应性进化. 北京: 科学出版社. 2014,1—7]
[2] Morita K, Yamamoto S. Effects of habitat fragmentation by damming on the persistence of stream-dwelling charr populations [J].Conservation Biology, 2002, 16(5):1318—1323
[3] Enders E C, Gessel M H, Williams J G. Development of successful fish passage structures for downstream migrants requires knowledge of their behavioural response to accelerating flow [J].Canadian Journal of Fisheries &Aquatic Sciences, 2008, 66(12): 2109—2117
[4] Russon I J, Kemp P S. Advancing provision of multi-species fish passage: Behaviour of adult European eel (Anguilla anguilla) and brown trout (Salmo trutta) in response to accelerating flow [J].Ecological Engineering,2011, 37(12): 2018—2024
[5] Piper A T, Wright R M, Walker A M,et al. Escapement,route choice, barrier passage and entrainment of seaward migrating European eel,Anguilla anguilla, within a highly regulated lowland river [J].Ecological Engineering, 2013, 57(8): 88—96
[6] Zhu H F, Liu L, Lu B,et al. A review of fish passage facilities for downstream migrants [J].Journal of Yangtze River Scientific Research Institute, 2015, 32(10): 33—37[朱海峰, 刘流, 路波, 等. 鱼类下行过坝相关工程措施综述. 长江科学院院报, 2015, 32(10): 33—37]
[7] Alex H, Mufeed O, John N,et al. Effect of water acceleration on downstream migratory behavior and passage of atlantic salmon smolts and juvenile american shad at surface bypasses [J].Transactions of the American Fisheries Society, 1998, 127(1): 118—127
[8] David A V, Dennis W R, John M K. Migratory Behavior and forebay delay of radio-tagged juvenile fall chinook salmon in a lower snake river impoundment [J].North American Journal of Fisheries Management, 2000, 20(1):41—52
[9] Buysse D, Mouton A M, Stevens M,et al. Mortality of European eel after downstream migration through two types of pumping stations [J].Fisheries Management &Ecology, 2014, 21(1): 13—21
[10] Zhuang P, Kynard B, Zhang L,et al. Ontogenetic behavior and migration of Chinese sturgeon,Acipenser sinensis[J].Environmental Biology of Fishes, 2002, 65(1): 83—97
[11] Wang C, Kynard B, Wei Q,et al. Spatial distribution and habitat suitability indices for non-spawning and spawning adult Chinese sturgeons below Gezhouba Dam,Yangtze River: Effects of river alterations [J].Journal of Applied Ichthyology, 2013, 29(1): 31—40
[12] Lin C Y, Luo J, Liu D F,et al. The behavior response of juvenileAristichthys nobilisto the accelerating flow during their downstream migration [J].Acta Hydrobiologica Sinica, 2017, 41(3): 560—564 [林晨宇, 罗佳, 刘德富,等. 鳙幼鱼在下行过程中应对加速流的行为响应研究.水生生物学报, 2017, 41(3): 560—564]
[13] Bai Y Q, Lu B, Luo J,et al. Induction velocity of juvenile grass carp, silver carp, and darkbarbel catfish [J].Chinese Journal of Ecology, 2013, 32(8): 2085—2089[白艳勤, 路波, 罗佳, 等. 草鱼、鲢和瓦氏黄颡鱼幼鱼感应流速的比较. 生态学杂志, 2013, 32(8): 2085—2089]
[14] Arjan P P, Josep V P. Swimming Physiology of Fish Towards Using Exercise to Farm a Fit Fish in Sustainable Aquaculture [M]. Berlin: Springer Central Book Services.2013, 81—108
[15] Tudorache C, O’Keefe R A, Benfey T J. Optimal swimming speeds reflect preferred swimming speeds of brook charr (Salvelinus fontinalisMitchill, 1874) [J].Fish Physiology and Biochemistry, 2011, 37(2): 307—315
[16] Holm C F, Armstrong J D, Gilvear D J. Investigating a major assumptionof predictive instream habitat models: is water velocity preference of juvenile Atlantic salmon independent of discharge [J]?Journal of Fish Biology,2001, 59(6): 1653—1666
[17] Wu Q Y, Zeng L Q, Cao Z D,et al. The preferred water velocity beha-vior of six Cyprinids with different feeding habits [J].Journal of fisheriesof China, 2016, 39(12):1807—1816 [吴青怡, 曾令清, 曹振东, 等. 鲤科鱼类的流速选择及其与食性的关系. 水产学报, 2016, 39(12):1807—1816]
[18] Cai L, Tu Z Y, Yuan X,et al. Swimming capability and swimming behaviour of juvenileAristichthys nobilis[J].Resources and Environment in the Yangtze Basin, 2012,S2: 89—95 [蔡露, 涂志英, 袁喜, 等. 鳙幼鱼游泳能力和游泳行为的研究与评价. 长江流域资源与环境, 2012,S2: 89—95]
[19] Fang M. Swimming capability of several cyprinid and assessment of vertical slot fishways base on simulation [D].Thesis for Master of Science. China Three Gorges University, Yichang. 2014 [房敏. 几种鲤科鱼游泳能力研究及竖缝式鱼道模拟与评价. 硕士学位论文, 三峡大学,宜昌. 2014]
[20] Kemp P S, Anderson J J, Vowles A S. Quantifying behaviour of migratory fish: Application of signal detection theory to fisheries engineering [J].Ecological Engineering, 2012, 41(4): 22—31
[21] Williams J G, Armstrong G, Katopodis C,et al. Thinking like a fish: a key ingredient for development of effective fish passage facilities at river obstructions [J].River Research and Applications, 2012, 28(4): 407—417
[22] Kemp P S, Mike H G, John G W. Fine-Scale behavioral responses of pacific salmonid smolts as they encounter divergence and acceleration of flow [J].Transactions of the American Fisheries Society, 2005, 134(2): 390—398
[23] Li X, Lin X T, Song B L,et al. Effects of water velocities onswimming performances of Juvenile Tinfoil BarbBarbodes schwanenfeldi[J].Chinese Journal of Zoology,2010, 45(2): 126—133 [李想, 林小涛, 宋波澜, 等. 流速对红鳍银鲫幼鱼游泳状态的影响. 动物学杂志, 2010,45(2): 126—133]
[24] Wu Q Y, Cao Z D, Fu S J. Flow velocity selection and its relationship to locomotive energetic metabolism in Chinese bream (Parabramis pekinensis) and pale chub(Zacco platypus) [J].Acta Ecologica Sinica, 2016,36(13): 4187—4194 [吴青怡, 曹振东, 付世建. 鳊鱼和宽鳍鱲幼鱼流速选择与运动能量代谢特征的关联. 生态学报, 2016, 36(13): 4187—4194]
[25] Wu Q Y, Zeng L Q, Fu S J. Preferred swimming behavior in the crucian carp (Carassius auratus) at different nutrition status [J].Journal of Fishery Sciences of China,2016, 23(3): 565—573 [吴青怡, 曾令清, 付世建. 不同营养状况对鲫鱼偏好水流速度的影响. 中国水产科学,2016, 23(3): 565—573]
[26] Wu Q Y, Zeng L Q, Fu S J. Effects of temperature acclimation on preferred swimming behavior in crucian carp(Carassius auratus) [J].Chinese Journal of Ecology,2016, 35(2): 441—445 [吴青怡, 曾令清, 付世建. 温度驯化对鲫偏好游泳行为的影响. 生态学杂志, 2016, 35(2):441—445]
[27] Li D, Lin X T, Zhu Z M,et al. Effects of flow rate on swimming states and activity metabolism in juvenile Hybrid Sturegeon [J].Acta Hydrobiologica Sinica, 2011,35(4): 578—585 [李丹, 林小涛, 朱志明, 等. 不同流速下杂交鲟幼鱼游泳状态与活动代谢研究. 水生生物学报,2011, 35(4): 578—585]
[28] Yan G J, He X K, Cao Z D,et al. An interspecific comparison between morphology and swimming performance in cyprinids [J].Journal of Evolutionary Biology, 2013,26(8): 1802—1815
[29] Facey D E, Grossman G D. The relationship between water velocity, energetic costs, and microhabitat use in four North American stream fishes [J].Hydrobiologia, 1992,239(1): 1—6
[30] Vowles A S, Kemp P S. Effects of light on the behaviour of brown trout (Salmo trutta) encountering accelerating flow: Application to downstream fish passage [J].Ecological Engineering, 2012, 47(1): 247—253
[31] Kemp P S, Gessel M H, Williams J G. Seaward migrating subyearling Chinook salmon avoid overhead cover[J].Journal of Fish Biology, 2005, 67(5): 1381—1391
[32] Kemp P S, Williams J G. Illumination influences the ability of migrating juvenile salmonids to pass a submerged experimental weir [J].Ecology of Freshwater Fish, 2009,18(2): 297—304
