乌司他丁对脓毒症大鼠胰腺外分泌功能的保护作用及机制研究
2018-05-16陆志峰
陆志峰, 赵 丽, 王 胜
(同济大学附属第十人民医院重症医学科,上海 200072)
脓毒症是烧伤、创伤、感染等临床危急重症患者的常见并发症,可导致多器官功能障碍(multiple organ dysfunction syndrome, MODS),影响患者预后[1]。因而脓毒症诱导MODS的机制是近年来脓毒症研究的主攻方向,心脏、肝脏和肺等重要脏器的损伤和功能衰竭则是关注的焦点[2]。其实,脓毒症也会导致胰腺外分泌功能障碍,且与预后密切相关,但发病机制尚不清楚[3]。线粒体损伤在脓毒症MODS发生发展过程中起着关键作用[4-5],而线粒体损伤又与细胞凋亡密切相关[6]。乌司他丁(ulinastatin,UTI)是从健康成年男性新鲜尿液中分离纯化出来的一种广谱蛋白酶抑制剂,广泛用于MODS、休克、胰腺炎等疾病[7]。本研究旨在观察急性脓毒症时大鼠胰腺外分泌功能受损时的细胞凋亡情况,并探讨乌司他丁是否能通过抑制细胞凋亡从而保护胰腺外分泌功能。
1 材料与方法
1.1 实验动物及主要试剂
清洁级SD大鼠30只,体质量(300±30) g,雄性,实验前禁食12h,自由饮水,购自同济大学附属第十人民医院中心实验室。脂多糖(LPS)购自美国Sigma公司,乌司他丁(UTI)购自广州天普生化医药股份有限公司;TNF-α检测试剂盒由欣博盛生物科技公司生产;兔抗B淋巴细胞瘤-2(Bcl-2)、Bcl相关X蛋白(Bax)、凋亡蛋白酶Caspase3、细胞色素C(CytC)购自武汉谷歌生物科技公司;TUNEL试剂盒购自美国罗氏公司。
1.2 动物实验
按随机数字表法分为对照组、LPS组和UTI组,每组各10只。腹腔内注射LPS 15mg/kg建立脓毒症模型,UTI组在腹腔内注射LPS后立即按照50000U/kg体质量注射UTI,模型组在腹腔内注射LPS后立即注射相同容量的生理盐水,对照组注射等量的生理盐水。
1.3 标本采集
12h后存活大鼠(LPS组死亡2只)用2%戊巴比妥50mg/kg腹腔注射麻醉,沿股静脉走向作长约2~3cm的切口。用止血钳小心分离肌肉及筋膜,清楚地暴露出股三角区,22G静脉穿刺针穿刺股静脉并留置。经该导管采集血标本,置入离心管中,4℃,离心半径10cm,4000r/min,离心10min,分离血清,-20℃冰箱保存,用于淀粉酶、脂肪酶及TNF-α等的检测。取血后断头处死大鼠,取中上腹部正中切口,迅速取下胰腺。一部分用于H-E染色,剩余部分液氮冷冻后-70℃保存,用于凋亡相关蛋白提取等检测。
1.4 血清淀粉酶、脂肪酶检测
使用全自动生化分析仪(日立全自动生化分析仪7180)检测血清淀粉酶、脂肪酶含量。
1.5 TNF-α检测
根据试剂盒说明书进行操作。用酶联免疫吸附法测定血清TNF-α含量。
1.6 胰腺组织病理学检测
取胰腺组织,常规固定、脱水、包埋、切片、H-E染色后光学显微镜下观察。每份标本切片5张,每张高倍镜行下连续观察5个视野,根据改良Schmidt评分标准[8]分别评分后计算各项的平均值及总评分。评分内容如下。(1) 水肿: 0分为无;1分为轻度叶间隙增宽;2分为重度叶间隙增宽;3分为腺泡间隙增宽;4分为细胞间隙增宽。(2) 炎性细胞浸润: 计数高倍视野下血管周围或小叶内白细胞数量,0~1个为0分;2~10个为1分;11~20个为2分;21~30个为3分;≥30个或出现微脓肿为4分。(3) 出血: 0分为无;1分为有。(4) 坏死: 0分为无;1分为坏死面积1%~10%;2分为坏死面积11%~20%;3分为坏死面积21%~30%;4分为坏死面积>30%。(1)、(2)、(3)及(4)之和为胰腺组织损伤病理积分。
1.7 TUNEL法计数凋亡细胞
使用TUNEL试剂盒检测胰腺细胞凋亡,制作石蜡切片,经脱蜡、水合,细胞通透,加TUNEL反应液,加converter-POD,与底物DAB反应显色后,在光学显微镜下计数。
1.8 蛋白质免疫印迹试验
胰腺组织块用冷PBS洗涤2~3次,加入10倍组织体积的组织裂解液,冰上彻底匀浆,将匀浆液转移至1.5mL离心管中,振荡。冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。离心半径10cm,10500r/min离心10min,收集上清液,即为总蛋白溶液。用BCA法测定蛋白浓度。蛋白上样,进行丙烯酰胺凝胶电泳,转膜,封闭,加入一抗4℃孵育过夜。次日,加二抗孵育后曝光。最后用显影、定影试剂进行显影和定影。将胶片进行扫描存档,PhotoShop整理去色,Alpha软件处理系统分析目标带的光密度值。
1.9 统计学处理
2 结 果
2.1 血清淀粉酶、脂肪酶和TNF-α含量
LPS组和UTI组淀粉酶、脂肪酶和TNF-α含量均显著高于对照组(P<0.01);UTI组淀粉酶、脂肪酶和TNF-α含量显著均低于LPS组(P<0.01),见表1。
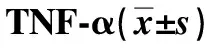
表1 血清淀粉酶、脂肪酶和TNF-α含量
与对照组相比,#P<0.01;与LPS组相比,*P<0.01
2.2 H-E染色结果
对照组大鼠胰腺小叶结构完整,小叶间隙致密,血管结构正常,胰岛结构完整;LPS组细胞间隙增宽、少许炎性细胞浸润伴少许出血;UTI组腺泡间隙增宽,见图1。改良Schmidt评分分别为0、5.13和3.70分,UTI组显著低于LPS组(P<0.01)。
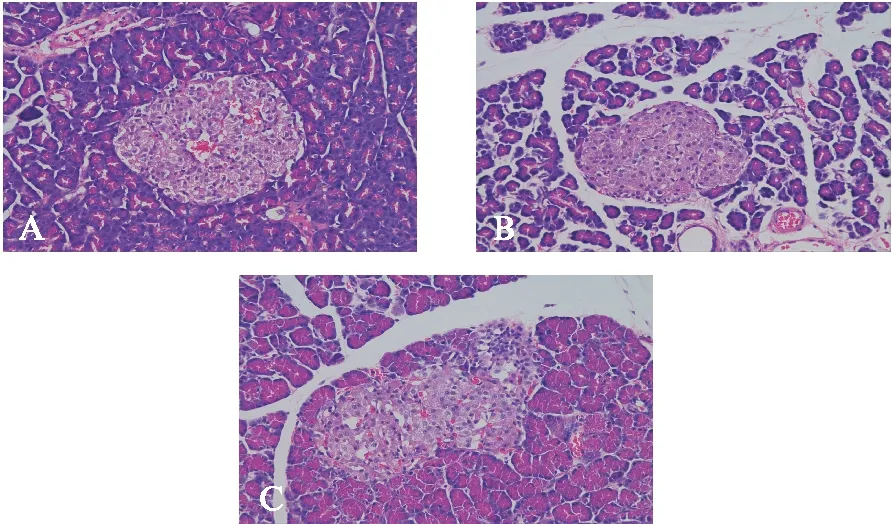
图1 大鼠胰腺组织光镜观察结果(H-E,×200)Fig.1 Pancreas tissues under light microscope(H-E,×200)A: 对照组;B: LPS组;C: UTI组
2.3 TUNEL计数凋亡细胞指数
对照组有少量凋亡细胞,LPS组凋亡指数显著高于对照组(P<0.01);UTI组凋亡指数显著低于LPS组(P<0.01),见图2。
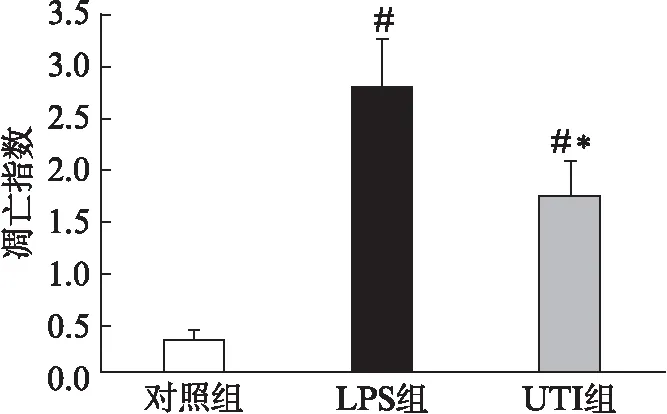
图2 大鼠胰腺细胞凋亡指数Fig.2 The apoptosis index of pancreatic cells与对照组相比,#P<0.01;与LPS组相比,*P<0.01
2.4 凋亡相关蛋白表达
与对照组相比,LPS组胰腺组织中促凋亡蛋白Bax、CytC、Caspase3表达显著增加,抑制凋亡蛋白Bcl-2则显著下降,而乌司他丁能对上述异常表达蛋白起到显著恢复作用,见图3。
3 讨 论
胰腺外分泌功能不全(pancreatic exocrine insufficience, PEI)是指各种原因引起的胰酶分泌不足、胰酶活性不足或者胰酶过早降解,从而导致患者出现消化吸收不良等症状[9-10],常见于原发胰腺疾病。但是现在也有许多证据表明在没有原发胰腺疾病的重症患者合并胰腺损伤和PEI的比例很高[11]。2003年Tribl等[12]研究发现脓毒症患者存在胰腺外分泌功能不全,其中脓毒症合并休克患者尤甚。最近的流行病学研究也发现,脓毒症患者合并胰腺外分泌功能不全的比例超过50%,约20%甚至被诊断为重度胰腺外分泌功能不全[13]。本研究通过动物实验发现脓毒症大鼠的血清淀粉酶、脂肪酶明显升高,证实了脓毒症中存在胰腺功能损伤。但目前,脓毒症中胰腺功能损伤的发病机制尚未完全阐明[14]。有研究[15]表明,细胞凋亡是脓毒症时重要的病理变化之一。
本研究发现LPS组血清TNF-α水平显著升高,而TNF-α可诱导胰腺腺泡细胞凋亡[16],腺泡细胞凋亡后又可正反馈地促进TNF-α等炎症介质的合成与释放[17],从而触发炎症介质瀑布样级联反应。清除TNF-α则可以减轻胰腺组织的炎性损伤[18],与本研究UTI组结果一致。
Bcl-2家族在细胞凋亡的线粒体途径中起着重要作用,既有促进凋亡作用,也有抗凋亡的作用[19]。Bax是线粒体途径上促进急性胰腺炎时腺泡细胞凋亡的重要调控基因[20],可以增加线粒体膜通透性,促进细胞色素C(CytC)的释放,形成凋亡诱导复合物,作用于凋亡效应因子导致细胞凋亡。相反,Bcl-2是主要的抗凋亡因子,与BH3结构域形成异二聚体,维持促凋亡蛋白在细胞内的定位分布,保护细胞不进入凋亡程序,而且Bcl-2还能抑制CytC的释放,使CytC无法达到激活下游天冬氨酸特异性半胱氨酸蛋白酶(Caspases)的阀值,保护细胞不发生凋亡[19]。Caspases家族是一类与细胞凋亡密切相关的蛋白水解酶家族,Caspases激活后可以酶切底物天冬氨酸羧基端从而促进细胞凋亡发生。迄今为止已知有14种Caspases,其中Caspase 3是细胞凋亡主要的执行者之一[21]。CytC是呼吸链中重要的电子传递体,它是第一种被发现的线粒体释放的促凋亡蛋白[22],当线粒体损伤后,CytC穿过Bax孔隙移位到细胞质[23],与Apafl及dATP组装成凋亡小体[24],激活下游的Caspase 9,活化的Caspase 9进一步激活Caspase 3,引起Caspases级联激活反应。本研究发现LPS组凋亡细胞指数增高,促凋亡蛋白Bax、CytC、Caspase 3表达增加,抑制凋亡蛋白Bcl-2表达下降,伴血淀粉酶明显升高、胰腺组织病理损伤加重,提示细胞凋亡参与脓毒症胰腺外分泌功能损伤。而在UTI组上述异常指标可见显著逆转,提示发生脓毒症时乌司他丁可以抑制细胞凋亡,减轻胰腺损伤。乌司他丁可同时抑制多种蛋白酶,已证实其有强大的抗炎症介质、抗氧自由基作用,可减轻炎症反应、抑制凋亡等[25-26]。
综上,本研究认为LPS诱导的脓毒症大鼠存在胰腺外分泌功能损伤;乌司他丁可以保护脓毒症大鼠胰腺外分泌功能,抑制脓毒症时的细胞凋亡可能为其保护机制之一。
【参考文献】
[1] 邵换璋,王存真,朱文亮,等.辛伐他汀对脓毒症和严重脓毒症患者外周血单核细胞Toll样受体4的影响[J].中华危重病急救医学,2016,28(2): 159-163.
[2] JEGER V, DJAFARZADEH S, JAKOB S M, et al. Mitochondrial function in sepsis[J]. Eur J Clin Invest, 2013,43(5): 532-542.
[3] 陈胜利,黄锦达,曾其毅,等.自噬和线粒体辅酶Q对急性脓毒症大鼠胰腺外分泌功能的影响[J].中华危重病急救医学,2015,27(2): 86-91.
[4] 陶珮,尹海燕,马永辉.姜黄素对脓毒症大鼠肝细胞线粒体膜通透性转换的作用机制研究[J].中华危重病急救医学,2014,26(9): 666-670.
[5] SINGER M. The role of mitochondrial dysfunction in sepsis-induced multi-organ failure[J]. Virulence, 2014,5(1): 66-72.
[6] 李宁,张琪.脓毒症线粒体损伤研究进展[J].中华临床医师杂志(电子版),2014,8(19): 3525-3530.
[7] ATAL S S, ATAL S. Ulinastatin-a newer potential therapeutic option for multiple organ dysfunction syndrome[J]. J Basic Clin Physiol Pharmacol, 2015,27(2): 91-99.
[8] SCHMIDT J, LEWANDROWSKI K, FERNANDEZ-DEL CASTILLO C, et al. Histopathologic correlates of serum amylase activity in acute experimental pancreatitis[J]. Dig Dis Sci, 1992,37(9): 1426-1433.
[9] VUJASINOVIC M, VALENTE R, DEL CHIARO M, et al. Pancreatic exocrine insufficiency in pancreatic cancer[J]. Nutrients, 2017,9(3): 183.
[10] LÖHR J M, OLIVER M R, FRULLONI L. Synopsis of recent guidelines on pancreatic exocrine insufficiency[J].United Eur Gastroenterol J, 2013,1(2): 79-83.
[11] 马利杰,王胜.重症患者胰腺外分泌功能不全的研究进展[J].中华临床医师杂志(电子版),2014,8(2): 265-269.
[12] TRIBL B, SIBBALD W J, VOGELSANG H, et al. Exocrine pancreatic dysfunction in sepsis[J]. Eur J Clin Invest, 2003,33(3): 239-243.
[13] WANG S, MA L J, ZHUANG Y G, et al. Screening and risk factors of exocrine pancreatic insufficiency in critically ill adult patients receiving enteral nutrition[J]. Crit Care, 2013,17(4): R171.
[14] 胡限,祝益民.脓毒症胰腺损害的机制研究进展[J].中华急诊医学杂志,2013,22(6): 680-683.
[15] CINEL I, DELLINGER R P. Advances in pathogenesis and management of sepsis[J]. Curr Opin Infect Dis, 2007,20(4): 345-352.
[16] SENDLER M, DUMMER A, WEISS F U, et al. Tumour necrosis factor α secretion induces protease activation and acinar cell necrosis in acute experimental pancreatitis in mice[J]. Gut, 2013,62(3): 430-439.
[17] HOQUE R, MALIK A F, GORELICK F, et al. Sterile inflammatory response in acute pancreatitis[J]. Pancreas, 2012,41(3): 353-357.
[18] PERIDES G, WEISS E R, MICHAEL E S, et al. TNF-alpha-dependent regulation of acute pancreatitis severity by Ly-6C(hi) monocytes in mice[J]. J Biol Chem, 2011,286(15): 13327-13335.
[19] 吉木斯,李存保.Bcl-2家族在线粒体细胞凋亡途径中的作用[J].内蒙古医科大学学报,2013,35(2): 152-157.
[20] 陈海龙,张桂信,宫爱霞,等.大鼠急性胰腺炎时胰腺腺泡细胞凋亡及Bax,Caspase-8的表达[J].世界华人消化杂志,2007,15(10): 1067-1072.
[21] TIBBETTS M D, ZHENG L, LENARDO M J. The death effector domain protein family: regulators of cellular homeostasis[J]. Nat Immunol, 2003,4(5): 404-409.
[22] 陈胜,彭沪,庄育刚,等.盐酸法舒地尔对脑缺血再灌注损伤大鼠神经细胞凋亡和细胞色素C释放的影响[J].同济大学学报(医学版),2012,33(6): 36-40.
[23] WALENSKY L D, GAVATHIOTIS E. BAX unleashed: the biochemical transformation of an inactive cytosolie monomer into a toxic mitochondrial pore[J]. Trends Biochem Sci, 2011,36(12): 642-652.
[24] LINDSAY J, ESPOSTI M D, GILMORE A P. Bcl-2 proteins and mitochondria-specificity in membrane targeting for death[J]. Biochim Biophys Acta, 2011,1813(4): 532-539.
[25] 樊楚明,杨欣悦,任靖宇,等.乌司他丁对脓毒症大鼠血管内皮细胞损伤保护作用及机制研究[J].中国临床药理学杂志,2016,32(8): 723-726.
[26] TAO Z, HU F Q, LI C F, et al. Effect of ulinastatin, a human urinary protease inhibitor, on heat stroke-induced apoptosis and inflammatory responses in rats[J]. Exp Ther Med, 2017,13(1): 335-341.
