妊娠期糖尿病胎盘基因表达变化及功能分析
2018-05-16倪晓田黄小杰
倪晓田, 黄小杰, 王 凯, 周 健
(1. 同济大学附属第一妇婴保健院产科,上海 201204; 2. 同济大学附属第一妇婴保健院转化中心实验室,上海 201204)
妊娠期糖尿病(gestational diabetes mellitus, GDM)是全球范围内高发的妊娠期特有的代谢性疾病,国外报道其发病率在5.8%~9.5%,而且近年有持续升高的趋势[1-3]。GDM对母儿健康均有影响,近期影响包括增加巨大儿、肩难产的发生率、剖宫产率[4]以及胎儿肺部成熟延迟[5],远期影响有增加母亲未来发生Ⅱ型糖尿病[6-8]和心血管疾病[7-8]的机会,增加后代发生心血管疾病[9]、呼吸窘迫综合征[5]和神经心理疾病[10]的风险。
胎盘是孕期连接母体和胎儿的主要器官,是研究妊娠相关疾病的一个重要窗口。GDM对胎盘的发育和功能都有不良影响。研究表明GDM可以使胎盘重量增加[11],胰岛素信号通路缺陷[12],使胎盘血管内皮生长因子A和血管内皮生长因子受体2表达下降,使终末绒毛血管生成发生退行性变化[13]。已有研究报道GDM改变部分胎盘基因表达[14-16],但所报道的差异表达基因(DEGs)不同。本研究选择单纯饮食和运动治疗的GDM病例,检测单纯饮食和运动治疗的GDM胎盘基因表达及功能变化,有助于进一步理解妊娠期糖尿病胎盘的基因表达及功能变化。
1 资料与方法
1.1 一般资料
选择2016年3月至2016年4月在同济大学附属第一妇婴保健院建卡产检并在38~40周接受选择性剖宫产分娩的孕妇共6例,其中正常组孕妇3例,GDM组3例。GDM诊断采用IADPSGC诊断标准,即75g口服葡萄糖实验空腹血糖≥5.1mmol/L或1h血糖≥10.0mmol/L或2h血糖≥8.5mmol/L诊断为GDM,选择经饮食和运动治疗血糖控制理想者。研究对象既往健康,排除妊娠合并其他疾病如哮喘、高血压、子痫前期及妊娠前患糖尿病等。本研究符合赫尔辛基宣言所规定的以人类为研究对象的研究标准,通过了同济大学附属第一妇婴保健院伦理委员会的审批。受试者获得知情同意并签署了知情同意书。6例受试者的临床参数详见表1。

表1 用于芯片分析的标本临床参数
与对照组相比,*P<0.05
1.2 实验试剂
TRIzol试剂购自美国Life Technologies公司;RNeasy mini试剂盒及RNase-Free DNase Set购自德国QIAGEN公司;单色低输入快速放大标记试剂盒、基因表达杂交试剂盒、杂交炉、基因表达洗涤液试剂盒、芯片扫描仪及Feature Extraction 10.7软件购自美国安捷伦科技有限公司;芯片着色盘购自美国Thermo Shandon公司;Moloney鼠白血病病毒反转录酶购自美国Promega公司;SYBR®Green反应混合物购自日本ToYoBo公司。
1.3 方法
1.3.1 RNA提取 采用TRIzol方法提取胎盘组织总RNA,分别采用分光光度法(Nanodrop)和凝胶电泳法检测RNA纯度和完整性。分离的RNA贮存于-80℃备用。总RNA用RNeasy mini试剂盒和RNase-Free DNase Set进行纯化后用作芯片分析。
1.3.2 芯片杂交和数据分析 总RNA标本提取方法如上,用单色低输入快速放大标记试剂盒扩增mRNA并进行标记。用RNeasy mini试剂盒将cRNA进行纯化。cRNA上样量为1.65μg,使用基因表达杂交试剂盒,将芯片置于65℃杂交炉10r/min,持续17h。然后将芯片放入着色盘中,用基因表达洗涤液试剂盒进行洗涤。杂交的芯片用Agilent芯片扫描仪进行扫描,用Feature Extraction 10.7软件进行定量分析,并采用Quantile方法将数据进行处理。
1.3.3 反转录定量PCR(RT-qPCR) 采用TRIzol方法提取胎盘组织总RNA。测定RNA浓度后,用Moloney鼠白血病病毒反转录酶及长度为12~18 nt的寡核苷酸(Oligo dT)将mRNA反转为cDNA,用RT-qPCR方法及SYBR®Green反应混合物对SLC16A1、ATP2C2、KCNJ2、ABCA6、IGFL2、BDKRB2、FGF12、SGK2基因进行定量分析。熔解温度设为61℃。每个标本中mRNA绝对数量都根据循环数对应的标准曲线计算。为了控制取样误差,每个样本都检测保守基因β-actin,用目的基因比β-actin得到的值代表目的基因的表达量。用熔解曲线及PCR产物凝胶电泳检测引物的特异性。扩增以上基因所用的引物序列详见表2。

表2 用于RT-qPCR的引物序列
1.3.4 DEGs的GO、KEGG分析 DEGs分析所使用的数据来自于FunNet 1.00-12软件。FunNet是一种基于芯片表达数据库用于分析基因相互关系的可靠的系统工具[17-18]。本实验使用的FunNet 1.00-12软件更新时间是2011年5月20日。
1.4 统计学处理

2 结 果
2.1 GDM胎盘DEGs的分层聚类研究
该研究使用的基因芯片包括41000种基因,其中1773种(4.3%)基因两组间的表达差异有统计学意义。627种基因上调表达,1146种基因下调表达,热图详见图1。去除非特指的基因,本研究列出20个上调表达且倍数(fold change, FC)≥2的基因(表3)和26个下调表达且FC≤0.5的基因(表4)。

图1 正常和GDM胎盘基因芯片热图Fig.1 Heatmap of normal and GDM placental gene chipsA1、A2、A3为GDM胎盘组织,B1、B2、B3为正常胎盘组织,将6例胎盘组织分别用6张芯片(Agilent GeneChips, 4×44K transcripts)进行检测。热图显示与正常胎盘相比,GDM胎盘中627个基因表达显著上升(P<0.05,红色),1146个基因表达显著下降(P<0.05,绿色)
2.2 RT-qPCR方法验证基因芯片的部分结果
采用RT-qPCR方法对基因芯片结果进行验证,验证的8个基因包括: 溶质载体家族16成员1(SLC16A1)、ATP酶分泌途径Ca2+转运2(ATP2C2)、钾离子通道亚家族成员2(KCNJ2)、ATP结合盒亚家族成员6(ABCA6)、胰岛素样生长因子家族成员2(IGFL2),缓激肽B2受体(BDKRB2)、成纤维细胞生长因子12(FGF12)、丝氨酸/苏氨酸激酶2(SGK2)。以上8个基因用芯片和RT-qPCR这2种方法检测,GDM组和正常组的比值见图2。

表3 GDM胎盘组织水平表达上调的基因

表4 GDM胎盘组织水平表达下调的基因
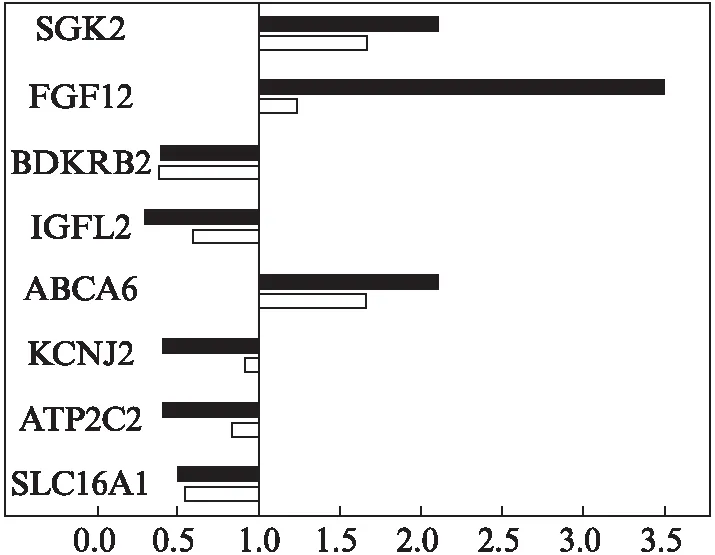
图2 RT-qPCR方法验证芯片部分结果Fig.2 RT-qPCR verification for gene chips黑色柱代表芯片筛查结果,白色柱代表RT-qPCR结果;横坐标代表GDM胎盘基因表达与正常胎盘的比值
2.3 GO、KEGG对DEGs的分析
将DEGs经GO聚类从生物学过程、细胞成分和分子功能三方面进行功能分析,结果显示: 在生物学过程方面,差异基因中38.8%与基于DNA的转录调节有关,10.5%与蛋白磷酸化有关,9.5%与基因表达有关;在细胞成分方面,大部分差异基因位于细胞核(51.1%)和细胞质(44%)。分子功能分析大部分基因涉及蛋白结合(51.8%)、金属离子结合(33.3%)、锌离子结合(24.4%)和DNA结合(23.7%)。DEGs在生物学过程、分子功能和细胞成分三方面的功能分布见图3。差异基因相关的信号通路,位于前3位的分别是Wnt、Spliceosome和TGF-β信号通路,见图4。

图3 GO对DEGs的功能分析结果Fig.3 Functional analysis of DEGs by GOA: DEGs相关的生化过程分析;B: DEGs相关的细胞成分分析;C: DEGs相关的分子功能分析

图4 KEGG对DEGs相关信号传导通路的分析结果Fig.4 Analysis of DEGs related signal transduction pathway by KEGG
3 讨 论
GDM虽然是一种妊娠期特有的疾病,但对母亲和胎儿均有不良影响。随着GDM发病率的上升,研究GDM发病机制的必要性越来越迫切。临床根据是否需要药物治疗将GDM分为A1型(即饮食控制的GDM)和A2型(即需要药物治疗的GDM)。胎盘作为孕期连接母体和胎儿的重要器官,与GDM的发生机制相关,同时其结构及功能也受该疾病的影响。既往只有少数研究采用基因芯片方法研究GDM胎盘基因表达变化。Radaelli等[14]发现GDM组16.2%的基因表达发生显著性变化,并且发现炎症标记物和炎症介质的表达显著增加。Enquobahrie等[15]却发现只有10.9%的基因表达发生变化,且只有部分基因的表达变化与Radaelli等结果一致。本实验选择A1型GDM病例,3例GDM通过饮食控制,空腹血糖均控制在5.3mmol/L以下,餐后2h血糖维持在6.7mmol/L。孕期产检尿常规提示+~++,尿酮体均为阴性。新生儿出生后常规给予口服少量葡萄糖水预防低血糖,新生儿均无低血糖表现。虽然孕妇通过饮食控制血糖在正常范围,但通过检测胎盘41000个基因的表达发现,1773个(4.3%)基因存在差异表达,进一步用RT-qPCR方法验证8个基因的表达情况,其中5个基因的表达与芯片结果相符合(SGK2、BDKRB2、IGFL2、ABCA6、SLC16A1),符合率达60%。考虑基因芯片筛查和RT-qPCR两种不同的检查方法具有较高的符合率,因此认为基因芯片的筛查结果具有很好的参考价值。进一步分析实验结果缺乏重叠性的原因发现,Radaelli等[14]选取的GDM病例均为A2型,Enquobahrie等[15]选择的病例包括A1型和A2型,而本实验选取的病例则均为A1型,从而推测A1型和A2型GDM对胎盘基因表达影响程度不同。
本研究利用基因GO平台对差异表达基因进行了生物过程、分子功能和细胞成分三方面分析。差异基因涉及的生物过程包括: 以DNA为基础的转录调节过程、蛋白磷酸化、基因表达、细胞周期等。最引人瞩目的是以DNA为基础的转录调节过程中涉及到多达75种锌指蛋白,而且多表达于细胞核,在蛋白金属离子结合、锌离子结合和DNA结合等分子功能方面起着重要作用。锌指蛋白可以结合DNA、RNA、脂质、蛋白质和小分子,在多种生理过程中发挥重要作用[19]。近期有研究开始关注锌指蛋白在生殖系统方面发挥的作用[20-21],但未发现有对GDM胎盘锌指蛋白表达变化的报道。GDM对锌指蛋白的影响及对胎盘功能的负面影响值得进一步研究。MICA和MICB在GDM胎盘中的表达显著增加,二者参与胎盘多种生物过程,包括热反应、细胞溶解、抗原加工提呈、gamma-delta T细胞活化等,其表达与胎儿-母体免疫识别相关[22],二者表达增加可能对母体对胎盘的免疫耐受不利。芯片结果提示多种与胎盘能量代谢及离子代谢相关的基因下调表达,如KCNJ2、ATP2C2、SLC16A1等,其中KCNJ2和SLC16A1在胎盘大量表达,KCNJ2主要参与调节钾离子代谢,SLC16A1主要与单碳化合物如乳酸、丙酮酸代谢相关,其表达量的变化可能直接影响胎儿宫内营养素的改变。
另外,本研究用基因KEGG数据库分析了变化基因相关的信号通路。在存在差异的信号通路中Wnt信号通路居于首位。目前所知,本实验是首次报道Wnt信号通路在妊娠期糖尿病中的变化。Wnt是一种分泌性糖蛋白受体,在调节很多生物过程中起重要作用,这些生物过程包括胚胎发育,细胞结局、增殖、迁移,干细胞维持,肿瘤细胞抑制,肿瘤生成和组织平衡[23]。研究报道Wnt配体复合物可能在人类胎盘发育过程中发挥重要作用[24]。Wnt信号通路还在胎盘滋养层细胞的功能异常[25]、滋养层细胞种植、蜕膜化和胎盘分化[26]中起关键作用。妊娠期糖尿病中Wnt信号通路的作用和机制需要进一步研究。KEGG分析还提示DEGs参与剪接体、TGF-β信号通路、ErbB信号通路等,但以上结果限于基因芯片筛查结果,需进一步实验验证。
综上所述,GDM胎盘部分基因表达及功能发生变化,这些变化可能导致胎盘功能发生变化,从而影响胎儿与胎盘之间的对话。GDM胎盘部分基因表达变化涉及多种生物学过程、分子功能及信号通路,但具体胎盘基因表达对功能及信号通路的影响需进一步实验研究。研究GDM胎盘基因表达及功能变化有助于充分理解GDM疾病并指导临床诊疗。
【参考文献】
[1] LAVERY J A, FRIEDMAN A M, KEYES K M, et al. Gestational diabetes in the United States: temporal changes in prevalence rates between 1979 and 2010[J]. BJOG, 2017,124(5): 804-813.
[2] TAMAYO T, TAMAYO M, RATHMANN W, et al. Prevalence of gestational diabetes and risk of complications before and after initiation of a general systematic two-step screening strategy in Germany(2012—2014)[J]. Diabetes Res Clin Pract, 2016,115: 1-8.
[3] KOO B K, LEE J H, KIM J, et al. Prevalence of gestational diabetes mellitus in Korea: a national health Insurance Database Study[J]. PLoS One, 2016,11(4): e0153107.
[4] FARRAR D, SIMMONDS M, BRYANT M, et al. Hyperglycaemia and risk of adverse perinatal outcomes: systematic review and meta-analysis[J]. BMJ, 2016,354: i4694.
[5] AZAD M B, MOYCE B L, GUILLEMETTE L, et al. Diabetes in pregnancy and lung health in offspring: developmental origins of respiratory disease[J]. Paediatr Respir Rev, 2017,21: 19-26.
[6] KIM C, NEWTON K M, KNOPP R H. Gestational diabetes and the incidence of type 2 diabetes: a systematic review[J]. Diabetes Care, 2002,25(10): 1862-1868.
[7] SATTAR N, GREER I A. Pregnancy complications and maternal cardiovascular risk: opportunities for intervention and screening?[J]. BMJ, 2002,325(7356): 157-160.
[8] HOPMANS T E, VAN HOUTEN C, KASIUS A, et al. Increased risk of type Ⅱ diabetes mellitus and cardiovascular disease after gestational diabetes mellitus: a systematic review[J]. Ned Tijdschr Geneeskd, 2015,159: A8043.
[9] EHRLICH S F, ROSAS L G, FERRARA A, et al. Pregnancy glucose levels in women without diabetes or gestational diabetes and childhood cardiometabolic risk at 7 years of age[J]. J Pediatr, 2012,161(6): 1016-1021.
[10] NAHUM SACKS K, FRIGER M, SHOHAM-VARDI I, et al. Prenatal exposure to gestational diabetes mellitus as an independent risk factor for long-term neuropsychiatric morbidity of the offspring[J]. Am J Obstet Gynecol, 2016, 215(3): 380.
[11] MCNAMARA H, HUTCHEON J A, PLATT R W, et al. Risk factors for high and low placental weight[J]. Paediatr Perinat Epidemiol, 2014,28(2): 97-105.
[12] COLOMIERE M, PERMEZEL M, RILEY C, et al. Defective insulin signaling in placenta from pregnancies complicated by gestational diabetes mellitus[J]. Eur J Endocrinol, 2009,160(4): 567-578.
[13] MENG Q, SHAO L, LUO X, et al. Expressions of VEGF-A and VEGFR-2 in placentae from GDM pregnancies[J]. Reprod Biol Endocrinol, 2016,14(1): 61.
[14] RADAELLI T, VARASTEHPOUR A, CATALANO P, et al. Gestational diabetes induces placental genes for chronic stress and inflammatory pathways[J]. Diabetes, 2003,52(12): 2951-2958.
[15] ENQUOBAHRIE D A, WILLIAMS M A, QIU C, et al. Global placental gene expression in gestational diabetes mellitus[J]. Am J Obstet Gynecol, 2009,200(2): 206.
[16] ZHAO Y H, WANG D P, ZHANG L L, et al. Genomic expression profiles of blood and placenta reveal significant immune-related pathways and categories in Chinese women with gestational diabetes mellitus[J]. Diabet Med, 2011,28(2): 237-246.
[17] PRIFTI E, ZUCKER J D, CLEMENT K, et al. FunNet: an integrative tool for exploring transcriptional interactions[J]. Bioinformatics, 2008,24(22): 2636-2638.
[18] HENEGAR C, TORDJMAN J, ACHARD V, et al. Adipose tissue transcriptomic signature highlights the pathological relevance of extracellular matrix in human obesity[J]. Genome Biol, 2008,9(1): R14.
[19] LAITY J H, LEE B M, WRIGHT P E. Zinc finger proteins: new insights into structural and functional diversity[J]. Curr Opin Struct Biol, 2001,11(1): 39-46.
[20] STUMPO D J, TREMPUS C S, TUCKER C J, et al. Deficiency of the placenta- and yolk sac-specific tristetraprolin family member ZFP36L3 identifies likely mRNA targets and an unexpected link to placental iron metabolism[J]. Development, 2016,143(8): 1424-1433.
[21] KOMMAGANI R, SZWARC M M, VASQUEZ Y M, et al. The promyelocytic leukemia zinc finger transcription factor is critical for human endometrial stromal cell decidualization[J]. PLoS Genet, 2016,12(4): e1005937.
[22] TILBURGS T, SCHERJON S A, CLAAS F H. Major histocompatibility complex (MHC)-mediated immune regulation of decidual leukocytes at the fetal-maternal interface[J]. J Reprod Immunol, 2010,85(1): 58-62.
[23] NAYEEM S B, ARFUSO F, DHARMARAJAN A, et al. Role of Wnt signalling in early pregnancy[J]. Reprod Fertil Dev, 2016,28(5): 525-44.
[24] SONDEREGGER S, HUSSLEIN H, LEISSER C, et al. Complex expression pattern of Wnt ligands and frizzled receptors in human placenta and its trophoblast subtypes[J]. Placenta, 2007,28(Suppl A): S97-102.
[25] KNÖFLER M, POLLHEIMER J. Human placental trophoblast invasion and differentiation: a particular focus on Wnt signaling[J]. Front Genet, 2013,4: 190.
[26] SONDEREGGER S, POLLHEIMER J, KNÖFLER M. Wnt signalling in implantation, decidualisation and placental differentiation-review[J]. Placenta, 2010,31(10): 839-847.
