益赛普联合甲氨蝶呤治疗中重度斑块型银屑病的有效性和安全性
2018-05-16张玲玲史玉玲
张玲玲, 龚 瑜, 于 倩, 王 瑶, 史玉玲
(同济大学附属第十人民医院皮肤科,上海 200072)
银屑病(psoriasis)是一种常见的慢性复发性炎症性皮肤病,是多基因遗传背景下由T细胞介导的疾病[1,2]。我国流行病学研究显示患病率为0.47%[3]。银屑病的系统用药包括: 甲氨蝶呤(methotrexate, MTX)、维甲酸类药物、环孢素、生物制剂等。大量临床试验证实生物制剂在中重度银屑病的治疗中疗效显著,为其他系统用药疗效不佳及副作用较大的患者带来了希望。生物制剂可使中重度银屑病患者病情得到较快缓解和控制,并减缓疾病的进展。
益赛普是一种肿瘤坏死因子α(TNF-α)阻断剂,对中重度斑块型银屑病有明确疗效,但随着使用次数和总量的增加,大部分患者出现疗效降低的现象。近几年来,益赛普联合免疫抑制剂甲氨蝶呤治疗中重度银屑病在临床上开始被应用,收到了较好的疗效。本课题研究益赛普联合MTX治疗中重度斑块型银屑病的有效性和安全性。
1 资料与方法
1.1 一般资料
所有病例均来自于2015年2月至2016年2月同济大学附属第十人民医院皮肤科门诊就诊的中重度斑块型银屑病患者。共纳入30例患者,其中男性20例,女性10例。平均年龄(51.93±14.72)岁,平均病程(19.40±10.27)年。
纳入标准: (1) 年龄≥18岁,男女不限;(2) 理解本研究步骤和内容,并自愿签署知情同意书表示同意参加本研究;(3) 符合中重度斑块型银屑病的诊断标准;(4) 病程稳定≥6个月;(5) 皮损严重度。体表受累面积(body surface area, BSA)≥10%且银屑病面积和严重程度指数(psoriasis area and severity index, PASI)评分≥10;(6) 接受过至少一种系统性手段的规范治疗(除MTX)或光疗(NB-UVB)而疗效不佳,且研究者认为患者适合接受其他系统性治疗;(7) 均同意在研究期间及研究结束后的6个月内避孕;(8) 体质量指数(body mass index, BMI)≤30kg/m2;(9) 患者可以按期随访。
排除标准: (1) 对益赛普及其成分过敏;(2) 患有其他可能干扰病情评估的皮肤病;(3) 活动性结核病史;(4) HBV表面抗原阳性,或抗丙肝抗体阳性;(5) 实验室检查异常,如血小板小于正常值下限,肝肾功能异常;(6) 基线前28d内接受过包括MTX在内的系统性药物(维甲酸类、环孢素、糖皮质激素、环磷酰胺等)治疗。本研究经同济大学附属第十人民医院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 用药方法 联合用药组: 益赛普50mg,皮下注射,1次/周;MTX 7.5mg口服,1次/周(第1~2周);10mg口服,1次/周(第3~4周);12.5mg口服,1次/周(第5~6周);15mg口服,1次/周(第7~24周)。联合用药组在距离服用MTX 24h后口服5mg叶酸片。单药组: 益赛普50mg,皮下注射,1次/周。
1.2.2 观察指标 在第2、6、12、18、24周分别进行PASI评分同时统计达到PASI 50、PASI 75、PASI 90患者的比例。记录医生对病情的总体评价(physician’s global assessment, PGA)、患者对病情的总体评价(patient’s global assessment, PtGA)和皮肤病生活质量指数(dermatology life quality index, DLQI)评分。
在第2、6、12、18、24周检查血、尿常规,肝肾功能,血沉和C反应蛋白;第24周治疗结束时检查胸片和心电图评价患者不良反应(adverse event, AE)如感染、结核、肿瘤、头痛、肝功能异常等的发生情况。
1.3 统计学处理

2 结 果
2.1 一般资料比较
30例患者入组,男20例,女10例。年龄25~73岁,平均(51.93±14.72)岁,病程3.8~60.9年,平均病程(19.40±10.27)年,PASI评分为(29.64±8.95)分。30例患者随机分为2组,联合用药组15例,其中男9例,女6例,平均(54.28±12.32)岁,平均病程(18.58±11.42)年;单药组15例,其中男11例,女4例,平均(49.58±16.02)岁,平均病程(20.22±8.63)年。两组之间性别、年龄、病程等差异无统计学意义(P>0.05),具有可比性。
2.2 PASI评分
单药组和联合用药组治疗前PASI评分分别为(30.31±9.32)、(28.97±7.09)分,差异无统计学意义(P>0.05)。联合用药组PASI评分平均值2、6、12、18、24周均低于单药组,其中12、18、24周时两组对比差异有统计学意义,见表1。
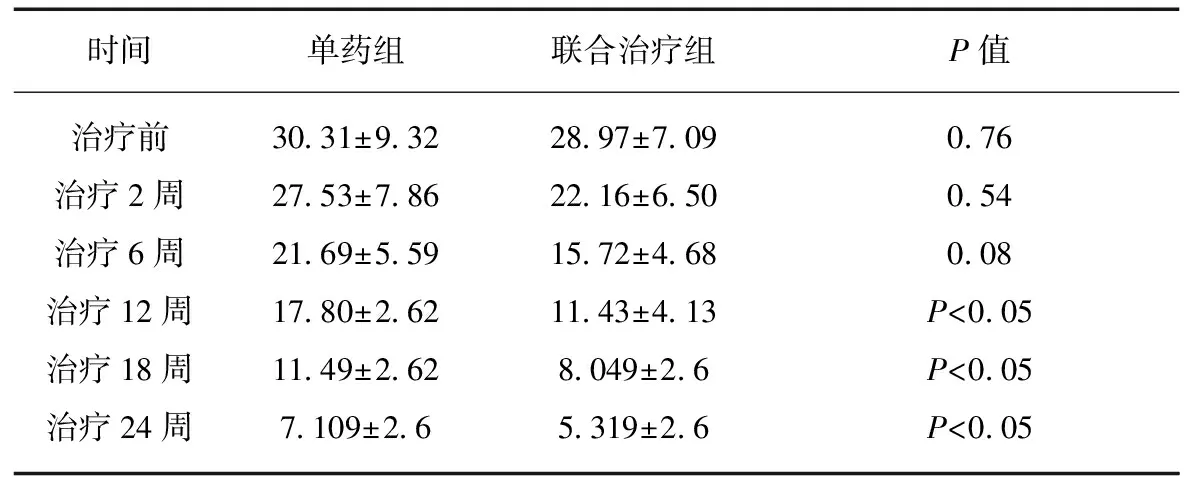
表1 患者各期PASI评分平均值
2.3 PASI 50,PASI 75,PASI 90
单药组在治疗2、6、12、18、24周PASI评分下降50%的患者比例(PASI 50)分别为0%、40.0%、60%、66.7%,86.7%。联合用药组在对应时期的PASI 50分别为26.7%、66.7%、80%、86.7%、93.3%。相同时期联合用药组达到PASI 50应答的比例均高于单药组,但差异无统计学意义(P>0.05)。同时,24周治疗结束后,联合用药组93.3%的患者达到PASI 50。
单药组在治疗2、6、12、18、24周PASI评分下降75%的患者比例(PASI 75)分别为0%、20.0%、46.7%、60.0%、66.7%。联合用药组在对应时期的PASI 75分别为26.7%、46.7%、66.7%、73.3%、80.0%。相同时期联合用药组达到PASI 75应答的比例均高于单药组,但差异无统计学意义(P>0.05)。
单药组在治疗2、6、12、18、24周达到PASI 90的比例(PASI 90)分别为0%、0%、26.7%、33.3%、40.0%。联合用药组在相同时期达到PASI 90的比例分别为0%、40%、33.3%、46.7%、60%。12、18、24周联合组PASI 90的应答率高于单药组,但差异无统计学意义(P>0.05),见表2。

表2 达到PASI 50,PASI 75,PASI 90应答的患者比例
2.4 PGA、PtGA、DLQI评分
治疗前PGA评分单药组为(5.42±0.49)分,联合用药组为(5.10±0.33)分。12、18、24周联合用药组PGA评分低于单药组,差异有统计学意义(P<0.05)。
治疗前PtGA评分单药组为(7.96±1.25)分,联合用药组为(7.85±0.90)分。6、12、18、24周联合用药组PGA评分低于单药组,差异有统计学意义(P<0.05)。
治疗前DLQI评分单药组为(17.14±3.48)分,联合治疗组为(15.71±2.1)分,两组差异无统计学意义。第6、12、18、24周联合用药组DLQI值低于单药组,差异有统计学意义(P<0.05),见表3。

表3 患者各期PGA,PtGA,DLQI评分平均值
2.5 安全性比较
在治疗期间AE发生率为46.7%(14例),单药组33.3%,联合用药组60%,差异无统计学意义(P>0.05)。无患者因不良反应退出。大多数AE为轻中度,治疗期间,无严重感染及肿瘤的发生。
联合治疗组5例患者发生转氨酶的轻度升高(升高均未超过标准值上限的1.5倍,未达到严重AE);1例尿蛋白异常;1例尿糖异常;1例发热,对症处理后好转;1例失眠。单药组1例尿糖异常;1例发热,白细胞升高,对症处理后好转;眩晕,嗜睡,失眠各1例。
3 讨 论
生物制剂通过阻断银屑病发病机制中的关键因子,干扰疾病的进展,使中重度银屑病患者病情得到较快缓解。不同的生物制剂PASI 75的应答率不同,部分使用生物制剂的患者在最初的一段时间疗效显著,但是随着使用时间的延长,疗效逐渐减弱,无法维持令患者满意的疗效。这可能和生物制剂抗药物抗体的产生有关[4]。为了增加疗效,临床上开始使用生物制剂联合免疫抑制剂的治疗策略[5]。
益赛普主要成分为依那西普,能与可溶性的TNF-α、TNF-β结合并使之丧失生物活性,是在我国第1个上市的TNF阻断剂。益赛普单独使用治疗银屑病具有良好的疗效。治疗12周患者PASI 75应答率达58.8%。不良反应发生率低,程度轻[6]。但随着使用时间的延长,疗效逐渐减弱。有研究[7]表明其原因与抗药物抗体产生有关。Hsu等[8]的研究显示: 7969例使用生物制剂的银屑病患者中抗药物抗体阳性率为11.9%。Takahashi等[9]的研究显示: 抗药物抗体产生的患者血药浓度谷值明显低于无抗体产生的患者。
联合MTX相比单用依那西普可以获得更佳的临床疗效。在Gottlieb等[10]的试验中,478例PASI评分≥10的银屑病患者分为两组,前组239例接受MTX联合依那西普治疗,后组单用依那西普。在24周后,前后两组达到PASI 75的比例分别为77%和60%,差异有统计学意义。在Graziella[11]的试验中,对22例单用依那西普效果不佳的患者联用MTX,22周之后PASI评分由12.5下降为2.5。本研究中,第12、18、24周联合用药组PASI评分、PGA、PtGA、DLQI评分低于单药组,差异有统计学意义(P<0.05),表明联合MTX可以显著提高疗效。PASI 75、PASI 50和PASI 90在相同时期,联合用药组均高于单药组,但差异无统计学意义(P>0.05)。在Zachariae等[12]的研究中,24周时联合组和单药组达到PGA基本清除或清除的比例分别为37%和67%,和本试验联合用药组24周时66.7%的结果基本一致。可见,依那西普联合MTX治疗中重度斑块型银屑病,起效更快,疗效更佳。
尽管生物制剂联合免疫抑制剂治疗收到了较好的临床疗效以及维持效果,但是医生们更多的是担心联合使用后的副作用和安全性。尽管有些文献已经有相关的报道[13],但是样本量都比较小,需要临床上更多的经验和总结。
有文献报道[14]使用依那西普后常见的不良反应是注射部位局部反应和感染。感染多为轻至中度,严重感染发生率小于1%。少见的不良反应有结核、机会致病菌感染、贫血、白细胞减少等[15]。MTX的不良反应较常见病有胃肠道反应包括恶心、呕吐、食欲减退和肝功能损伤。
Gottlieb等[10]的试验中,联合用药组75%的患者发生不良反应,高于单用依那西普组60%,但大多数不良反应为轻中度。研究中发生6例严重不良反应: 联合用药组发生腰椎椎管狭窄、腱鞘囊肿、细菌性肺炎各1例,单用组哮喘,胆囊炎,心力衰竭各1例。两组相比严重不良事件的发生率并无差异。本研究中,联合用药组不良反应的发生率为60%,高于单药组的33.3%,但差异无统计学意义,说明联合用药并没有显著增加不良反应的发生率。其中联合用药组患者转氨酶升高的比例高于单用益赛普组,但转氨酶升高均为轻度,无需停药,密切随访过程中未发现持续升高的患者,所有的患者均完成24周的治疗。
综上所述,本研究发现在严格掌握适应证的前提下益赛普联合MTX治疗中重度斑块型银屑病疗效显著高于单用益赛普组,同时并不显著增加其不良反应。为临床上生物制剂联合免疫抑制剂治疗中重度斑块型银屑病的治疗提供临床依据。
【参考文献】
[1] ARAKAWA A, RUZICKA T, PRINZ J C. Therapeutic efficacy of interleukin 12/interleukin 23 blockade in generalized pustularpsoriasis regardless of IL36RN mutation status[J]. JAMA dermatol, 2016,152(7): 825-828.
[2] GOLDENSTEIN-SCHAINBERG C, FAVARATO M H, RANZA R. Current and relevant concepts in psoriatic arthritis[J]. Rev Bras Reumatol,2012,52(1): 98-106.
[3] 丁晓岚,王婷琳,沈佚葳,等.中国六省市银屑病流行病学调查[J].中国皮肤性病学杂志,2010,(7): 598-601.
[4] BARTELDS G M, WIJBRANDTS C A, NURMOHAMED M T, et al. Clinical response to adalimumab: relationship to anti-adalimumab antibodies and serum adalimumab concentrations in rheumatoid arthritis[J]. Ann Rheum Dis, 2007,66(7): 921-926.
[5] XU Z, DAVIS H M, ZHOU H. Clinical impact of concomitant immunomodulators on biologic therapy: Pharmacokinetics, immunogenicity, efficacy and safety[J]. J Clin Pharmacol, 2015,55(Suppl3): S60-74.
[6] BACHELEZ H, VAN DE KERKHOF P C, STROHAL R. Tofacitinib versus etanercept or placebo in moderate-to-severe chronic plaque psoriasis: a phase 3 randomised non-inferiority trial[J]. Lancet, 2015,386(9993): 552-561.
[7] PARENKY A, MYLER H, AMARAVADI L, et al. New FDA draft guidance on immunogenicity[J]. AAPS J, 2014,16(3): 499-503.
[8] HSU L, SNODGRASS B T, ARMSTRONG A W. Antidrug antibodies in psoriasis: a systematic review[J]. Br J Dermatol, 2014,170(2): 261-273.
[9] TAKAHASHI H, TSUJI H, ISHIDA-YAMAMOTO A, et al.Plasma trough levels of adalimumab and infliximab in terms of clinical efficacy during the treatment of psoriasis[J]. J Dermatol, 2013,40(1): 39-42.
[10] GOTTLIEB A B, LANGLEY R G, STROBER B E, et al. A randomized, double-blind, placebo-controlled study to evaluate the addition of methotrexate to etanercept in patients with moderate to severe plaque psoriasis[J]. Br J Dermatol, 2012,167(3): 649-657.
[11] BABINO G, GIUNTA A, RUZZETTI M, et al. Combination therapy with etanercept in psoriasis: retrospective analysis of efficacy and safety outcomes from real-life practice[J].J Int Med Res, 2016,44(1 suppl): 100-105.
[12] ZACHARIAE C, MORK N J, REUNALA T, et al. The combination of etanercept and methotrexate increases the effectiveness of treatment in active psoriasis despite inadequate effect of methotrexate therapy[J]. Acta Derm Venereol, 2008,88(5): 495-501.
[13] RITCHLIN C, RAHMAN P, KAVANAUGH A, et al. Efficacy and safety of the anti-IL-12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumor necrosis factor therapy: 6-month and 1-year results of the phase 3, multicenter, double-blind, placebo-controlled, randomized PSUMMIT 2 trial[J]. Ann Rheum Dis, 2014,73(6): 990-999.
[14] PALER A S, SIEGFRIED E C, PARISER D M, et al. Long-term safety and efficacy of etanercept in children and adolescents with plaque psoriasis[J]. J Am AcadDermatol, 2016,74(2): 280-287.
[15] PATEL S V, KHAN D A. Adverse Reactions to Biologic Therapy[J]. Immunol Allergy Clin North Am, 2017,37(2): 397-412.
