H2O2诱导BRL-3A细胞氧化损伤的研究
2018-05-16徐国银谈为忠杨利慧马海田
徐国银 谈为忠 杨利慧 马海田
(1.江苏省苏州市吴中区金庭动物防疫站,江苏苏州 215111;2.南京农业大学 农业部动物生理生化重点实验室,江苏南京 210095)
在正常生理条件下,体内的氧化系统与抗氧化系统处于动态平衡,适当含量的活性氧自由基对机体具有积极的生理作用。但在病理条件下,机体氧化与抗氧化系统之间平衡的破坏,机体内活性氧(ROS)含量相对升高,超过对其的清除能力,则会导致机体氧化应激的产生,继而引起机体脂质过氧化水平升高,DNA和蛋白质的氧化损伤增强,最终会增加机体发生动脉粥样硬化、炎症、衰老、癌症等疾病的风险。
H2O2作为一种重要的活性氧物质,其极易穿透细胞膜与细胞内的Fe2+通过fenton反应产生较高活性的羟自由基(·OH),继而引起一系列反应。H2O2来源广泛,性质相对稳定,目前已成为国内外研究细胞氧化应激的首选诱导剂。机体自由基含量增高,是导致肝脏氧化应激产生的主要原因之一。肝脏作为机体最重要的代谢器官,其功能障碍会增加内毒素含量,引发机体各种疾病的发生、发展。其他应激,如热应激等也可导致肝脏氧化应激的发生。因此,本试验以大鼠肝细胞系(BRL-3A)为研究对象,探讨不同浓度H2O2对肝细胞氧化应激损伤的影响,以期为深入研究肝脏抗氧化应激损伤机制的研究提供依据。
1 材料与方法
1.1 试验材料
胎牛血清(FBS)购自Gibco公司;DMEM高糖培养基购自Hyclone公司;BCA蛋白浓度测定试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、活性氧(ROS)检测试剂盒均购自碧云天生物技术研究所;噻唑蓝(MTT)粉剂、超氧化物歧化酶(SOD)测试盒、过氧化氢酶(CAT)测试盒、过氧化物酶(POD)测试盒、细胞丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)测试盒、蛋白质羰基含量检测试剂盒均购自南京建成生物工程研究所;H2O2(分析级,29.0%~32.0%)购自美国 Amresco 公司。
1.2 试验方法
1.2.1 BRL-3A细胞培养 将液氮中冻存的BRL-3A细胞取出后放入37 ℃恒温水浴箱中迅速融化。用75%乙醇擦拭冻存管,在无菌条件下,将细胞悬液转移到离心管中,加入含10%胎牛血清的DMEM高糖培养液洗涤后,以1000 rpm/min 离心3 min,弃上清。将细胞沉淀用含10%胎牛血清的DMEM高糖培养液悬浮,然后移至10cm培养皿中,于37 ℃,5% CO2培养箱内培养。次日更换含10%胎牛血清的DMEM高糖培养液,继续培养观察。待细胞融合度达90%时,采用0.25%胰蛋白酶消化后传代。所有试验均使用对数生长期细胞。
1.2.2 MTT法检测细胞活力 将BRL-3A细胞按1×105ml-1接种于96 孔板,37℃ 培养 24 h 后分别用 0、50、100、150、200和300 μmol·L-1(n =10)的H2O2处理,分别于作用 0.5、1、2、4 和 8 h 后向每孔加入20 μl 5mg·mL-1MTT,37 ℃孵育4 h;吸出培养基,每孔加入150 μl二甲基亚砜(DMSO)溶解结晶,微型振荡器上振荡10 min,酶标仪测定 490 nm 处的吸光值(D490)。
1.2.3 Annexin V-PI 双染分析细胞凋亡率 将BRL-3A细胞按1×105ml-1接种于6孔板,37℃培养 24 h 后分别用0、50、100、150、200和300 μmol·L-1(n =10)的H2O2处理2 h后,0.25%胰酶消化、离心后收集细胞,弃培养液,用 PBS 清洗1次,加入195 μl Annexin V-FITC 结合液,再加入5 μl AnnexinV-FITC 和 10 μl碘化丙啶(PI)染色液,混匀,室温避光30 min,随即进行流式细胞检测。
1.2.4 ROS 含量的检测 细胞处理同1.2.3。细胞处理结束后,消化、离心后收集细胞,弃培养液,用 PBS 清洗1次,按照1:1000用无血清培养液稀释DCFH-DA,细胞收集后悬浮于稀释好的DCFH-DA中,37 ℃细胞培养箱内孵育30min,收集细胞并用 PBS洗涤细胞2次,流式细胞仪检测ROS含量。
1.2.5 抗氧化物酶(SOD、CAT、POD、GSH-Px)活性测定 细胞处理同 1.2.3。细胞处理结束后消化、离心、收集细胞。超声破碎细胞,2500 rpm/min 离心20min后收集上清。BCA 蛋白测试盒测定蛋白浓度,比色法分别测定细胞液的 D450、D405、D420和D550值。
1.2.6 蛋白质羰基含量测定 细胞处理同 1.2.3。细胞处理结束后消化、离心、收集细胞。超声破碎细胞,12000 rpm/min 离心15min后收集上清。BCA 蛋白测试盒测定蛋白浓度,比色法测定上清液中D370值。
1.3 数据统计与分析
数据以Mean ± SE 表示,用Graphpad prism 5.0和SPSS 16.0软件对试验数据进行One-Way ANOVA 方差分析。
2 结果和分析
2.1 H2O2处理对BRL-3A细胞活力的影响
BRL-3A细胞经0~300 μmol·L-1的H2O2分别处理0.5 h、1 h、2 h、4 h、8 h后,发现0~300 μmol·L-1的H2O2处理BRL-3A细胞0.5 h对细胞活力无显著性影响(P>0.05);150~300 μmol·L-1的H2O2处理BRL-3A细胞1~8 h时细胞活力极显著降低(P<0.01);100 μmol·L-1的H2O2处理BRL-3A细胞2 h开始,细胞活力显著降低(P<0.05),而在相同处理条件下,2~8 h细胞活力无显著性变化(P>0.05)。综合以上结果,本试验选取H2O2处理时间为2 h。
2.2 H2O2处理对BRL-3A细胞凋亡率的影响
Annexin V-PI 双染分析结果显示,与对照相比(0 μmol·L-1H2O2),25~50μmol·L-1的H2O2处理对BRL-3A细胞的凋亡率无显著性影响(P>0.05);100 μmol·L-1的H2O2处理有增加BRL-3A细胞的凋亡率的趋势,但差异不显著(P>0.05);150~300 μmol·L-1的H2O2处理极显著增加BRL-3A细胞的凋亡率(P<0.01),且与浓度呈正相关。
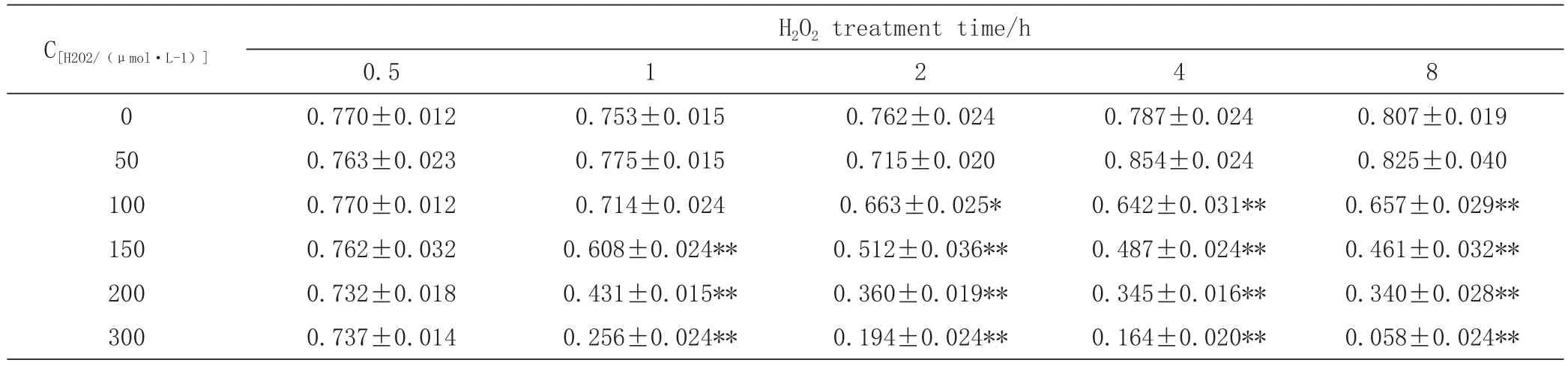
表1 H2O2对BRL-3A细胞活力的影响
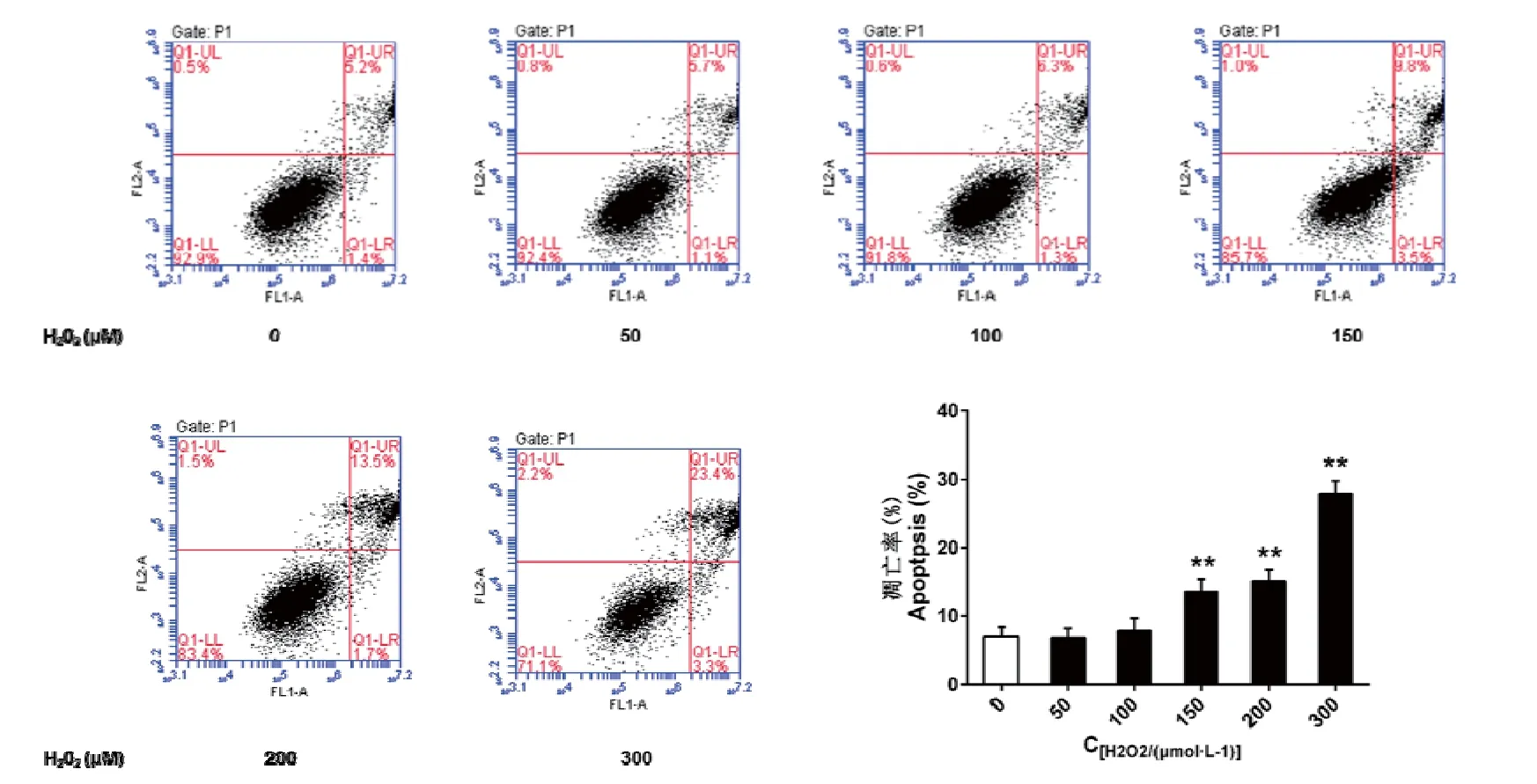
图1 H2O2处理对BRL-3A 细胞凋亡的影响
2.3 H2O2处理对BRL-3A细胞ROS含量的影响
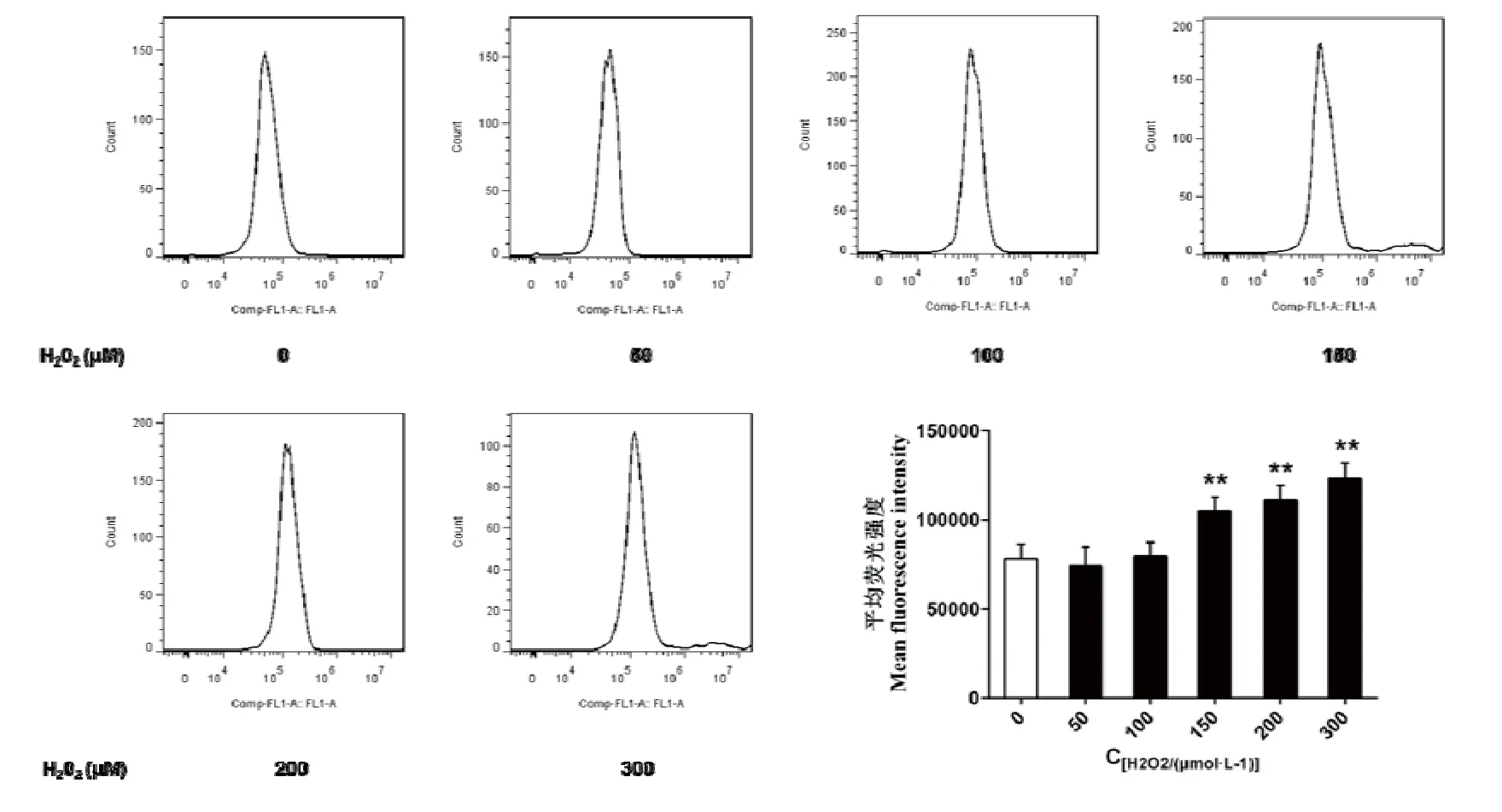
图2 H2O2处理对BRL-3A 细胞ROS含量的影响
DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。本试验结果显示,与对照相比,25~100 μmol·L-1的H2O2处理对BRL-3A细胞的活性氧含量无显著性影响(P>0.05);150~500 μmol·L-1的H2O2处理极显著增加BRL-3A细胞活性氧含量(P<0.01),且与浓度呈正相关。
2.4 H2O2处理对BRL-3A细胞蛋白质羰基含量的影响
由表2可知,与对照相比,25~50 μmol·L-1的H2O2处理对BRL-3A细胞的蛋白质羰基含量无显著性影响(P>0.05);100 μmol·L-1的H2O2处理显著增加BRL-3A细胞蛋白质羰基含量(P<0.05);150~300 μmol·L-1的H2O2处理极显著增加BRL-3A细胞蛋白质羰基含量(P<0.01),且与浓度呈正相关。
2.5 H2O2处理对BRL-3A细胞抗氧化物酶活性的影响
由表3可知:与对照相比,25~50 μmol·L-1的H2O2处理对BRL-3A细胞的SOD、CAT、POD的活性均无显著性影响(P>0.05);100~300 μmol·L-1的H2O2处理显著降低BRL-3A细胞的SOD、CAT、POD的活性(P<0.05),且与浓度呈正相关。与对照相比,25~300 μmol·L-1的H2O2处理对BRL-3A细胞的GSHPx的活性无显著性影响(P>0.05)。

表2 H2O2对BRL-3A细胞蛋白质羰基含量的影响
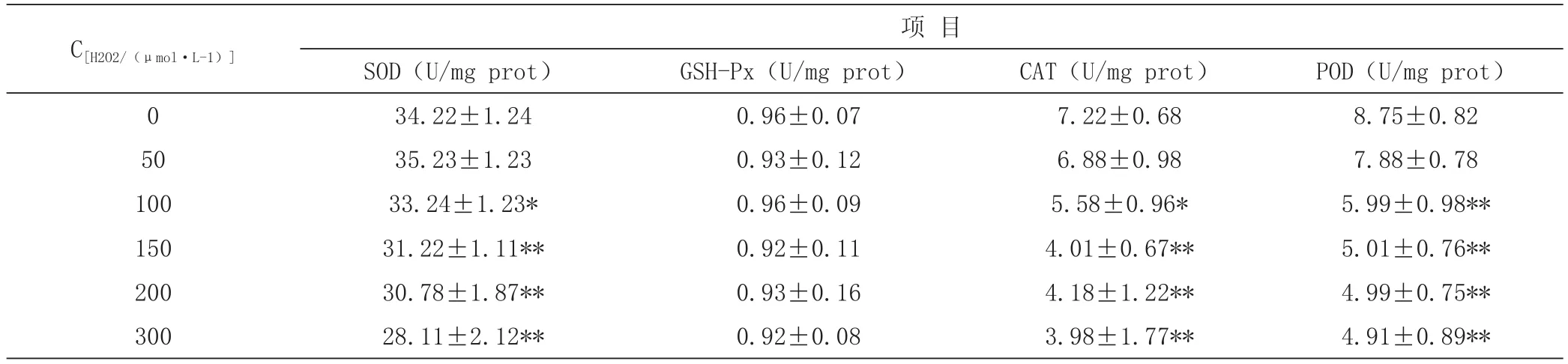
表3 H2O2对BRL-3A细胞抗氧化物酶活性的影响
3 讨论
氧化应激是体内氧化与抗氧化作用失衡导致的应激损伤状态,可导致细胞功能损伤,被认为是引起衰老及疾病的重要因素之一[11]。肝脏是动物机体的核心代谢器官,被称为体内化学工厂。其含有大量的线粒体,线粒体呼吸链能够利用电子传递产生 ATP,为细胞各种生理活动提供基础能量的同时,也产生大量ROS,如果没有相应的抗氧化机制,就会引起肝细胞损伤。机体的各个组织和细胞内都有抗氧化系统,其中肝细胞具有相对较多的抗氧化相关酶,因而具有更强的抗氧化功能。
H2O2作为ROS在体内的重要存在形式,可穿透细胞并对其造成损伤。本试验以H2O2为氧化损伤诱导剂,探讨了不同浓度的H2O2对BRL-3A细胞体外氧化损伤的影响。试验结果表明,H2O2可诱导BRL-3A细胞凋亡,其凋亡程度与H2O2浓度呈正相关。MTT法检测细胞活力结果表明,150~300 μmol·L-1H2O2处理BRL-3A细胞 1~8 h后细胞活力均极显著降低,但H2O2作用时间太长可能会导致细胞产生不可逆的损伤甚至死亡。因此,选择H2O2处理 2 h作为后续研究H2O2诱导BRL-3A氧化损伤的处理条件。
流式细胞术分析结果表明,150~300 μmol·L-1的H2O2处理BRL-3A细胞2 h极显著增加细胞的凋亡率。该结果提示,H2O2可诱导BRL-3A 细胞凋亡,并与浓度呈正相关。ROS 是生物机体有氧代谢过程中的一种副产物,本试验中H2O2处理BRL-3A细胞后,胞内的 ROS 含量出现显著升高,说明在BRL-3A 细胞内主要是通过 Fenton 反应转化成·OH,使胞内的 ROS 含量大幅度增加而造成细胞的氧化损伤。本试验中 H2O2处理后胞内蛋白质羰基含量显著升高,且与浓度呈正相关。蛋白质羰基作为氧化应激的敏感指标,其生成量的多少能间接地反映 H2O2对细胞的损伤程度。生理情况下,需氧生物体内代谢伴随着 ROS 不断产生,同时也被机体的抗氧化系统不断清除,然而并不能被完全清除,剩余的部分一方面发挥生理作用,另一方面可损伤生物分子。活性氧主要通过氧化修饰蛋白质侧链残基从而引起蛋白质构象改变,肽链断裂、聚合及交联,最终使得蛋白质功能丧失,酶和受体的功能下降。这可能是 H2O2诱导细胞中总 SOD 活性下降的原因之一。体内外研究表明,活性氧升高可对机体细胞造成羰基毒性。
SOD、POD、GSH-Px及CAT是生物体主要的酶性抗氧化剂[23,24],当机体受到外界刺激时,酶性抗氧化剂活性降低或非酶性抗氧化物质含量水平下降,可使机体组织因氧化损伤而引起功能失常。在对原发性肝癌、慢性病毒性肝炎、肝硬化失代偿期等肝脏病人的研究中发现,血液中清除活性氧的SOD、POD、GSH-Px及CAT活性下降,其检测结果可反映肝组织受自由基损伤的程度和作为判断慢性肝病病情、疗效及预后的一个重要生化指标。本试验中,H2O2处理的BRL-3A细胞SOD、POD及CAT 活性下降,并与浓度呈正相关。综合以上结果,我们认为H2O2处理增加BRL-3A细胞的活性氧含量及降低抗氧化酶活性,导致BRL-3A细胞的氧化应激损伤,提高了BRL-3A细胞的蛋白质羰基含量及凋亡率,最终降低细胞活力。
本试验通过使用不同浓度H2O2处理BRL-3A细胞,探讨H2O2对肝细胞氧化应激损伤的影响,并探讨各种酶在抗损伤过程中的相互作用规律,为以后深入研究动物肝脏损伤和抗损伤保护机制奠定基础。
参考文献
[1]Reuter S,Gupta S C,Chaturvedi M M,et al. Oxidative stress,inflammation,and cancer:how are they linked [J]. Free Radical Biology and Medicine,2010,49(11):1603 -1616.
[2]Pi J B,Zhang Q,Fu J Q,et al. ROS signaling,oxidative stress and Nrf2 in pancreatic beta-cell function [J].Toxicology and Applied Pharmacology,2010,244(1):77-83.
[3]汪海涛,林洁,杨波,等. 过氧化氢诱导人巨核细胞系Dami氧化应激模型的建立及评价 [J].解放军医学院学报,2014,35(4):349-356.
[4]Liu H T,He J L,Li WM,et al. Chitosan oligosaccharides protect human umbilical vein endothelial cells from hydrogen peroxideinduced apoptosis [J].Carbohydrate Polymers,2010,(80):1062-1071.
[5]Farombi E O,Moller P,Dragsted L O,et al. Ex-vivo and in vitro protective effects of kolaviron against oxgen-dervied strew in human lymphocyles and rat liver cells [J].Cell Biology and Toxicology,2004,(20):71-82.
[6]丁逍,刘琳,陈迪,等.过氧化氢诱导原代大鼠睾丸间质细胞氧化损伤模型的建立 [J].南京农业大学学报,2014,37(2):99-104.
[7]Poljsak B,Strategies for Reducing or Preventing the Generation of Oxidative Stress [J].Oxidative Medicine and Cellular Longevity,2011,(10):45.
[8]Długosz A,Średnicka D,Boratyński J,et al. The infl uence of tacrolimus on oxidative stress and freeradical processes [J]. Postepy Hig Med Dosw,2007,(61):466-471.
[9]臧琳,郭景茹,郭爽,等. H2O2诱导BRL-3A细胞模拟大鼠肝脏氧化应激损伤的研究 [J]. 中国兽医学报,2013,33(3):445-449.
[10]赵雪珂,穆茂,程明亮.酒精性肝病与氧化应激 [J].临床肝胆病杂志,2014,30(2):118-120.
