CT联合MRI在PCNSL诊断中的临床应用
2018-05-15李翔张树桐王翔
李翔,张树桐,王翔
(华中科技大学同济医学院附属武汉中心医院 影像科,湖北 武汉 430014)
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)是一种罕见的恶性中枢神经系统非霍奇金淋巴瘤,其发病率低、约占颅脑肿瘤的2%,近年来其发病率呈上升趋势[1]。临床主要表现为以局部神经系统受损及颅内压增高为主,一般不伴发全身其他部位淋巴瘤,但该病起病急、进展快且预后较差,早发现早诊断早治疗能改善患者的预后[2-3]。CT扫描速度快、操作简单,能够有效的用于筛查病灶。MRI具有多参数成像的特点,其组织分辨率高,能够在一定程度上反应病灶的病理生理变化情况[4-5]。鉴于此,本研究旨在研究多层螺旋CT和MRI在诊断PCNSL中各自的作用和临床应用价值。
1 资料与方法
1.1 一般资料
选取2015年3月-2017年3月于华中科技大学同济医学院附属武汉中心医院病理科证实的73例PCNSL患者的CT与MRI数据。其中,男性39例、女性34例;年龄33~61岁,平均年龄45.8岁。临床上患者以肢体功能障碍及头痛头晕等中枢神经系统症状就诊,遂建议头颅CT平扫筛查,所有患者无免疫缺陷病史。
1.2 扫描设备及参数
1.2.1 CT扫描参数本研究CT扫描设备为64层螺旋CT(美国GE公司),探测器准直40mm×0.625mm,层厚选择5mm,层间距为5mm,矩阵选择512×512,采用120 kV电压,250 mA电流条件下扫描。
1.2.2 MRI扫描参数本研究采用3.0T磁共振扫描仪(荷兰Philips公司),线圈采用头颅线圈,视野为32cm×32cm、层厚5mm、层间距8mm,回波时间(echo time,TE)100~130 ms、重复时间(repetition time,TR)3 000~4 000 ms;磁共振扩散加权成像(diffusion weighted imaging,DWI)序列中b值(0和1 000 s/mm2),层厚5mm、层间距8mm,TE Minimun、TR 5 000~6 000 ms。所有患者进行T1WI增强扫描,对比剂钆喷酸葡胺,剂量0.1 ml/kg,流速2 ml/s,注射25 ml生理盐水。观察病灶的强化方式和强化程度,并测量病灶及周围3mm内水肿带的表现弥散系数(apparent diffusion coefficient,ADC)值和对侧正常脑实质的ADC值。
1.2.3 氢质子磁共振波谱(1H magnetic resonance spectroscopy,1H-MRS)检查在T1WI的三维坐标中扫描病灶感兴趣区(region of interest,ROI),将图像传至后处理工作站进行处理,获取ROI的波谱图像,主要观测的代谢产物是N-乙酰天门冬氨酸(n-acetyl aspartate,NAA)、胆碱(Choline,Cho)、脂质(Lipids,Lip)及Cho/NAA值。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用t检验,计数资料以率表示,用χ2检验,相关分析用Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 PCNSL患者的一般情况和CT、MRI表现
本研究共发现58例患者单发、15例患者多发,共检出97个病灶,病灶直径0.8~5.9cm,所有病灶均未发现钙化或出血。CT平扫呈等或稍高密度,MRI平扫呈等或稍长T1、T2信号,弥散呈高信号,67个病灶周围可见少许水肿,增强扫描呈均匀性或环形强化,部分增强病灶可见尖角征、脐凹征和蝴蝶征。
2.2 PCNSL患者的ADC值和1H-MRS结果比较
强化实性区与对侧正常区是所有患者自身进行相互对照。患者强化实性区与对侧正常区ADC、NAA、Cho、Lip及Cho/NAA值比较,采用t检验,差异有统计学意义(P<0.05),强化实性区ADC、NAA值低于对侧正常区,强化实性区Cho、Lip及Cho/NAA高于对侧正常区。见附表。
2.3 PCNSL病灶实性部分的1H-MRS代谢产物峰值与ADC值的相关性
通过分析1H-MRS代谢产物峰值结果与ADC值的相关性,采用Spearman相关性分析,ADC值与Cho峰值无相关(P>0.05)。ADC值与Lip峰值和Cho/NAA比值呈负相关(r=-0.729和-0.869,P=0.013和0.007),ADC值与NAA比值呈正相关(r=0.672,P=0.025)。
附表 PCNSL患者的ADC和1H-MRS结果比较 (n =73,±s)
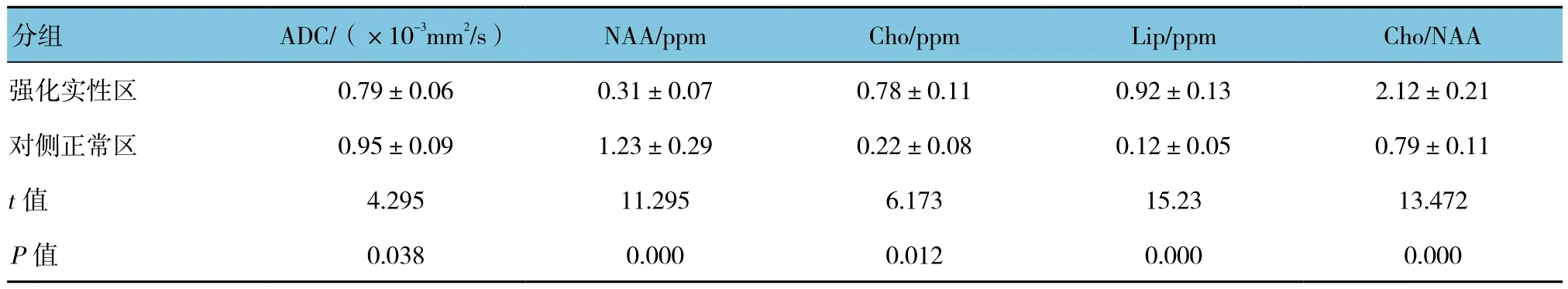
附表 PCNSL患者的ADC和1H-MRS结果比较 (n =73,±s)
分组 ADC/(×10-3mm2/s) NAA/ppm Cho/ppm Lip/ppm Cho/NAA强化实性区 0.79±0.06 0.31±0.07 0.78±0.11 0.92±0.13 2.12±0.21对侧正常区 0.95±0.09 1.23±0.29 0.22±0.08 0.12±0.05 0.79±0.11 t值 4.295 11.295 6.173 15.23 13.472 P值 0.038 0.000 0.012 0.000 0.000
3 讨论
PCNSL可发生与脑实质的任何部位,且可见于任何年龄组,无性别差异,目前该病起源尚不清楚,部分学者认为来源于脑组织血管周围未分化的继发性淋巴组织,因此,PCNSL瘤细胞表现为以血管为中心的袖套样生长方式[6-7]。当临床考虑为PCNSL是最好的治疗方案是进行放化疗,CT是临床筛查疾病的常规检查方法之一,MRI的多参数成像特点在诊断PCNSL具有明显的优势[8]。
本研究发现PCNSL病灶的CT平扫呈等或稍高密度,MRI平扫呈等或稍长T1、T2信号,弥散呈高信号,部分病灶周围可见少许水肿。据报道,PCNSL病灶区组织中淋巴细胞紧密排列,细胞间质水分少且核浆比较高,导致PCNSL病灶能够吸收许多X射线,在CT表现为高密度结节的颅内占位性病变[9]。PCNSL病灶在MRI的表现与脑膜瘤信号相似,又被称为脑膜瘤样信号改变,尤其是当存在瘤周水肿时,在瘤周水肿的衬托下形成鲜明的信号差异对比,具有该信号特点主要是因为淋巴瘤内含有丰富的网状纤维结构[10]。
本研究PCNSL病灶增强扫描表现为均匀性或环形强化,部分增强病灶可见尖角征、脐凹征及蝴蝶征。PCNSL是一种乏血供病变,但本研究增强扫描表现为均匀性或环形强化,主要是因为PCNSL肿瘤细胞表现为浸润性方式生长,导致病灶周围血管壁受侵蚀,破坏颅内血脑屏障,血管渗透性增加。因此,造影剂通过血管壁渗透漏经肿瘤细胞外间隙,且细胞间扩散速度缓慢,增强后病灶的边界更清晰[11]。当病灶增强扫描表现为环形强化时,这意味着肿瘤病灶内存在坏死,如果平扫时坏死部分没有表现为均匀的水信号,这表明病灶的坏死程度还未达到液化,且血脑屏障尚未发生完全破坏[12]。
本研究通过比较PCNSL强化实性区与对侧正常区的ADC、NAA、Cho、Lip及Cho/NAA值发现,淋巴瘤实性部分与对侧正常部分比较有差异,强化实性区ADC和NAA低于对侧正常区,强化实性区Cho、Lip和Cho/NAA高于对侧正常区。核磁DWI序列主要是客观反映感兴趣区内的水分子微观的扩散运动,PCNSL内瘤细胞排列紧密且细胞间质较少,细胞核浆比较高,因此,病灶内的水分子扩散运动受限,表现为DWI呈高信号,ADC呈低信号且ADC值较低[13]。Cho峰反应细胞膜的代谢情况,当Cho峰增加,意味着病灶区细胞膜快速转运,肿瘤细胞生长活跃。NAA峰降低意味着病灶区神经元减少,出现轴突损伤。高耸的Lip峰是PCNSL的特征性表现之一,高耸的Lip峰出现与淋巴细胞的存在和游离脂质被肿瘤细胞吞噬有关,在诊断PCNSL具有较高的特异性[14-15]。
通过分析1H-MRS代谢产物峰值结果与ADC值的相关性,采用Spearman相关性分析,ADC值与Cho峰值无相关性,ADC值与Lip峰值和Cho/NAA比值呈负相关。ADC值与NAA比值呈正相关,病灶区肿瘤细胞的密集程度与ADC值具有密切的关系,随着肿瘤细胞的不断增殖,肿瘤细胞水分子运动进一步受限,ADC值更低。并非只有PCNSL才会导致肿瘤细胞膜转换加速,如果仅仅根据Cho峰的变化而忽略ADC值情况,容易造成假阳性[16]。因此,根据1H-MRS结果诊断PCNSL时也需要与ADC值情况相结合。
PCNSL需要与多种疾病相鉴别:①脑膜瘤,浅表的PCNSL需要与脑膜瘤相鉴别,由于两者的MRI表现信号相似,且脑膜瘤钙化时CT平扫也可表现为高密度结节。进行1H-MRS扫描发现NAA峰消失且出现特征性的丙氨酸峰,可以此鉴别;②高级别胶质瘤,常规的MRI平扫和增强与环形强化的PCNSL容易混淆,除CT平扫能够鉴别部分外,ADC值是鉴别两种疾病的重要依据,PCNSL的ADC值<1,且1H-MRS技术的特征性Lip峰也是重要的鉴别点;③脑转移瘤,转移瘤多囊变坏死,增强表现为环形样和结节样强化,周围水肿明显。1H-MRS成像中,转移瘤的囊变坏死区可出现Lip峰,而PCNSL是实质部分出现Lip峰。除此之外,转移瘤的瘤周水肿无病理性波谱出现、而PCNSL病灶近侧水肿由于病灶的侵蚀可出现病理性波谱[17-19]。
综上所述,PCNSL的CT平扫、MRI平扫和增强及核磁1H-MRS成像具有一定的特征性,CT平扫能够有效地发现病灶,通过MRI信号能够初步诊断PCNSL,在需要与其他疾病相鉴别时,通过1H-MRS成像能够提供足够的代谢产物信息,对PCNSL的诊断和鉴别诊断具有重要的临床应用价值。
参 考 文 献:
[1]李洁琳, 李晓玲.原发性中枢神经系统淋巴瘤的治疗进展[J].中国肿瘤临床, 2016, 43(2):47-51.
[2]司马义力·买买提尼牙孜, 贺春钰, 木克代斯·拜克提亚尔, 等.首发中枢神经系统转移的乳腺癌患者临床特点分析[J].实用癌症杂志, 2016, 31(09):1453-1455.
[3]KASSAM S, CHERNUCHA E, O’NEILL A, et al.High-dose chemotherapy and autologous stem cell transplantation for primary central nervous system lymphoma:a multi-centre retrospective analysis from the United Kingdom[J].Bone Marrow Transplant,2017, 52(9):1268-1272.
[4]AMBADY P, FU R, NETTO J P, et al.Patterns of relapse in primary central nervous system lymphoma:inferences regarding the role of the neuro-vascular unit and monoclonal antibodies in treating occult CNS disease[J].Fluids Barriers CNS, 2017, 14(1):16.
[5]刘运培.原发性中枢神经系统淋巴瘤的诊断、治疗及预后分析[J].国际神经病学神经外科学杂志, 2016, 43(6):595-597.
[6]吴永芳, 许春伟, 崔淼, 等.间变性大细胞淋巴瘤的临床病理特征合并文献复习[J].实用癌症杂志, 2016, 31(1):151-155.
[7]方向, 黄周, 孟倩, 等.原发性中枢神经系统淋巴瘤MRI表现[J].中国介入影像与治疗学, 2016, 13(1):37-41.
[8]SAKATA A, OKADA T, YAMAMOTO A, et al.Primary central nervous system lymphoma:is absence of intratumoral hemorrhage a characteristic finding on MRI[J].Radiol Oncol 2015, 49:128-134.
[9]黄维玲, 马宇昕, 刘靖, 等.银杏内酯A对中枢神经系统作用及机制的研究进展[J].解剖学研究, 2017, 39(2):149-151.
[10]JAIN T K, SHARMA P, SUMAN S K, et al.Primary central nervous system lymphoma with lymphomatosis cerebri in an immunocompetent child:MRI and 18F-FDG PET-CT findings[J].Rev Esp Med Nucl Imagen Mol, 2013, 32:394-396.
[11]NAKAJIMA S, OKADA T, YAMAMOTO A, et al.Differentiation between primary central nervous system lymphoma and glioblastoma:a comparative study of parameters derived from dynamic susceptibility contrast-enhanced perfusion-weighted MRI[J].Clin Radiol 2015, 70:1393-1399.
[12]李岩, 刘爱春.弥漫大B细胞淋巴瘤预后相关因素研究进展[J].东南大学学报(医学版), 2017, 36(4):666-670.
[13]杨琳, 谢瑞祥, 吴晖, 等.ABCB1基因多态性与非霍奇金淋巴瘤患者甲氨蝶呤毒副反应关系研究[J].中国医院药学杂志,2016, 36(22):1992-1996.
[14]陈其钻, 王守森, 刘峥, 等.原发性中枢神经系统淋巴瘤的影像学研究[J].中华神经外科杂志, 2017, 33(2):173-177.
[15]GE J, ZUO C, GUAN Y.Enhanced MRI and 18F-FDG PET/CT findings of primary central nervous system lymphoma mimicking encephalitis[J].Clin Nucl Med, 2016, 41:e436-e438.
[16]孙辰婧, 洪柳, 刘建国, 等.颅内肿瘤样脱髓鞘病与原发性中枢神经系统淋巴瘤临床误诊病理分析[J].中华神经科杂志,2015, 48(9):757-762.
[17]谢韬, 金法, 姜晓丹, 等.120例脑膜瘤病理表型与肿瘤分级及预后的相关性研究[J].东南大学学报(医学版), 2016, 35(05):688-691.
[18]黄日升, 曹代荣, 邢振, 等.1H-MRS在原发性中枢神经系统淋巴瘤与高级别胶质瘤鉴别诊断中的价值[J].临床放射学杂志, 2015, 34(4):527-531.
[19]冯殿伟.药源性中枢神经系统疾病1262例文献分析[J].中国医院药学杂志, 2016, 36(19):1680-1684.
