氨基酸转运蛋白家族成员在膀胱癌中的表达及其临床意义
2018-05-15曾繁畅唐正严岑松康新立
曾繁畅,唐正严,岑松,康新立
(1.中南大学湘雅医院 泌尿外科,湖南 长沙 410008;2.海南省人民医院 泌尿外科,海南 海口 570311)
膀胱癌是威胁人类健康的常见泌尿系统恶性肿瘤,膀胱癌发生、发展与染色体异常、基因多态性、表观遗传学改变等分子学机制关系密切[1]。但是膀胱癌发病机制目前仍不清楚。因此,本文从在分子生物学角度探讨膀胱癌发生、发展的可能机制,寻找新的膀胱癌诊断和预后评判指标,以及基因治疗靶点。
氨基酸转运蛋白家族在正常细胞和转化细胞生长、增殖及生存中发挥重要作用[2]。L型氨基酸转运载体1(L-type amino acid transporter 1,LAT1)、 系统ASC氨基酸转运蛋白2(system ASC amino acid transporter-2,ASCT2)、胱氨酸/谷氨酸转运体功能亚基(x-C-type cystine/glutamate transporter,xCT)3种氨基酸转运蛋白家族成员被认为与肿瘤发病机制和致癌作用关系密切[3-4]。这些氨基酸转运载体在人类肿瘤组织中呈异常高表达状态[5-7]。LAT1、ASCT2和xCT的过度表达与多种人类癌症不良结局相关,提示氨基酸转运蛋白家族成员可能是肿瘤的重要病理预测因子[3,8-11]。但这些氨基酸转运载体LAT1、ASCT2和xCT在膀胱癌患者中的临床病理意义目前尚未见报道。本研究采用免疫组织化学法检测膀胱癌手术切除组织标本中LAT1、ASCT2和xCT蛋白的表达,并分析其表达水平与患者临床病理参数的相关性。此外,还检测细胞核增殖相关抗原Ki-67和血管生成标志物CD34在膀胱癌组织中的表达,以探讨膀胱肿瘤增殖、血管生成与氨基酸转运蛋白的相关性。
1 资料与方法
1.1 研究对象
选取2008年1月-2009年12月中南大学湘雅医院手术切除并经病理证实的膀胱癌患者93例,取膀胱癌及其癌旁正常膀胱组织,癌旁组织为距肿瘤2cm处膀胱上皮组织。另取手术治疗的良性疾病正常膀胱组织27例作为对照。标本切除离体后用10%甲醛固定。膀胱癌组患者男性71例,女性22例;年龄37~68岁,平均48.2岁;患者术前未接受放、化疗(包括膀胱灌注)。收集患者的临床资料,包括肿瘤大小、数目、形态、病理分级、病理分期(按AJCC2002标准)、复发转移情况、生存时间等。
1.2 主要试剂
小鼠抗人CD34、Ki-67、ASCT2、xCT和LAT1单克隆抗体购自美国Abcam公司,SP试剂盒和二氨基联苯氨(Diaminobezidin,DAB)显色试剂盒购自北京中杉金桥生物公司。
1.3 免疫组织化学法
免疫组织化学法检测CD34、Ki-67、ASCT2、xCT、LAT1的表达。将蜡块制成4mm厚切片,常规脱蜡至水,0.3%过氧化氢孵育30min以阻断内源性过氧化物酶。0.01 mol/L PBS冲洗3次,5min/次,高压抗原修复。将切片浸入0.01 mol/L柠檬酸盐抗原修复液(pH=6.0),高压3min,自然冷却至室温。0.01 mol/L PBS冲洗3次,5min/次,滴加一抗(1∶100),4℃孵育过夜。0.01 mol/L PBS冲洗3次,5min/次,滴加生物素标记的二抗,室温孵育30min。0.01 mol/L PBS冲洗3次,5min/次,DAB显色,苏木精复染,中性树胶封片,光镜观察。PBS代替一抗作为阴性对照。结果判定采用双盲法,同时由2位资深病理科医师独立观察每张切片后进行判定。判定标准采用半定量评分法,根据染色强度和阳性细胞百分比进行判定。染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比:无阳性细胞为0分,1%~9%为1分,10%~49%为2分,50%~74%为3分,75%~100%为4分。2项评分乘积≤4为阴性,>4分为阳性。
1.4 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验,计数资料以百分比或率表示,比较用χ2检验,用cox风险模型进行多变量回归分析,相关性分析用Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学法染色结果
LAT1、ASCT2和xCT主要表达于细胞膜上,在肿瘤组织部分以岛状形式表达,所有阳性细胞显示出较强的细胞膜染色。膀胱癌组织中LAT1、ASCT2和xCT的阳性表达率分别为55.9%(52/93)、77.4%(72/93)和65.6%(61/93)。按照半定量评分法,LAT1、ASCT2和 xCT表达的分数分别为(0.72±0.18)、(1.74±0.26)和(1.42±0.23)分,经方差分析,差异有统计学意义(F=3.829,P=0.001)。LAT1的分数低于ASCT2和 xCT(P<0.05),ASCT2与 xCT比较,差异无统计学意义(P>0.05)。见附图。
膀胱癌组织中CD34和Ki-67高表达率分别为52.7%(49/93)和50.5%(47/93)。ASCT2阳性表达与Ki-67相关(P<0.05)。LAT1的表达与临床病理特征无关(P>0.05)。xCT阳性表达只与肿瘤分化程度相关(P<0.05)。见表1。
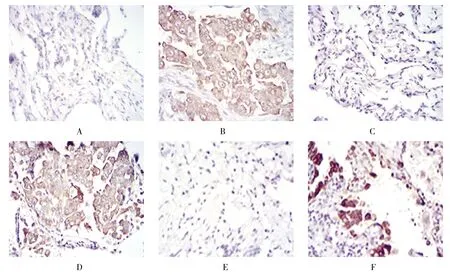
附图 LAT1、ASCT2和xCT在膀胱癌组织中的表达 (SP×400)
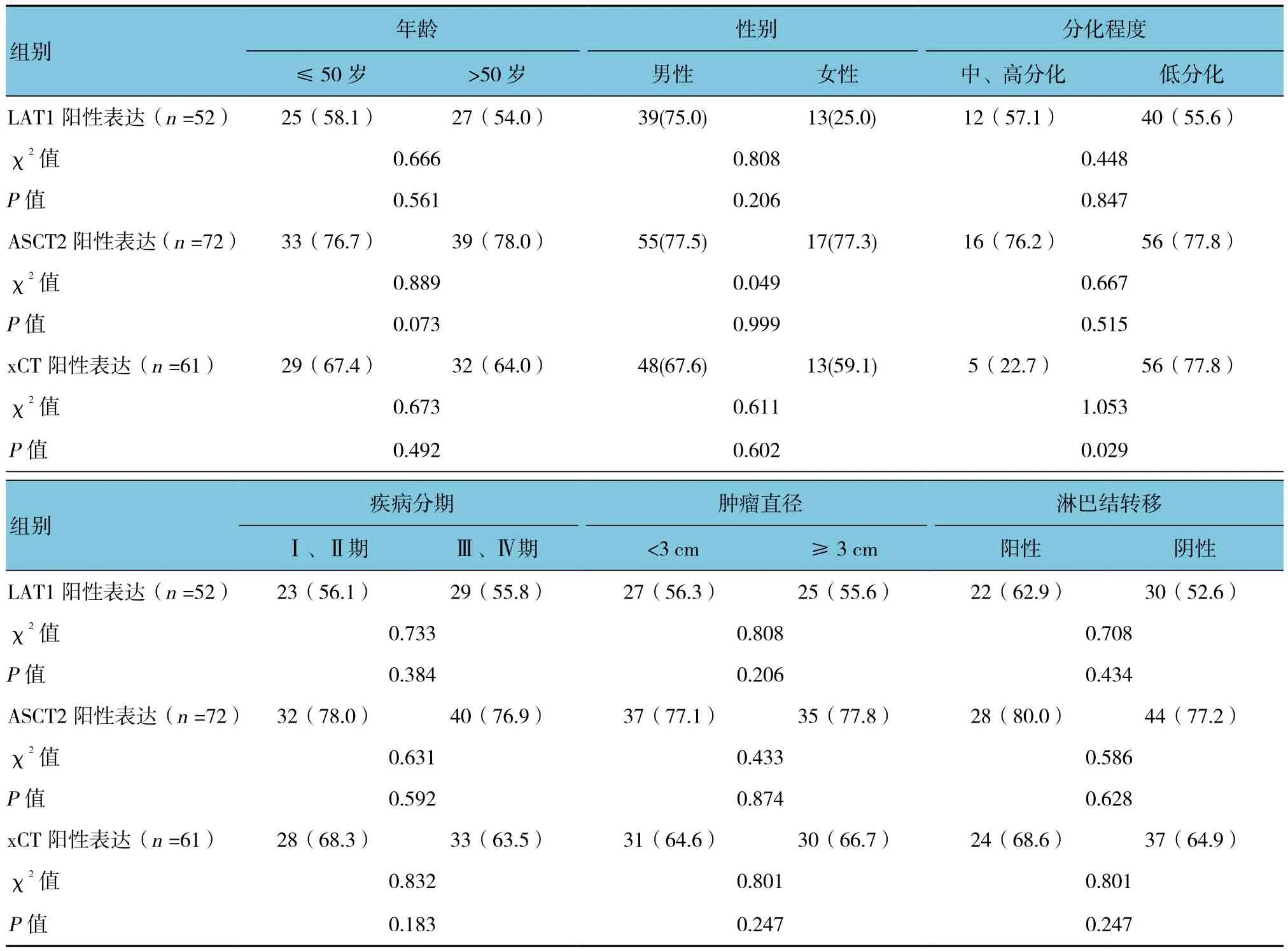
表1 LAT1、ASCT2、xCT阳性表达与患者临床病理特征的关系 例(%)

续表1
2.2 ASCT2表达与各因素的相关性
ASCT2与 LAT1、Ki-67呈正相关(P<0.05),与肿瘤大小、淋巴结转移、复发、xCT及CD34无关(P>0.05)。见表2。
2.3 膀胱癌患者5年总生存率和无复发生存率的单因素分析
本研究引入可能影响膀胱癌患者术后生存的临床病理因素,包括患者年龄、性别、分化程度、疾病分期、肿瘤大小、淋巴结转移、复发、ASCT2、LAT1、xCT、Ki-67及CD34表达。ASCT2表达、疾病分期与总生存率相关(P<0.05)。肿瘤大小、疾病分期、淋巴结转移与无复发生存率相关(P<0.05)。见表3。
2.4 膀胱癌患者5年总生存率的Cox多因素分析
将单因素分析有统计学意义的影响因素纳入Cox多因素回归分析。结果显示,疾病分期和ASCT2蛋白表达是影响膀胱癌患者预后最有价值的因素。疾病分期和ASCT2蛋白表达是影响膀胱癌患者术后5年总生存率的独立预后因素。本研究发现,ASCT2蛋白是影响膀胱癌患者预后的独立分子标志物,并且对膀胱癌患者的5年总生存率和无复发生存率具有重要的预测价值。见表4。
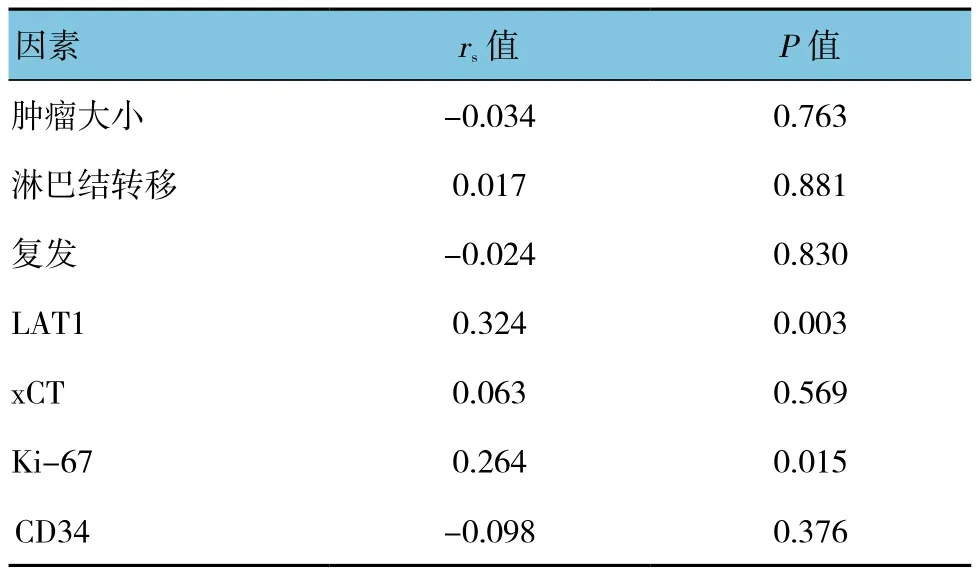
表2 ASCT2表达与各因素的相关性
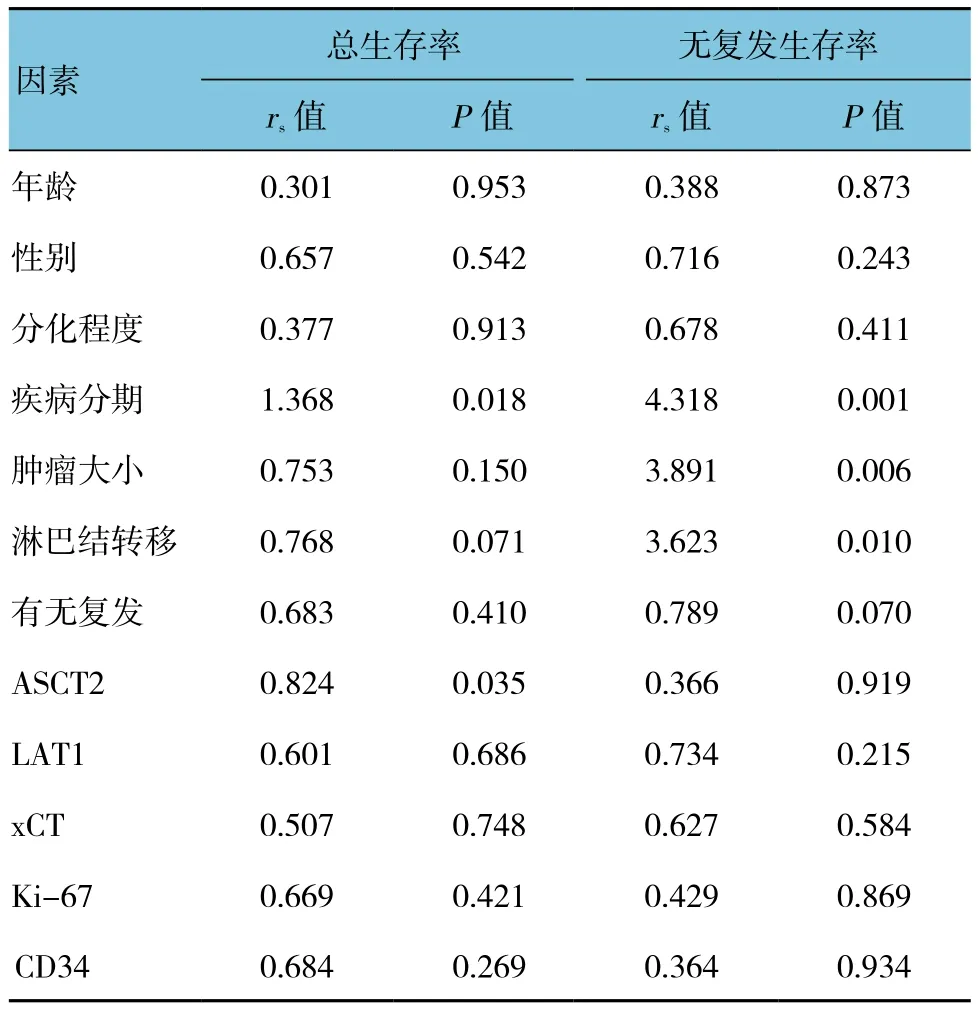
表3 各因素与5年总生存率和无复发生存率的相关性
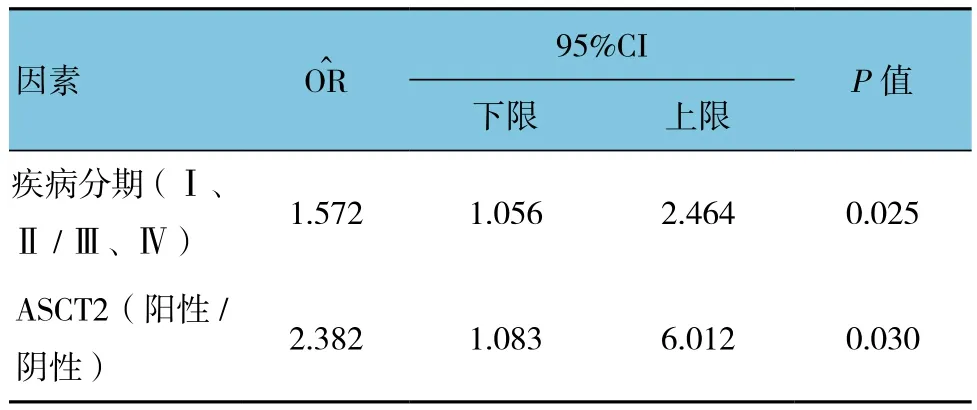
表4 膀胱癌患者5年总生存率的多因素分析参数
3 讨论
本研究探讨氨基酸转运蛋白家族成员LAT1、ASCT2和xCT在膀胱癌中的表达及其临床意义。结果表明,3种氨基酸转运蛋白中,ASCT2表达在膀胱癌发展和恶化过程中发挥重要作用。此外,ASCT2表达与细胞核增殖相关抗原Ki-67呈正相关,提示ASCT2表达与膀胱癌细胞增殖关系密切,ASCT2表达是预测膀胱癌患者不良转归的独立预后标志。此外,ASCT2表达与细胞增殖、血管生成相关。但ASCT2在膀胱癌中的表达低于其他人类肿瘤,如肺癌[4]、胰腺癌[6]、乳腺癌[12]和头颈部癌[5]。尚未见关于ASCT2在膀胱癌中表达低于其他癌的研究报道。
SHIMIZU等[4]研究104例非小细胞肺癌发现,ASCT2的阳性表达率为86%,且ASCT2阳性表达与疾病分期、淋巴结浸润、血管浸润、CD98表达、细胞增殖、血管生成、mTOR磷酸化及肺腺癌关系密切;其研究表明,ASCT2是肺腺癌患者预后差的独立预测因素。蔡灿锋等[13]研究表明,ASCT2的高表达与结直肠癌进展关系密切,是其独立预后不良因素之一,可能与增强谷氨酰胺代谢,促进肿瘤进展有关。这些研究结果与本研究在膀胱癌中的实验结果类似,但是以往这些研究未探讨氨基酸转运蛋白其他家族成员在肿瘤中的表达情况,未对ASCT2影响肿瘤进展的机制进行分析。本研究也是国内首次在膀胱癌中分析氨基酸转运家族成员与膀胱癌细胞增殖Ki-67、血管生成CD34的相关性。结果表明,ASCT2在膀胱癌细胞增殖、新生血管中发挥重要作用,尤其是在膀胱癌细胞增殖过程中。此外,本研究还发现,LAT1在ASCT2表达中发挥重要作用。有研究证实在舌癌中LAT1与ASCT2相关[5]。膀胱癌患者中,ASCT2是预测不良结果的有效指标,但LAT1不是明确的预后指标。然而在其他肿瘤中,LAT1是一个独立的预后指标,LAT1表达与晚期癌症患者不良预后关系密切。目前认为,肺癌中LAT1与氨基酸转运、整合素信号、促进肿瘤的生长和转移等功能关系密切[14]。膀胱癌患者中,LAT1可能促进ASCT2的表达,肿瘤的恶性特征可能是LAT1和ASCT2共同表达的结果。这些结果表明,ASCT2的表达对肿瘤进展和膀胱细胞存活是非常必要的,LAT1是一个潜在的预后标志。
本实验结果还发现,膀胱癌组织中ASCT2的阳性表达低于肺癌[4]、胰腺癌[6]和结肠癌[13],胰腺癌、胆管癌和肺癌的平均阳性表达率分别为86%、85%和89%。但膀胱癌患者中阳性表达率仅为77%。虽然ASCT2在膀胱癌中的表达低于其他癌,但膀胱癌细胞中ASCT2阳性与肿瘤细胞增殖和存活关系密切。膀胱癌中LAT1、ASCT2和xCT均为阳性表达,这些氨基酸转运蛋白在膀胱癌的发展和恶化过程中发挥至关重要的作用。以往研究报道,LAT1和ASCT2可以作为重要的预后因素,其过度表达与人类肿瘤的转移、浸润关系密切[15]。其他癌中ASCT2表达低于LAT1和xCT,但膀胱癌患者ASCT2表达高于LAT1和xCT。目前尚未见氨基酸转运蛋白在不同肿瘤中表达差异的机制研究,因此需要进一步研究LAT1和xCT表达在膀胱癌的作用。
最近研究表明,抑制ASCT2会降低肿瘤生长和哺乳动物雷帕霉素mTOR靶位的磷酸化水平[16]。氨基酸营养通过mTOR耦合到细胞信号上,激活的信号通路引起细胞生长。据报道,ASCT2在mTOR途径中扮演关键角色,人类肿瘤组织中ASCT2表达与mTOR磷酸化关系密切。但膀胱患者中ASCT2与mTOR的关系仍不清楚,有必要进一步研究ASCT2在膀胱癌mTOR通路中的作用。
总之,膀胱癌组织中ASCT2阳性表达与LAT1、细胞增殖相关。本研究结果提示,ASCT2表达是预测膀胱癌术后不良转归重要且独立的预后因素,抑制ASCT2可能成为膀胱癌患者治疗的潜在目标。
参 考 文 献:
[1]范海涛, 李然伟.分子靶向治疗在膀胱癌治疗中的研究进展[J].国际泌尿系统杂志, 2013, 33(1):71-76.
[2]CHRISTENSEN H N.Role of amino acid transport and countertransport in nutrition and metabolism[J].Physiological Reviews, 1990, 70(1):43-77.
[3]SHI L, LUO W, HUANG W, et al.Downregulation of L-type amino acid transporter 1 expression inhibits the growth, migration and invasion of gastric cancer cells[J].Oncology Letters, 2013, 6(1):106-112.
[4]SHIMIZU K, KAIRA K, TOMIZAWA Y, et al.ASC amino-acid transporter 2 (ASCT2) as a novel prognostic marker in non-small cell lung cancer[J].British Journal of Cancer, 2014, 110(8):2030-2039.
[5]TOYODA M, KAIRA K, OHSHIMA Y, et al.Prognostic significance of amino-acid transporter expression (LAT1, ASCT2, and xCT) in surgically resected tongue cancer[J].Br J Cancer, 2014, 110(10):2506-2513.
[6]KAIRA K, SUNOSE Y, ARAKAWA K, et al.Clinicopathological significance of ASC amino acid transporter-2 expression in pancreatic ductal carcinoma[J].Histopathology, 2015, 66(2):234-243.
[7]GUO W, ZHAO Y, ZHANG Z, et al.Disruption of xCT inhibits cell growth via the ROS/autophagy pathway in hepatocellular carcinoma[J].Cancer Lett, 2011, 312(1):55-61.
[8]HAINING Z, KAWAI N, MIYAKE K, et al.Relation of LAT1/4F2hc expression with pathological grade, proliferation and angiogenesis in human gliomas[J].BMC Clin Pathol, 2012, 1(8):4-11.
[9]黄骞, 李宁, 朱维铭, 等.Na+-依赖性谷氨酰胺载体ASCT2的生物学功能及表皮生长因子的调控作用[J].肠外与肠内营养,2006, 13(4):329-334.
[10]ROOMAN I, LUTZ C, PINHO A V, et al.Amino acid transporters expression in acinar cells is changed during acute pancreatitis[J].Pancreatology, 2013, 13(5):475-485.
[11]WAGNER C A, LANG F, BRÖER S.Function and structure of heterodimeric amino acid transporters[J].American Journal of Physiology Cell Physiology, 2001, 281(4):C1077-1093.
[12]FURUYA M, HORIGUCHI J, NAKAJIMA H, et al.Correlation of L-type amino acid transporter 1 and CD98 expression with triple negative breast cancer prognosis[J].Cancer Science, 2012,103(2):382-389.
[13]蔡灿锋, 唐超明, 刘高杰, 等.谷氨酰胺转运体ASCT2在结直肠癌中的表达及临床意义[J].中华实验外科杂志, 2015,32(10):2557-2559.
[14]黄士隋.氨基酸转运载体LAT1在肿瘤中的研究进展[J].临床肿瘤学杂志, 2012, 17(1):85-88.
[15]FUCHS B C, BODE B P.Amino acid transporters ASCT2 and LAT1 in cancer:partners in crime[J].Semin Cancer Biol, 2005,15(9):254-266.
[16]KIM D H, SARBASSOV D D, ALI S M, et al.GβL, a positive regulator of the rapamycin-sensitive pathway required for the nutrient-sensitive interaction between raptor and mTOR[J].Molecular Cell, 2003, 11(4):895-904.
