紫檀芪对中波紫外线照射的HaCaT细胞抗氧化物酶表达及活性的影响
2018-05-15邓蕙妍李华平陈荃李润祥梁碧华高爱莉周欣朱慧兰
邓蕙妍 李华平 陈荃 李润祥 梁碧华 高爱莉 周欣 朱慧兰
510095广州市皮肤病防治所皮肤科
白藜芦醇是具有较好防护作用的抗氧化剂[1],其中核因子E2相关因子2(Nrf2)信号通路的激活是其发挥抗氧化作用的主要机制之一。紫檀芪是白藜芦醇的衍生物,与白藜芦醇相比,其生物利用度更高[2],对Nrf2有较强的激活作用[3]。既往对紫檀芪抗氧化作用的研究集中在乳腺、心血管系统、消化系统、血液系统、代谢系统和神经系统等,其主要作用表现为减少活性氧簇(ROS)生成、增加过氧化氢酶(CAT)、谷胱甘肽(GSH)、谷胱甘肽氧化酶(GPx)、超氧化物歧化酶(SOD)等表达[4⁃6],而紫檀芪对皮肤作用的研究仅限其抗癌作用[7]。紫檀芪能否作为紫外线防护剂,预防皮肤急性氧化损伤还未见报道。为探讨紫檀芪对人永生化角质形成细胞(HaCaT细胞)急性光损伤的保护作用,本研究探讨紫檀芪干预前后经中波紫外线(UVB)照射的HaCaT细胞损伤程度、Nrf2核转位及下游抗氧化酶变化。
材料与方法
一、细胞、试剂和仪器
HaCaT细胞(广州吉妮欧生物科技有限公司)。紫檀芪纯合物(纯度≥97%,美国Sigma公司),细胞活性检测试剂盒(美国Promega公司),膜联蛋白V-藻红蛋白凋亡检测试剂盒(美国BD Biosciences公司),核蛋白-胞质蛋白提取液(美国Thermo Fisher Scientific公司),M⁃MLV反转录酶(美国Promega公司,M1705),GoTaq®qPCR Master Mix(美国Promega公司,A6002),一步法RNA提取试剂盒(Trizol,美国MRC公司,TR118⁃500),抗Nrf2抗体、生物素标记抗体、辣根过氧化物酶标记亲和素(武汉博士德生物工程有限公司)。ELISA检测试剂盒(武汉华美生物工程有限公司),UVB灯管,波长范围290~320 nm,峰值297 nm,功率40 W(北京电光源研究所);Tanon电泳仪(上海天能科技有限公司);基因扩增仪(珠海黑马医学仪器有限公司)。
二、实验方法
1.HaCaT细胞急性光损伤模型构建:参考本课题组前期研究结果[8],使用57 mJ/cm2UVB,每次照射光源与细胞的垂直照射距离为15 cm,取对数生长期细胞在超净台内照射,完成后换为培养基继续培养18 h。
2.筛选无毒性的紫檀芪浓度:HaCaT细胞随机分为对照组、各浓度紫檀芪组(2.44、4.88、9.75、19.5、39、78和156 μmol/L),分组加好药物后37 ℃培养24 h。加入MTS试剂,37℃孵育0.5 h后,酶标仪检测490 nm波长处吸光度(A值)。
细胞按上述分组处理24 h后,无乙二胺四乙酸(EDTA)胰酶消化并收集细胞,磷酸盐缓冲液(PBS)清洗细胞2次。用1×结合缓冲液重悬细胞为1 × 106个/ml,取100 μl上述悬液至流式管中,分别加入膜联蛋白V 5 μl和7氨基放线菌素D 5 μl,混匀,室温避光孵育15 min,加入400 μl结合缓冲液混匀后1 h内,采用流式细胞仪检测HaCaT细胞凋亡和坏死率,即细胞早期凋亡率、晚期凋亡率和坏死率之和。
3.Western印迹法检测HaCaT细胞内Nrf2核转位:HaCaT细胞随机分为对照组、UVB组、紫檀芪组、紫檀芪+UVB组。对照组:正常培养,不做任何处理;UVB组:UVB照射(同实验方法1);紫檀芪组:HaCaT细胞分别与2.44、4.88、9.75 μmol/L紫檀芪在37℃共培养24 h;紫檀芪+UVB组:HaCaT细胞分别与2.44、4.88、9.75 μmol/L紫檀芪在37 ℃共培养24 h后,接受UVB照射(同实验方法1)。吸去培养液,胰酶消化成细胞悬液,终止消化后600×g离心5 min。吸弃上清,加入胞质蛋白提取液Ⅰ和胞质蛋白提取液Ⅱ,经剧烈振荡和离心,上清液即为胞质蛋白;剩下的沉淀加入预冷的胞核蛋白提取液,重复振荡和冰上放置、离心,上清液即为胞核蛋白,收集细胞蛋白后,1∶500稀释,用8%聚丙烯酰胺凝胶电泳检测胞核蛋白和胞质蛋白,以3磷酸甘油醛脱氢酶(GAPDH,1∶5 000)和组蛋白H3(1∶2 000)作为内参照,计算上述蛋白表达量,设定对照组的第一个值为1,其他组与其相比较得出上述蛋白表达的差异。
4.定量PCR检测CAT和SOD mRNA表达水平:按照“二、3”中方法分组处理HaCaT细胞后,Trizol提取总RNA后,以M⁃MLV反转录酶进行逆转录,随后采用GoTaq®qPCR Master Mix进行qPCR反应。qPCR引物序列见表1。以β肌动蛋白为内参,根据2⁃△△Ct计算CAT和SOD mRNA的相对表达量。
5.ELISA检测CAT和SOD活性:将HaCaT细胞按实验方法3分组处理,收集上清液,按照ELISA检测试剂盒操作说明检测CAT和SOD活性。
三、统计学分析
采用SPSS19.0统计软件分析,计量资料用±s表示。无毒性紫檀芪浓度的确定实验结果采用单因素方差分析,两两多重比较采用LSD法。紫檀芪及UVB照射对HaCaT细胞胞质与胞核中Nrf2表达、CAT和SOD mRNA表达及活性的影响实验数据采用析因设计的方差分析,多重比较采用Tukey法。P<0.05为差异有统计学意义。

表1 qPCR引物序列
结 果
一、紫檀芪浓度的确定
0、2.44、4.88、9.75、19.5、39、78和156 μmol/L紫檀芪处理HaCaT细胞24 h后,HaCaT细胞增殖活性(A值)分别是1.442±0.004、1.437±0.002、1.428±0.002、1.415 ± 0.005、1.357 ± 0.002、1.263 ± 0.006、1.071±0.029、0.885±0.002。各组间HaCaT细胞增殖活性差异有统计学意义(F=1 497.661,P<0.01)。两两多重比较显示,2.44和4.88 μmol/L紫檀芪组细胞增殖活性与对照组相比,差异无统计学意义(P=0.512、0.061),而9.75、19.5、39、78、156 μmol/L紫檀芪组细胞增殖活性显著低于对照组,差异均有统计学意义(P<0.05)。
2.44、4.88、9.75、19.5、39、78和156 μmol/L紫檀芪组HaCaT细胞凋亡与坏死率分别为3.53%±0.12%、4.58% ±0.52%、8.06% ±0.97%、8.97% ±0.68%、9.70%±1.04%、14.53%±1.13%和19.75%±0.97%,各组间差异有统计学意义(F=3912.3,P<0.001),且随紫檀芪浓度增加,HaCaT细胞凋亡与坏死率逐渐增加。与对照组相比,紫檀芪浓度低于9.75 μmol/L时,细胞凋亡与坏死率变化不明显(P>0.05);浓度为9.75 μmol/L时,凋亡与坏死率开始出现轻微变化(P=0.05)。
结合细胞增殖和凋亡结果,紫檀芪浓度≤9.75 μmol/L时,对HaCaT细胞没有损伤。因此,确定下一步实验中紫檀芪浓度为2.44、4.88和9.75μmol/L。
二、HaCaT细胞内Nrf2核转位情况
见图1、表2。析因分析显示,紫檀芪对HaCaT细胞内Nrf2胞质和胞核蛋白的作用受UVB影响(胞质蛋白交互作用F=7.408,P=0.02,胞核蛋白交互作用F=16.148,P< 0.001)。Tukey检验显示,2.44、4.88和9.75 μmol/L紫檀芪组与对照组相比,Nrf2胞质蛋白(q分别为0.06、0.52、3.07,P> 0.05)和胞核蛋白(q分别为0.24、3.02、4.76,P> 0.05)无明显变化;UVB组与对照组相比,Nrf2胞质蛋白无明显变化(q=1.86,P>0.05),而Nrf2胞核蛋白显著增加(q=17.24,P< 0.01)。
2.44、4.88和9.75 μmol/L紫檀芪 +UVB组与对照组相比,Nrf2胞质蛋白浓度均显著下降(q分别为6.96、6.90、9.92,均P< 0.05),胞核蛋白浓度则显著升高(q分别为31.85、36.30、24.46,均P< 0.01);与UVB组相比,Nrf2胞质蛋白浓度均显著下降(q分别为5.329、5.069、12.30,均P< 0.05),胞核蛋白浓度则显著升高(q分别为14.61、19.06、7.23,均P< 0.01)。
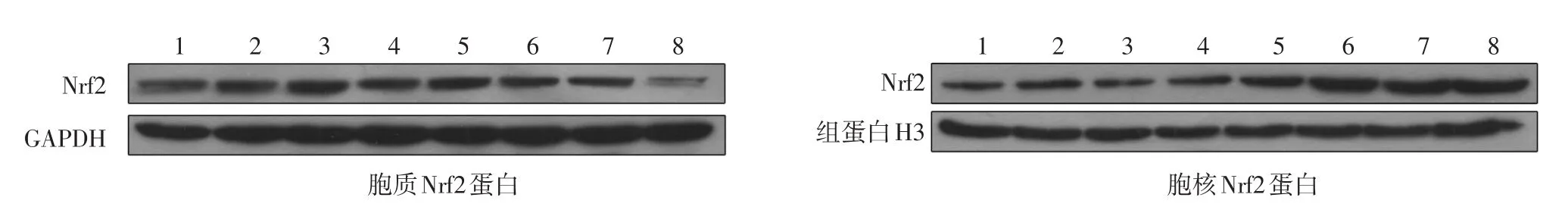
图1 不同浓度紫檀芪及UVB作用HaCaT细胞后胞质Nrf2蛋白、胞核Nrf2蛋白浓度变化 1:对照组;2~4:2.44、4.88、9.75 μmol/L紫檀芪组;5:UVB组;6~ 8:2.44、4.88、9.75 μmol/L紫檀芪 +UVB组
表2 不同浓度紫檀芪及UVB作用HaCaT细胞后胞质和胞核Nrf2蛋白相对表达水平(±s)
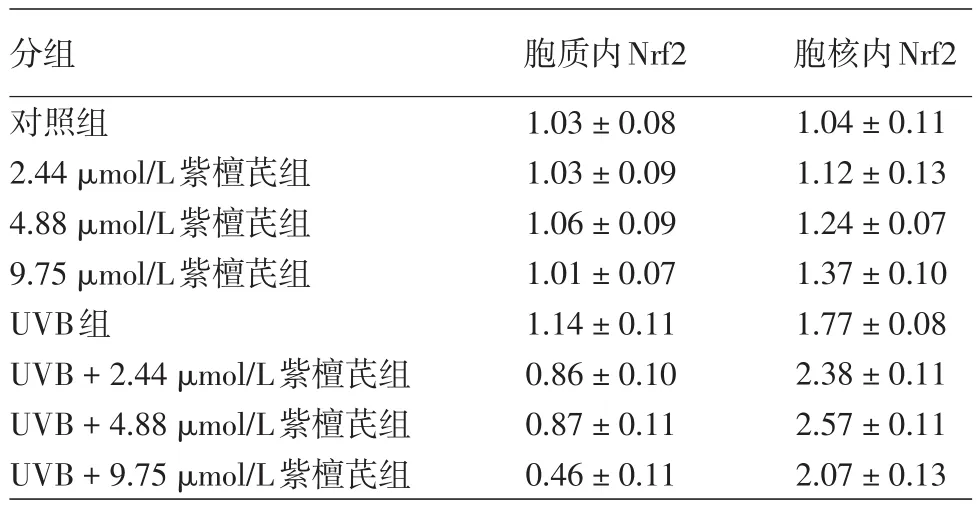
表2 不同浓度紫檀芪及UVB作用HaCaT细胞后胞质和胞核Nrf2蛋白相对表达水平(±s)
注:n=3
分组对照组2.44 μmol/L紫檀芪组4.88 μmol/L紫檀芪组9.75 μmol/L紫檀芪组UVB组UVB+2.44 μmol/L紫檀芪组UVB+4.88 μmol/L紫檀芪组UVB+9.75 μmol/L紫檀芪组胞质内Nrf2 1.03±0.08 1.03±0.09 1.06±0.09 1.01±0.07 1.14±0.11 0.86±0.10 0.87±0.11 0.46±0.11胞核内Nrf2 1.04±0.11 1.12±0.13 1.24±0.07 1.37±0.10 1.77±0.08 2.38±0.11 2.57±0.11 2.07±0.13
三、HaCaT细胞内CAT、SOD mRNA表达
见图2。qPCR显示,UVB照射会降低HaCaT细胞内CAT mRNA表达(F=276.569,P<0.001),但不会降低SOD mRNA表达(F=1.923,P>0.05),不同浓度紫檀芪亦会影响CAT、SOD mRNA表达(CAT:F=6.63,P=0.004;SOD:F=16.82,P< 0.001),且受UVB的影响(CAT交互作用F=3.78,P=0.032;SOD交互作用F=10.63,P<0.001)。
如图2显示,UVB组CAT表达显著低于对照组(P<0.05),而SOD表达无明显变化(P>0.05)。各浓度紫檀芪组与对照组相比,CAT和SOD的表达均无明显变化(P>0.05)。各浓度紫檀芪+UVB组与对照组相比,CAT表达显著下调(P<0.05),SOD表达显著上调(P<0.05);与UVB组相比,CAT和SOD的表达均明显上调(P<0.05)。不同浓度紫檀芪组间CAT、SOD mRNA的表达差异均无统计学意义。
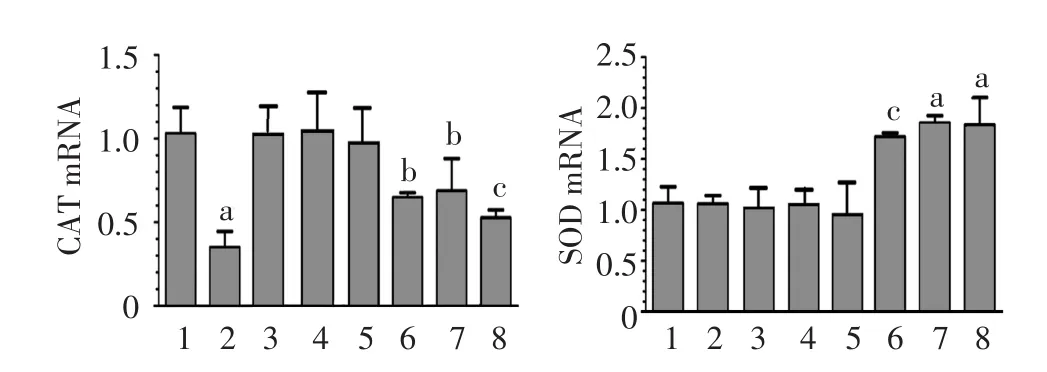
图2 不同浓度紫檀芪和(或)UVB处理HaCaT细胞后过氧化氢酶(CAT)和超氧化物歧化酶(SOD)mRNA表达 1:对照组;2:UVB组;3 ~ 5:2.44、4.88、9.75 μmol/L紫檀芪组;6 ~ 8:2.44、4.88、9.75 μmol/L紫檀芪+UVB组。与未接受UVB照射及紫檀芪处理的对照组相比,a:P < 0.001,b:P < 0.05,c:P < 0.01

图3 不同浓度紫檀芪和(或)UVB处理HaCaT细胞后过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性变化 1:对照组;2:UVB组;3 ~ 5:2.44、4.88、9.75 μmol/L紫檀芪组;6 ~ 8:2.44、4.88、9.75 μmol/L紫檀芪+UVB组。与未受UVB照射及紫檀芪处理的对照组相比,a:P < 0.01,b:P < 0.05;与UVB组相比,c:P < 0.05,d:P <0.01
四、CAT和SOD活性检测结果
见图3。UVB照射可显著降低HaCaT细胞内CAT和SOD活性(CAT:F=161.565,P< 0.001;SOD:F=1 766.747,P<0.001),不同浓度紫檀芪亦可显著影响CAT和SOD活性(CAT:F=8.277,P=0.001;SOD:F=7.83,P=0.002),紫檀芪对细胞内CAT、SOD活性的作用受UVB的影响(CAT交互作用F=5.161,P=0.011;SOD交互作用F=10.219,P=0.001)。
如图3显示,UVB组与对照组相比,CAT和SOD活性均显著下调(P<0.05)。各浓度紫檀芪组与对照组相比,CAT和SOD活性均无明显变化(P>0.05),且不同浓度紫檀芪组间差异均无统计学意义。各浓度紫檀芪+UVB组与对照组相比,CAT和SOD的表达均显著下调(P<0.05),与UVB组相比则有明显上升(P<0.05)。
讨 论
紫外线分为长波紫外线、UVB和短波紫外线,短波紫外线在经过地球表面臭氧层时被过滤掉,对皮肤无影响,UVB主要作用于表皮,长波紫外线穿透深度大于UVB,主要作用于真皮和真皮下层。HaCaT细胞作为表皮的主要成分,受UVB影响较大。研究表明[9],UVB引起皮肤光损伤的机制复杂,其中,氧化应激损伤是造成皮肤红斑、水肿等急性炎症反应的重要原因。面对氧化应激损伤,人类皮肤配备完善的自身抗氧化防御机制,其中最为重要的是调控抗氧化物酶和Ⅱ相解毒酶,如GSH、CAT、SOD及血红素加氧酶1(HO⁃1)等基因表达的Nrf2[10]。生理条件下,Nrf2 在胞质中与胞质蛋白Kelch样ECH联合蛋白1(Keap1)结合后被蛋白酶水解;氧化应激条件下,Nrf2从Keap1上解离,从胞质进入胞核与小分子蛋白Maf识别元件(MARE)位点结合,形成异二聚体并与ARE结合,调控下游抗氧化物酶和Ⅱ相解毒酶基因的转录,重新维持细胞内氧化还原水平[11]。本研究及前期研究[12]均发现,在没有添加抗氧化剂的情况下,UVB照射可使胞核Nrf2蛋白有所增加,但Nrf2胞质蛋白的含量没有明显变化,提示无Nrf2核转位,表明UVB照射引起HaCaT细胞急性损伤时,细胞内Nrf2通路不能自行启动,无法起到抗氧化作用。
既往研究表明,CAT可催化细胞内过氧化氢分解,防止氧化损伤。SOD是生物体内清除自由基的首要物质[4]。结合我们的实验可知,UVB照射可抑制细胞内CAT和SOD的表达和活性,影响细胞的抗氧化活性,引起细胞光损伤。在HaCaT细胞中预先添加紫檀芪,再经一定剂量的UVB照射,HaCaT细胞内发生Nrf2核转位,Nrf2调控的CAT和SOD表达上调,活性增加,证明紫檀芪可通过激活细胞内Nrf2通路,上调下游CAT和SOD表达,激活其抗氧化活性,起到防御细胞氧化损伤的作用。但是,SOD活性增加幅度较小,是否意味着与CAT相比,紫檀芪对SOD活性的影响较小?推测紫檀芪的作用主要是通过CAT催化过氧化氢分解,防止氧化损伤,而非通过SOD清除自由基。但这一推断还需要进一步实验验证。本课题组还发现另一种天然植物抗氧化剂茶多酚在促进Nrf2 mRNA和核蛋白的表达及分布的同时,可抑制核转录因子Bach1核蛋白的表达及分布[13]。因此,紫檀芪激活Nrf2通路是否也与抑制Bach1相关,除此通路以外是否还有其他机制参与其中,均需进一步实验探讨。
参考文献
[1]郑雯,曾维惠,易清玲,等.白藜芦醇对UVB照射的人皮肤成纤维细胞MMP⁃1水平及细胞凋亡的影响[J].中国皮肤性病学杂志,2012,26(4):296⁃299.
[2]Zhang Y,Shang Z,Gao C,et al.Nanoemulsion for solubilization,stabilization,andin vitrorelease of pterostilbene for oral delivery[J].AAPS PharmSciTech,2014,15(4):1000⁃1008.doi:10.1208/s12249⁃014⁃0129⁃4.
[3]Ramkumar KM,Sekar TV,Foygel K,et al.Reporter protein complementation imagingassay toscreen and study Nrf2 activators in cells and living animals[J].Anal Chem,2013,85(15):7542⁃7549.doi:10.1021/ac401569j.
[4]McCormack D,McFadden D.A review of pterostilbene antioxidant activity and disease modification[J].Oxid Med Cell Longev,2013,2013:575482.doi:10.1155/2013/575482.
[5]Naik B,Nirwane A,Majumdar A.Pterostilbene ameliorates intra⁃cerebroventricular streptozotocin induced memory decline in rats[J].Cogn Neurodyn,2017,11(1):35⁃49.doi:10.1007/s11571⁃016⁃9413⁃1.
[6]Sireesh D,Ganesh MR,Dhamodharan U,et al.Role of ptero⁃stilbene in attenuating immune mediated devastation of pan⁃creatic beta cells via Nrf2 signaling cascade[J].J Nutr Biochem,2017,44:11⁃21.doi:10.1016/j.jnutbio.2017.02.015.
[7]Cichocki M,Paluszczak J,Szaefer H,et al.Pterostilbene is equally potent as resveratrol in inhibiting 12⁃O⁃tetradecanoylphorbol⁃13⁃acetate activated NFkappaB,AP⁃1,COX⁃2,and iNOS in mouse epidermis[J].Mol Nutr Food Res,2008,52 Suppl 1:S62⁃70.doi:10.1002/mnfr.200700466.
[8]邓蕙妍,肖峰,高爱莉,等.人表皮角质形成细胞急性光损伤模型的构建[J].新医学,2013,44(8):556⁃559.doi:10.3969/g.issn.0253⁃9802.2013.08.012.
[9]Valencia A,Kochevar IE.Nox1⁃based NADPH oxidase is the major source of UVA⁃induced reactive oxygen species in human keratinocytes[J].J Invest Dermatol,2008,128(1):214 ⁃222.doi:10.1038/sj.jid.5700960.
[10]Tkachev VO,Menshchikova EB,Zenkov NK.Mechanism of the Nrf2/Keap1/ARE signaling system[J].Biochemistry (Mosc),2011,76(4):407⁃422.doi:10.1134/S0006297911040031.
[11]Keum YS,Choi BY.Molecular and chemical regulation of the Keap1⁃Nrf2 signaling pathway[J].Molecules,2014,19(7):10074⁃10089.doi:10.3390/molecules190710074.
[12]邓蕙妍,高爱莉,李振洁,等.姜黄素对紫外线照射后HaCaT细胞内Nrf2核转位的激活作用[J].中国麻风皮肤病杂志,2014,(7):390⁃393.
[13]梁碧华,刘清,江娜,等.茶多酚对人皮肤成纤维细胞Nrf2/Bach1mRNA及核蛋白的影响[J].中华皮肤科杂志,2017,50(3):199⁃203.doi:10.3760/cma.j.issn.0412⁃4030.2017.03.011.
