EP4基因沉默对甲状腺乳头状癌K1细胞生长及迁移的影响
2018-05-11钟荣誉徐芬艾鹤英周丹莉杨小颖孙辽
钟荣誉 徐芬 艾鹤英 周丹莉 杨小颖 孙辽
1中山大学附属第五医院内分泌与代谢病科(广东珠海 519000);2中山大学附属第三医院内分泌与代谢病科,广东省糖尿病防治重点实验室(广州 510630)
甲状腺癌是目前内分泌系统最为常见的恶性肿瘤,流行病学调查显示,近几十年来其发病率逐步上升,已严重影响公众健康[1]。而甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是其最主要病理类型,约占79%~94%[2]。其中约5%~20%PTC患者经过传统的手术、I131、TSH抑制等治疗后,仍发生局部复发和远处转移,目前尚无有效的治疗手段[3]。因此,通过寻找新的治疗靶点,从而改善这部分患者预后显得极为重要。
既往研究表明,前列腺素E2(prostaglandin E2,PGE2)及其关键合成酶环氧合酶⁃2(cyclooxygenase⁃2,COX⁃2)在甲状腺乳头状癌组织中表达升高且参与了其发生发展[4-5]。PGE2通过下游4种前列腺素E 受体(prostaglandin E receptor,EP)介导其作用,分别为EP1~4,其中前列腺素E受体4(prosta⁃glandin E receptor 4,EP4)与肿瘤关系密切,在多种肿瘤的生长、侵袭、转移过程中发挥着重要作用[6]。同时我们前期研究发现,甲状腺乳头状癌的肿瘤组织及细胞株中EP4表达明显升高[4,7],提示其可能在甲状腺乳头状癌发病中扮演着重要角色,但目前EP4与甲状腺乳头状癌的关系尚不清楚。因此,本研究通过下调甲状腺乳头状癌K1细胞中EP4的表达,研究其对K1细胞生长、迁移的影响,进一步了解EP4在甲状腺乳头状癌中的作用。
1 材料与方法
1.1 材料人甲状腺乳头状癌K1细胞株购自European Collection of Authenticated Cell Cultures(ECACC)。DMEM/F12培养基、胎牛血清、青霉素-链霉素溶液、0.25%胰酶(GIBCO,美国)。阴性对照慢病毒及靶向沉默EP4慢病毒载体(上海吉凯基因有限公司),嘌呤霉素(Sigma⁃Aldrich,美国)。总RNA提取试剂TRIpure(Roche,瑞士),逆转录试剂盒(TAKARA,日本),SYBR Green I Mas⁃ter试剂盒(Roche,瑞士),引物合成(Invitrogen,美国)。总蛋白提取试剂RIPA裂解液、EDTA、蛋白酶抑制剂(thermo,美国),BCA蛋白定量试剂盒(ther⁃mo,美国),EP4抗体(Cayman,美国),GAPDH抗体(Proteintech Group,美国)。CCK⁃8试剂盒(Dojindo,日本)。Annexin V⁃APC/PI凋亡试剂盒(Invitrogen,美国)。Transwell小室(Corning,美国)。
1.2 细胞培养K1细胞用含10%胎牛血清的DMEM/F12培养基,于37℃、5%CO2湿润培养箱中培养,定期进行换液及传代,取对数生长期细胞进行后续实验。
1.3 慢病毒载体转染K1细胞株实验分为3组,分别为空白对照组(black control group,未转染慢病毒)、阴性对照组(negative control group,转染阴性对照慢病毒)和EP4沉默组(EP4 knockdown group,转染靶向沉默EP4慢病毒)。取对数生长期细胞,0.25%胰酶消化制成单细胞悬液,以2.5×105个细胞/孔接种于6孔板。铺板过夜后,更换新鲜培养基,分别加入阴性对照病毒液、靶向沉默EP4病毒液进行细胞感染。继续培养12 h后,更换为新鲜正常培养基。感染72 h后,加入含2 μg/mL嘌呤霉素的完全培养基进行嘌呤霉素抗性筛选7 d。
1.4 QRT⁃PCR实验采用TRIpure试剂裂解细胞,分别提取3组K1细胞总RNA,然后逆转录合成cDNA。按照qRT⁃PCR试剂盒说明书配制总体积为20 μL反应体系,反应条件:95℃预变性5 min;95℃变性5 s,60℃退火20 s,72℃延伸20 s,40个循环;95℃反应5 s,65℃反应1 min。β⁃actin上游引物:5′⁃ACAGAGCCTCGCCTTTGCCGAT⁃3′,下游引物:5′⁃CTTGCACATGCCGGAGCCGTT⁃3′;EP4 上游引物:5′⁃AATTCGTCCGCCTCCTTGAG⁃3′,下游引物:5′⁃CACCACCCCGAAGATGAACA⁃3′。β⁃actin作为内参基因,以 2⁃ΔΔCT法计算 EP4 基因 mRNA 的相对表达量。
1.5 Western blot实验使用RIPA裂解液分别提取3组细胞总蛋白,并用BCA法进行蛋白定量,与5×上样缓冲液混匀配平,煮沸变性后进行SDS⁃PAGE电泳。然后将蛋白转移至PVDF膜,5%脱脂奶粉室温封闭 1 h。TBS洗膜后,EP4(1∶200)、GAPDH(1∶1 000)一抗,4℃下孵育过夜。TBS洗膜后,加入IRDye 800红外荧光二抗(1∶10 000),室温孵育1 h,Odyssey扫描成像系统显像。采用Im⁃age⁃Pro Plus软件进行图像分析,GAPDH作为内参蛋白进行校正,以目的蛋白/内参蛋白的灰度比值表示目的蛋白的相对表达量。
1.6 CCK8实验将3组K1细胞消化稀释至浓度为5×104/mL的单细胞悬液,按5×103个细胞/孔接种于96孔板,同时设空白调零孔,每组设置5个平行复孔。分别在培养24、48、72 h后,每孔加入10 μL CCK⁃8溶液,继续培养2 h,用酶标仪在450 nm波长检测其吸光度。
1.7 Annexin V⁃APC/PI凋亡实验使用不含EDTA的胰酶消化细胞,每组分别收集5×105个细胞至流式管,200×g离心6 min,去除上清。分别用预冷1×PBS、1×Binding buffer各洗涤细胞1次。用100 μL 1×Binding buffer悬浮细胞后,加入5 μL AnnexinV⁃APC 溶液,室温避光孵育 10 min。200×g离心6 min,去除上清。加入含5 μL PI溶液的1×Binding buffer 200 μL重悬细胞后,4℃避光进行流式细胞仪检测。
1.8 Transwell细胞迁移实验将3组细胞消化后,用无血清培养基稀释至5×105/mL单细胞悬液,取100 μL细胞悬液加入transwell小室上室,下室加入500 μL完全培养基。在37℃,5%CO2培养箱中孵育12 h后,取出上室,弃去培养基,PBS洗涤3次。4%多聚甲醛固定30 min后,用棉签擦去上室未迁移的细胞。0.1%结晶紫染色20 min,PBS洗涤3次,显微镜下随机选择5个视野细胞并拍照计数。
1.9 统计学方法使用SPSS 13.0软件统计分析,Graphpad Prism 6.0作图,计量资料以均数±标准差表示,组间比较采用t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 构建EP4基因沉默的K1细胞株QRT⁃PCR结果显示,转染了靶向沉默EP4慢病毒后,与阴性对照组比较,K1细胞EP4 mRNA表达水平显著下调(P<0.01),而空白对照组与阴性对照组比较差异无统计学意义(P>0.05),见图1。同时,Western blot结果显示,EP4沉默组EP4蛋白表达明显少于阴性对照组(P<0.05),且两对照组之间比较差异无统计学意义(P>0.05),见图2。上述结果表明EP4基因沉默K1细胞株构建成功。
2.2 CCK8法检测K1细胞生长情况成功构建EP4敲减的K1细胞株后,采用CCK8法分别于24、48、72 h检测其细胞生长情况。结果显示,EP4沉默组K1细胞的生长较阴性对照组受到明显抑制(P<0.01),而空白对照组与阴性对照组比较差异无统计学意义(P>0.05),见图3。

图1 各组K1细胞EP4 mRNA表达水平Fig.1 Expression of EP4 mRNA in each group of K1 cells

图2 各组K1细胞EP4蛋白表达水平Fig.2 Expression of EP4 protein in each group of K1 cells

图3 EP4 shRNA对K1细胞生长的影响Fig.3 Effect of EP4 shRNA on the growth of K1 cells
2.3 Annexin V⁃APC/PI法检测K1细胞凋亡率采用AnnexinV⁃APC/PI双染细胞后,使用流式细胞仪检测3组细胞凋亡情况。结果显示,EP4沉默组较阴性对照组其细胞凋亡率显著增加(P<0.01),空白对照组及阴性对照组间比较差异无统计学意义(P<0.05),见图4。
2.4 Transwell法检测K1细胞迁移能力慢病毒转染细胞后,transwell结果显示,EP4沉默组K1细胞迁移能力较阴性对照组显著降低(P<0.01),而空白对照组与阴性对照组比较差异无统计学意义(P>0.05),见图5。

图4 EP4 shRNA对K1细胞凋亡的影响Fig.4 Effect of EP4 shRNA on the apoptosis of K1 cells
3 讨论
前列腺素E2属于花生四烯酸的衍生物,参与了肝癌[8]等多种肿瘤增殖、迁移、侵袭过程。已有研究表明,在甲状腺乳头状癌中PGE2及其关键合成酶COX⁃2呈高表达[4]。研究发现,通过 COX⁃2抑制剂阻滞PGE2合成可以显著抑制TPC⁃1细胞的生长、迁移和侵袭[5,9]。上述研究提示,PGE2在甲状腺乳头状癌的生长、侵袭及转移过程中发挥着重要作用。COX⁃2是催化花生四烯酸合成PGE2的关键限速酶,正常生理状态下在大多数组织中表达很少,而在炎症、肿瘤等病理过程中表达显著增强[7,10-11]。多项临床研究已发现抑制 COX⁃2 活性具有预防结直肠肿瘤的作用,但会增加消化道及心血管不良事件的风险,因此限制了其临床应用,而其下游EP受体成为新的研究方向[12-14]。
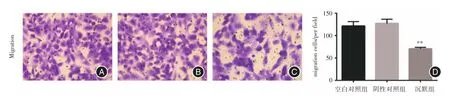
图5 EP4 shRNA对K1细胞迁移的影响(×200)Fig.5 Effect of EP4 shRNA on the migration of K1 cells(× 200)
EP4是PGE2下游受体的一种亚型,属于跨膜G蛋白偶联受体,在体内广泛分布,参与了机体肿瘤形成、心肌肥大、血管舒张与重构、骨重构、胃肠道稳态、炎症及肾和女性生殖系统功能调节等过程[6]。多项研究已证实EP4在结直肠癌、乳腺癌等多种恶性肿瘤的增殖、侵袭、转移过程起着重要作用[15-16]。同时我们前期研究发现,与癌旁正常甲状腺及良性结节性甲状腺肿组织相比,甲状腺乳头状癌肿瘤组织中EP4表达显著升高[4],这提示其可能参与了甲状腺乳头状癌发病过程,但EP4表达水平与PTC的关系尚未阐明。
由于EP4对肿瘤细胞生长具有重要作用,EP4可通过磷酸化激活下游Akt等蛋白,从而影响肿瘤细胞生长[17]。而EP4对K1细胞生长的影响尚未清楚。因此,本研究通过慢病毒转染技术,构建了EP4沉默甲状腺乳头状癌K1细胞株,以探讨EP4对K1细胞生长的影响。结果显示,通过慢病毒载体下调EP4蛋白表达后K1细胞生长受到显著抑制。在PARIDA等[18]研究中发现GW627368X可选择性阻滞EP4进而抑制宫颈癌细胞增殖及促进凋亡。同时在HANN等[19]研究中表明姜黄素可抑制头颈部多种肿瘤细胞生长,其通过下调EP4表达而发挥其抗肿瘤作用,这些研究均表明EP4在抑制肿瘤细胞生长中具有重要作用,与本研究结论一致。此外,流式细胞术结果显示EP4也参与了K1细胞凋亡过程,EP4蛋白表达下调后K1细胞凋亡显著增加,这进一步证实了EP4基因沉默具有抑制甲状腺乳头状癌细胞生长的作用。细胞迁移是肿瘤进展转移一个重要生物学过程,在ZHANG等[20]研究中发现EP4参与了肾癌细胞的迁移过程,敲减EP4可以抑制其肿瘤细胞迁移,延缓其进展。而甲状腺乳头状癌K1细胞的迁移是否受到EP4调控尚不清楚,因此本研究进一步探讨其对K1细胞迁移的影响。研究结果表明下调EP4表达可以明显抑制甲状腺乳头状癌K1细胞迁移。上述结果提示EP4可能在甲状腺乳头状癌发病中起着重要作用。
综上所述,本研究成功构建了EP4基因沉默甲状腺乳头状癌K1细胞株,并发现下调EP4基因表达能够抑制甲状腺乳头状癌K1细胞生长及诱导其细胞凋亡,并明显降低其细胞迁移能力。这提示靶向抑制EP4可能是治疗人甲状腺乳头状癌一种新的方法。EP4可通过多条信号通路发挥其作用,但EP4对K1细胞生长及迁移影响的机制目前尚不清楚,为此我们下一步将对其进行具体的机制探讨。同时由于体外培养无法完全模拟体内环境,因此我们后续将进行体内实验进行深入研究。
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115⁃132.
[2]杨雷,王宁.甲状腺癌流行病学研究进展[J].中华预防医学杂志,2014,48(8):744⁃748.
[3]KIM W B.A closer look at papillary thyroid carcinoma[J].En⁃docrinol Metab(Seoul),2015,30(1):1⁃6.
[4]SUN L,WEI X,LIU X,et al.Expression of prostaglandin E2 and EP receptors in human papillary thyroid carcinoma[J].Tu⁃mour Biol,2016,37(4):4689⁃4697.
[5]SCARPINO S,DURANTI E,STOPPACCIARO A,et al.COX⁃2 is induced by HGF stimulation in Met⁃positive thyroid papil⁃lary carcinoma cells and is involved in tumour invasiveness[J].J Pathol,2009,218(4):487⁃494.
[6]YOKOYAMA U,IWATSUBO K,UMEMURA M,et al.The prostanoid EP4 receptor and its signaling pathway[J].Pharma⁃col Rev,2013,65(3):1010⁃1052.
[7]周丹莉,艾鹤英,徐芬,等.EP4对人甲状腺乳头状癌TPC⁃1细胞生长的影响[J].中山大学学报(医学科学版),2016,37(3):396⁃401.
[8]MA J,CHEN M,XIA S K,et al.Prostaglandin E2 promotes liver cancer cell growth by the upregulation of FUSE⁃binding protein 1 expression[J].Int J Oncol,2013,42(3):1093⁃1104.
[9]KAJITA S,RUEBEL K H,CASEY M B,et al.Role of COX⁃2,thromboxane A2 synthase,and prostaglandin I2 synthase in papillary thyroid carcinoma growth[J].Mod Pathol,2005,18(2):221⁃227.
[10]STACK E,DUBOIS R N.Regulation of cyclo⁃oxygenase⁃2[J].Best Pract Res Clin Gastroenterol,2001,15(5):787⁃800.
[11]周菲菲,黄荣,蒋军,等.直肠癌环氧化酶⁃2的表达预测新辅助放疗敏感性的临床价值[J].实用医学杂志,2017,33(8):1290⁃1293.
[12]HUANG W K,CHIOU M J,YU K H,et al.The association between low⁃dose aspirin use and the incidence of colorectal cancer:a nationwide cohort study[J].Aliment Pharmacol Ther,2013,38(4):432⁃439.
[13]BÄCK M,YIN L,INGELSSON E.Cyclooxygenase⁃2 inhibitors and cardiovascular risk in a nation⁃wide cohort study after the withdrawal of rofecoxib[J].Eur Heart J,2012,33(15):1928⁃1933.
[14]COXIB AND TRADITIONAL NSAID TRIALISTS'(CNT)COL⁃LABORATION,BHALA N,EMBERSON J,et al.Vascular and upper gastrointestinal effects of non⁃steroidal anti⁃inflamma⁃tory drugs:meta⁃analyses of individual participant data from randomised trials[J].Lancet,2013,382(9894):769⁃779.
[15]WANG D,FU L,SUN H,et al.Prostaglandin E2 promotes colorectal cancer stem cell expansion and metastasis in mice[J].Gastroenterology,2015,149(7):1884⁃1895.
[16]HIKEN J F,MCDONALD J I,DECKER K F,et al.Epigene⁃tic activation of the prostaglandin receptor EP4 promotes resis⁃tance to endocrine therapy for breast cancer[J].Oncogene,2017,36(16):2319⁃2327.
[17]PARIDA S,PAREKH A,DEY G,et al.Molecular inhibition of prostaglandin E2 with GW627368X:Therapeutic potential and preclinical safety assessment in mouse sarcoma model[J].Cancer Biol Ther,2015,16(6):922⁃932.
[18]PARIDA S,PAL I,PAREKH A,et al.GW627368X inhibits proliferation and induces apoptosis in cervical cancer by inter⁃fering with EP4/EGFR interactive signaling[J].Cell Death Dis,2016,7:e2154.
[19]HANN S S,CHEN J,WANG Z,et al.Targeting EP4 by cur⁃cumin through cross talks of AMP⁃dependent kinase alpha and p38 mitogen⁃activated protein kinase signaling:the role of PGC⁃1α and Sp1[J].Cell Signal,2013,25(12):2566⁃2574.
[20]ZHANG Y,THAYELE PURAYIL H,BLACK J B,et al.Pros⁃taglandin E2 receptor 4 mediates renal cell carcinoma intravasa⁃tion and metastasis[J].Cancer Lett,2017,391:50⁃58.
