预臭氧化对含氮消毒副产物形成影响的分析与综述
2018-05-09赵慧媛刘永东钟儒刚
张 希, 赵慧媛, 刘永东, 钟儒刚
(北京工业大学 生命科学与生物工程学院, 北京 100124)
haloacetonitrile
20世纪70~80年代,在经氯消毒后的饮用水中被发现了三卤甲烷(THMs)和卤乙酸(HAAs),随后大量研究[1-3]发现THMs和HAAs等C-DBPs对人体具有显著的三致作用(致癌、致畸、致突变),所以许多国家对饮用水中这些C-DBPs的最大浓度进行了严格的限制.为了达到标准,一些饮用水厂开始变更消毒剂,用氯胺、臭氧和二氧化氯等替代氯进行消毒处理,而其中氯胺由于成本较低及消毒效果较好,已成为主要的替代消毒剂.研究[4-5]发现:与传统氯消毒相比,氯胺消毒能够明显降低THMs和HAAs等C-DBPs的含量,然而它却会导致一些毒性更强的含氮消毒副产物(N-DBPs)的生成.毒理学研究[6]表明,N-DBPs比C-DBPs具有更强的遗传毒性、细胞毒性和致癌性.此外,由于污染和富营养化等原因,现今的水体中含有愈来愈多的含氮有机物,这使得氯消毒过程中也可能导致N-DBPs的生成.因此,有关饮用水中的N-DBPs已愈来愈受到关注[7-8].
目前,对N-DBPs的研究集中在亚硝胺(NAs,主要为亚硝基二甲胺NDMA)、卤代硝基甲烷(HNMs,主要为三氯硝基甲烷TCNM)以及卤乙腈(HANs,主要为二氯乙腈DCAN),3种典型化合物的分子结构如图1所示.

图1 3种典型含氮消毒副产物的分子结构
NDMA是结构最简单、致癌性最强的亚硝胺.美国环境保护署指出,NDMA质量浓度达到0.7 ng·L-1时会产生10-6倍的致癌风险[9].研究[3]表明,TCNM和DCAN对于哺乳类动物的胆固醇细胞具有较强的基因致毒性,遗传毒性远超过HAAs,可以直接引起DNA的基因损伤.另外,DCAN可诱导哺乳动物卵巢细胞中DNA发生姐妹染色单体互换,甚至会引发皮肤肿瘤.
近年来,水质污染问题日益严重,常规的消毒处理工艺已经无法满足饮用水水质要求,在常规消毒处理工艺之前增加预处理工艺常常可以提高消毒效率.臭氧化预处理可以去除水中的异味和异臭、氧化铁锰等重金属,并且还可以起到一些助凝作用.有研究[10-11]表明,臭氧化预处理能够对C-DBPs(如THMs,HAAs)和N-DBPs(如NAs)的形成具有控制作用.
为此,本研究基于3类N-DBPs的形成机理,阐述臭氧化预处理对氯(胺)消毒处理过程中N-DBPs生成势影响的研究进展及今后的研究方向.
1 亚硝基二甲胺
1.1 亚硝基二甲胺的形成机理
亚硝基二甲胺(NDMA)具有很强致癌性,是在饮用水中检出率最高的一种NAs.研究发现在氯(胺)消毒过程中,胺类化合物是NDMA的主要前体,包括仲胺、叔胺和季胺[12-15].
图2为消毒处理水中DMA生成NDMA的机理示意图.对于仲胺(如二甲胺DMA)生成NDMA的反应机理,文献[14]认为在氯化作用下,HClO可以和水中的NO2-生成硝酰氯(NO2Cl),NO2Cl会与NO2-反应生成N2O4,ON-O-NO2结构的N2O4能够亚硝化DMA形成NDMA.氯胺化作用下,文献[15]提出DMA与二氯胺(NHCl2)反应生成氯代的二甲基肼(Cl-UDMH),Cl-UDMH又被氧气氧化成为NDMA.

图2 消毒处理水中DMA生成NDMA的机理示意图
图3为消毒处理水中三级胺生成NDMA的机理示意图.对于三级胺生成NDMA的反应机理,文献[16]认为三甲胺(TMA)首先转化成了亚胺离子,随后该离子可以通过水解、或与NO2-,N2O3作用形成NDMA.文献[17]提出在氯胺化作用下,以雷尼替丁(RNTD)为代表的含有(CH3)2N-基团、且胺基的β位含有芳香基团的三级胺,通过亲核取代反应、氧化反应、脱水反应及亚硝化反应生成NDMA,其中亚硝化反应是控速步骤.
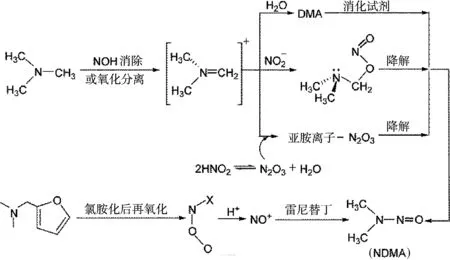
图3 消毒处理水中三级胺生成NDMA的机理示意图
1.2 预臭氧化对NDMA生成势的影响
研究发现臭氧化预处理可以改变氯(胺)消毒过程中NDMA的生成势,目前的报道主要集中在对如图4所示的18种前体胺的研究[12,18-19],根据预臭氧化对NDMA生成势的不同影响效果,将前体胺分类整理于表1中.

图4 臭氧化预处理的NDMA前体的分子结构

NDMA生成势变化仲胺、叔胺和季胺类化合物前体无显著变化DMAab,TMAab,DMEAa,DMFAa,DMDCa,DMANab,DMPhAb,DMSb,DRNb,MBb,polyDADMACb降低DMAIa,DMAPa显著降低DMBzAb,RNTDb,DMiPAb升高UDMHb,DMNZDb
注: a来自文献[18]; b 来自文献[19].
研究[18-19]表明,DMA, TMA, DMEA, DMFA, DMDC, DMAN, DMPhA, DMS, DRN, MB和polyDADMAC经过臭氧-氯胺消毒后,NDMA的生成势并无显著变化.文献[18]研究发现,pH=7.0时,经过5 min臭氧化预处理后,DMA,TMA和DMAN的NDMA生成势从原来只进行氯胺消毒时的2.90%,1.20%和1.15%分别降低到0.10%, 0.04%和0.15%.文献[19]研究发现,pH=7.5时,DMA,TMA和DMAN的NDMA生成势从原来的1.50%,1.60%和0.20%分别变为1.60%,0.10%和0.60%.以上的结果差异是由于不同的试验条件及数据分析方法导致的.其余的7种胺经过臭氧-氯胺消毒后,NDMA生成势都稍有下降,最大下降量也仅为1.90%(除polyDADMAC升高了约0.20%).
研究[18]表明:TMA,DMEA,DMFA,DMDC,DMAN和polyDADMAC经过臭氧化作用,会释放出DMA,而DMA的NDMA生成势与这些前体胺并无明显差异,这很可能是由于经过臭氧-氯胺消毒后,这些三级胺的NDMA生成势无明显变化.研究[18]发现:在臭氧-氯胺消毒后,DMAI和DMAP的NDMA生成势降低了;经过臭氧化预处理5 min,二者的NDMA生成势从原来的6.15%和4.30%分别下降到0.45%和0.15%.研究[19]发现:DMiPA,RNTD和DMBzA经过臭氧-氯胺消毒后,NDMA的生成势显著降低;3种胺经过5 min的预臭氧化,NDMA生成势全部从70.00%以上下降到2.00%以下.所以,以上三级胺经过臭氧化预处理后被转化为DMA,而DMA的NDMA生成势与这三种前体相比是非常低的,所以预臭氧化导致了这三种前体的生成势显著降低.
对于UDMH和DMNZD,经过5 min臭氧化预处理,它们的NDMA生成势从原来的小于2.00%提高到大于50.00%以上,UDMH甚至达到78.00%.因此,推测预臭氧化使UDMH和DMNZD直接生成了NDMA,所以在随后的氯胺消毒过程中,NDMA的产率表现出了显著的提高.
除了UDMH和DMNZD,研究[20-21]表明,如图5所示的这4种三级胺FDH, ADMH, FDMH和TMCH,由于它们的第2个氮和(CH3)2N-基团直接相连,所以它们在臭氧化下NDMA的生成势都高于80.00%.因此,推测这4种三级胺经过臭氧-氯胺消毒后,其NDMA生成势也会显著提高.

图5 臭氧化下具有NDMA高转化率的
2 三氯硝基甲烷
2.1 三氯硝基甲烷的形成机理
三氯硝基甲烷(TCNM)是最早被发现的HNMs类饮用水消毒副产物,在溴离子含量较低时,TCNM在HNMs中所占比重最大.因此,水中被检出的HNMs主要集中在TCNM上.研究[22-24]表明,氨基酸类、胺类、二肽类、嘌呤类、嘧啶类和吡咯类物质都是氯(胺)消毒过程中生成TCNM的前体物质.图6为消毒处理水中由MMA和天冬氨酸生成TCNM的机理.
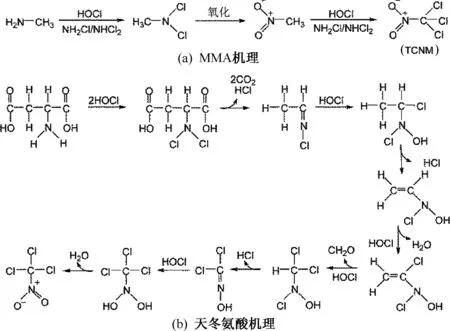
图6 消毒处理水中由MMA和天冬氨酸生成TCNM的机理
文献[23]提出了一甲胺(MMA)在氯(胺)消毒过程中生成TCNM的反应机理,如图6a所示.首先氯(胺)使胺基氢被氯化,随后氯化了的甲胺被氧化形成硝基甲烷,硝基甲烷中甲基氢再被氯化形成TCNM.文献[24]发现,天冬氨酸在氯消毒过程中可以形成TCNM,反应机理如图6b所示.首先,氨基酸通过氯化、脱羧作用和HCl的消去形成氯化了的亚胺,亚胺经过氯的氧化和HCl的消去形成含有碳碳双键的中间产物,中间产物进一步被氯氧化,并消去H2O,使双键C上的一个氢被氯取代,随后氯继续氧化碳碳双键,并脱去CH2O,得到的产物再通过消去HCl及氯的氧化,最后通过脱氢作用形成TCNM.
2.2 预臭氧化对TCNM生成势的影响
文献[25-27]分别对19种TCNM前体经臭氧化预处理后TCNM生成势的影响进行了报道.根据预臭氧化对TCNM生成势的不同影响效果,将前体胺分类整理于表2中.图7为臭氧化预处理的19种TCNM前体的分子结构.

表2 预臭氧化对部分胺类化合物TCNM生成势的影响
注: c来自文献[25]; d来自文献[26]; e来自文献[27].
研究[25-26]表明,Aspartic Acid,Alanine,Ananylalanine,3-Amimophenol,Glutamic Acid,Histidine,Cysteine, Serine,Glucosamine,Galactosamine,N-acetylglucosamine和N-acetylneuraminic Acid经过臭氧-氯消毒后,TCNM的生成势并无显著变化.文献[25]发现,pH=7时,经过15 min臭氧化预处理,Aspartic Acid和Alanine的TCNM生成势从原来只进行氯消毒时的0.07%和0.02%分别变为0.21%和0.77%,但仍小于1.00%.文献[26]发现,pH=8时,经过5 min臭氧化预处理,这两种胺TCNM的生成势从原来的0.053%和0.015%分别变为0.080%和0.038%.其余10种氨基酸和氨基糖,未进行臭氧化预处理时,其TCNM生成势为0~0.081%,预臭氧化使其TCNM生成势都稍有提高,但最大升高量也仅为0.200%,较之前无明显变化.

图7 臭氧化预处理的TCNM前体的分子结构
文献[26]发现:臭氧-氯消毒使Lysine和Glycine的TCNM生成势升高了;经过臭氧化预处理5 min,二者TCNM生成势从原来的0分别增加到了1.100%和8.100%.文献[27]发现:pH=7时,经过臭氧-氯消毒Methylamine的TCNM生成势从只进行氯消毒时的不到0.01%[23]增加到了接近50.00%,显著升高;同样地,预臭氧化使Monoethanolamine, Sarcosine, N-methylethanolamine, N-methylpropy-lamine和Diethanolamine的TCNM生成势也分别显著升高到了59.00%,51.00%,52.00%,53.00%和56.00%.因此,推测预臭氧化能提高氯消毒过程中TCNM生成势的原因可能是臭氧的较强氧化能力,使TCNM的前体生成了硝基中间体,进而使TCNM的生成势随之升高.
对废水、天然水体和工厂处理水的研究[28-29]表明,在3种水体中,臭氧预氧化都会提高TCNM的生成势.在废水中,臭氧-氯消毒过程的TCNM产率高于臭氧-氯胺消毒,而这2种情况下TCNM的产率都高于单纯的氯(胺)消毒.文献[28]发现:对于天然水体,在臭氧-氯消毒过程中,TCNM和一溴二氯硝基甲烷(BDCNM)是最主要的2种HNMs,TCNM的生成势高于单独的氯消毒,而且超过了其含量的最低报告水平(MRLs);臭氧-氯胺消毒过程形成TCNM的含量也高于单独氯胺消毒,但一般低于MRLs.
3 二氯乙腈
3.1 二氯乙腈的形成机理
二氯乙腈(DCAN)是一种新兴的N-DBPs,氨基酸类、胺类以及一些嘌呤、嘧啶和吡咯类化合物是其前体物质[30].在氯(胺)消毒过程中,DCAN的形成机理普遍认为有2种.图8为消毒处理水中由天冬氨酸和乙醛生成DCAN的机理[8,31].

图8 消毒处理水中DCAN的生成机理
由图8可知:一种途径是脱羧酸途径,即在氯化作用下,天冬氨酸被氯化形成二氯化胺,随后通过HCl的消去和脱羧过程形成乙腈,乙腈继续氧化形成DCAN[8].另一种途径是醛途径,即氯胺与乙醛反应形成的中间体发生脱水反应,生成氯化亚胺,随后亚胺通过HCl的消去形成乙腈,乙腈继续氧化形成DCAN[8].文献[31]研究表明,氨基酸在氯胺作用下形成DCAN的机理可能与氯化作用相似.但是由于无机的氯胺转化为+1价的Cl较难,因此氯胺作用下的反应速率较慢[8].
3.2 预臭氧化对卤代腈生成势的影响
迄今为止,对DCAN前体进行臭氧化预处理的研究还比较少.文献[32]研究表明:在含有藻类的水源中,当pH=7时,臭氧-氯消毒可以使藻类细胞胞外有机物质的DCAN生成势下降,但却会提高胞内有机物质的DCAN生成势;当pH=8时,臭氧-氯胺消毒会同时降低细胞内外有机物质的DCAN生成势,这表明臭氧可以有效地破坏DCAN的前体.文献[33]研究表明:对湖水水样进行臭氧化预处理时,使用低浓度臭氧时,DCAN的生成势降低不明显;使用高浓度臭氧时,DCAN生成势会显著降低.
4 结语与展望
臭氧化预处理能对氯(胺)消毒处理过程中产生的C-DBPs和N-DBPs具有控制作用.臭氧化预处理在大部分情况下都可以降低氯(胺)消毒过程中N-DBPs的生成,然而对于一些特殊的水体,可能由于N-DBPs高生成势前体的存在,臭氧化预处理反而使得N-DBPs的生成升高了.
臭氧化预处理仍然存在以下问题需要进一步深入研究:目前臭氧化预处理对N-DBPs生成势影响的研究还处于初级阶段,还有很多前体预臭氧化后N-DBPs生成势的变化原因尚不清楚,有待进一步探究;针对臭氧化预处理在降低部分N-DBPs的生成势的同时,也会使一部分N-DBPs的生成势升高的问题,应该如何利用不同的水质条件开展废水处理还需深入探讨;结合其他预处理方式的优点,如何将臭氧化预处理与其处理方式相结合,以达到更好的处理效果也有待研究.
参考文献(References)
[ 1 ] CHRISTMAN R F, NORWOOD D L, MILLINGTON D S, et al. Identity and yields of major halogenated pro-ducts of aquatic fulvic acid chlorination[J]. Environmental Science & Technology, 1983, 17(10): 625-628.
[ 2 ] RICHARDSON S D, PLEWA M J, WANGER E D, et al. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: a review and roadmap for research[J]. Mutation Research, 2007, 636(1/2/3): 178-242.
[ 3 ] STALTER D, O′MALLEY E, VON GUNTEN U, et al. Fingerprinting the reactive toxicity pathways of 50 drin-king water disinfection by-products[J]. Water Research, 2016, 91: 19-30.
[ 4 ] DAIBER E J, DEMARINI D M, RAVURI S A, et al. Progressive increase in disinfection byproducts and mutagenicity from source to tap to swimming pool and spa water: impact of human inputs[J]. Environmental Science & Technology, 2016, 50(13): 6652-6662.
[ 5 ] BOND T, TEMPLETON M R, KAMAL N H M, et al. Nitrogenous disinfection byproducts in English drinking water supply systems: occurrence, bromine substitution and correlation analysis[J]. Water Research, 2015, 85: 85-94.
[ 6 ] PLEWA M J, MUELLNER M G, RICHARDSON S D, et al. Occurrence, synthesis, and mammalian cell cytotoxicity and genotoxicity of haloacetamides: an emerging class of nitrogenous drinking water disinfection bypro-ducts[J]. Environmental Science & Technology, 2008, 42(3): 955-961.
[ 7 ] SGROI M, VAGLIASINDI F G A, SNYDER S A, et al. N-nitrosodimethylamine (NDMA) and its precursors in water and wastewater: a review on formation and removal[J]. Chemosphere, 2018, 191: 685-703.
[ 8 ] SHAH A D, MITCH W A. Halonitroalkanes, halonitriles, haloamides, and N-nitrosamines: a critical review of nitrogenous disinfection byproduct formation pathways[J]. Environmental Science & Technology, 2012, 46(1): 119-131.
[ 9 ] USEPA Integrated Risk Information System (IRIS). CASRN 62-75-9:N-Nitrosodimethylamine[S]. Wa-shington, USA: EPA, 2002.
[10] CHEN W H, HUANG T H, WANG C Y. Impact of pre-oxidation on nitrosamine formation from a source to drinking water: a perspective on cancer risk assessment[J]. Process Safety and Environmental Protection, 2018, 113: 424-434.
[11] SELBES M, GLENN M, KARANFIL T. The role of pre-oxidation in controlling NDMA formation: a review[J]. Recent Advances in Disinfection By-Products, 2015, 1190:151-172.
[12] KRASNER S W, MITCH W A, MCCURRY D L, et al. Formation, precursors, control, and occurrence of nitrosamines in drinking water: a review[J]. Water Research, 2013, 47: 4433-4450.
[13] PARK S H, PADHYE L P, WANG P, et al. N-nitrosodimethylamine (NDMA) formation potential of amine-based water treatment polymers: effects of in situ chloramination, breakpoint chlorination, and pre-oxidation[J]. Journal Hazardous Material, 2015, 282: 133-140.
[14] CHOI J H, VALENTINE R L. N-nitrosodimethylamine formation by free-chlorine-enhanced nitrosation of dimethylamine[J]. Environmental Science & Technology, 2003, 37(21): 4871-4876.
[15] SCHREIBER I M, MITCH W A. Nitrosamine formation pathway revisited: the importance of chloramine speciation and dissolved oxygen[J]. Environmental Science & Technology, 2006, 40(19): 6007-6014.
[16] SUN Z, LIU Y D, ZHONG R G. Theoretical investigation of N-nitrosodimethylamine formation from nitrosa-tion of trimethylamine[J]. Journal of Physical Chemistry A, 2010, 114(1): 455-465.
[17] LIU Y D, SELBES M, ZENG C C, et al. Formation mechanism of NDMA from ranitidine, trimethylamine, and other tertiary amines during chloramination: a computational study[J]. Environmental Science & Techno-logy, 2014, 48(15): 8653-8663.
[18] LEE C, SCHMIDT C, YOON J, et al. Oxidation of N-nitrosodimethylamine (NDMA) precursor with ozone and chlorine dioxide: kinetics and efffect on NDMA formation potential[J]. Environmental Science & Techno-logy, 2007, 41(6): 2056-2063.
[19] SELBES M, KIM D, KARANFIL T. The effect of pre-oxidation on NDMA formation and the influence of pH[J]. Water Research, 2014, 66: 169-179.
[20] LIM S, LEE W, NA S, et al. N-nitrosodimethylamine (NDMA) formation during ozonation of N,N-dimethylhydrazine compounds: reaction kinetics, mechanisms, and implications for NDMA formation control[J]. Water Research, 2016, 105: 119-128.
[21] KOSAKA K, FUKUI K, KAYANUMA Y, et al. N-nitrosodimethylamine formation from hydrazine compounds on ozonation[J]. Journal of the International Ozone Association, 2014, 36(3): 215-220.
[22] YANG X, SHEN Q Q, GUO W H, et al. Precursor and nitrogen origins of trichloronitromethane and dichloroacetonitrile during chlorination/chloramination[J]. Chemosphere, 2012, 88: 25-32.
[23] JOO S H, MITCH W A. Nitrile, aldehyde, and halonitroalkane formation during chlorination/chloramination of primary amines[J]. Environmental Science & Technology, 2007, 41(4): 1288-1296.
[24] HU J, SONG H, ADDISON J W, et al. Halonitrome-thane formation potentials in drinking waters[J]. Water Research, 2010, 44: 105-114.
[25] BOND T, TEMPLETON M R, RIFAI O, et al. Chlorinated and nitrogenous disinfection by-product formation from ozonation and post-chlorination of natural organic matter surrogates[J]. Chemosphere, 2014, 111: 218-224.
[26] SHAN J H, HU J, KAPLAN-BEKAROGLU S S, et al. The effects of pH, bromide and nitrite on halonitrome-thane and trihalomethane formation from amino acids and amino sugars[J]. Chemosphere, 2012, 86(4): 323-328.
[27] MCCURRY D L, QUAY A N, MITCH W A. Ozone promotes chloropicrin formation by oxidizing amines to nitro compounds[J]. Environmental Science & Techno-logy, 2016, 50(3): 1209-1217.
[28] HU J, SONG H, KARANFIL T. Comparative analysis of halonitromethane and trihalomethane formation and speciation in drinking water: the effects of disinfectants, pH, bromide, and nitrite[J]. Environmental Science & Technology, 2010, 44(2): 794-799.
[29] ERSAN M S, LADNER D A, KARANFIL T. The control of N-nitrosodimethylamine, halonitromethane, and trihalomethane precursors by nanofiltration[J]. Water Research, 2016, 105: 274-281.
[30] YANG X, FAN C, SHANG C, et al. Nitrogenous disinfection byproducts formation and nitrogen origin exploration during chloramination of nitrogenous organic compounds[J]. Water Research, 2010, 44: 2691-2702.
[31] MITCH W A, KRASNER S W, WESTERHOFF P, et al. Occurrence and formation of nitrogenous disinfection by-products, Report No. 91250[R]. Denver, USA: Water Research Found, 2008.
[32] ZHU M Q, GAO N Y, CHU W H, et al. Impact of pre-ozonation on disinfection by-product formation and spe-ciation from chlor(am)ination of algal organic matter ofmicrocystisaeruginosa[J]. Ecotoxicology & Environmental Safety, 2015, 120: 256-262.
[33] CHIANG P C, CHANG E E, CHUANG C C, et al. Evaluating and elucidating the formation of nitroge N-con-tained disinfection by-products during pre-ozonation and chlorination[J]. Chemosphere, 2010, 80: 327-333.
