青钱柳三萜酸对高糖所致的胰岛α细胞胰岛素抵抗的影响
2018-05-05王依婷赵梦鸽盛雪萍蒋翠花殷志琦
王依婷,赵梦鸽,盛雪萍,张 健,蒋翠花*,殷志琦
(1中国药科大学天然药物化学教研室&天然药物活性组分与药效国家重点实验室,南京210009;2南京中医药大学附属中西医结合医院,南京210028;3江苏省中医药研究院转化医学实验室,南京210028)
2型糖尿病(type 2 diabetes,T2DM)是一种以高血糖为特征的慢性代谢性疾病,可引发肾功能衰竭、心脏病发作、失明、下肢坏疽等并发症[1]。据世界卫生组织最新报告统计,2014年全球约有4.22亿糖尿病患者,其中T2DM患者超过90%[2]。“双激素异常假说”认为糖尿病的主要病因不仅是胰岛素不足,也与胰高血糖素的相对或绝对过多有关[3-4]。而胰高血糖素分泌过多的原因之一是α细胞的胰岛素抵抗。在高糖、炎症等持续刺激下,胰岛α细胞可能会产生原发性的胰岛素抵抗,胰岛素受体-1(IRS-1)、磷脂酰肌醇3激酶(PI3K)及其胰岛素信号通路中下游蛋白激酶B(Akt)的表达明显降低,与此同时外源性胰岛素对胰高血糖素分泌的抑制作用明显减弱,胰高血糖素分泌异常增加,引起血糖急剧上升[5-7]。因此通过干预IRS-1/PI3K/Akt信号通路改善α细胞胰岛素抵抗可能是治疗T2DM的有效途径之一。
青钱柳(Cyclocarya paliurus)为胡桃科青钱柳属植物,是我国特有物种[8]。现代药理学研究表明,青钱柳具有降血糖、降血脂等功效[9-12]。本课题组前期研究发现,青钱柳叶富含三萜酸部位可通过影响小鼠脂肪组织中IRS-1/PI3K/Akt信号通路传导而改善胰岛素抵抗,其对胰岛α细胞胰岛素抵抗是否具有调节作用有待研究[13]。本文拟采用高糖诱导小鼠胰高糖素瘤细胞株(αTC1-6)建立胰岛素抵抗细胞模型,探究青钱柳三萜酸对胰岛α细胞胰高血糖素分泌的影响及其可能的干预机制[14]。
1 材 料
1.1 试 剂
DMEM培养基(低糖)、HEPES[4-(2-羟乙基)-1-哌嗪乙磺酸]、双抗(青霉素和链霉素)、MEM非必需氨基酸(美国Gibco公司);胎牛血清(美国ScienCell公司);胰蛋白酶-EDTA消化液、噻唑兰MTT、PBS溶液(江苏凯基生物技术股份有限公司);二甲基亚砜DMSO、RIPA裂解液、PMSF、渥曼青霉素、Anti-Glucagon antibody(美国Cell Signaling Technology公司);KRBH缓冲液(广州沛瑜生物制品有限公司);胰岛素(美国 Sigma公司);Trizol Reagent(美国Life Technologies公司);葡萄糖检测试剂盒(上海荣盛生物药业有限公司);胰高血糖素ELISA试剂盒(美国R&D公司);引物、DEPC水(上海捷瑞生物工程有限公司);SYBR Green Realtime PCR Master Mix、ReverTra Ace qPCR RTMaster Mix with gDNA Remover[东洋纺(上海)生物科技有限公司];其他试剂均为市售分析纯。
1.2 仪 器
倒置荧光显微镜(德国 Carl Zeiss公司);Microfuge 22R台式微量冷冻离心机(美国Beckman Coulter公司);恒温干燥箱Synergy H1多功能酶标仪(美国 Biotek公司);QuantStudio®Dx Real-Time PCR循环仪;S1000 PCR热循环仪(美国Bio-Rad公司)。
1.3 药 物
青钱柳采自南京林业大学(GPS坐标:N32°04′46.95″,E118°48′47.40″),由中国药科大学中药资源与开发教研室秦民坚教授鉴定为Cyclocarya paliurus(Batal)Iljinskaja。样本保存于中国药科大学天然药化教研室(No.L20100033)。取青钱柳干燥粉末2.5 kg用80%乙醇回流提取(20 L×3,每次2 h)。合并提取物,减压浓缩无醇味后加适量水混悬,用石油醚脱脂并用氯仿分离,得到氯仿部位提取物171.9 g。取部分氯仿提取物用3%NaOH水溶液提取后,水相部分用5%HCl溶液反复萃取3次,得到三萜酸富集部位84.7 g(得率为3.39%)。
1.4 细胞株
小鼠胰高糖素瘤细胞株αTC1-6,购买自美国ATCC细胞库。
2 方 法
2.1 细胞胰岛素抵抗模型建立
2.1.1 高糖对αTC1-6细胞毒性的影响 将对数生长期αTC1-6细胞消化后,以每孔7.5×103个细胞的密度接种于96孔板中,细胞贴壁后将含有11 mmol/L葡萄糖的培养基换成含有 5.5、25、30和33 mmol/L葡萄糖的DMEM培养基,分别培养1、3、5和7 d后,每孔加入5 mg/mLMTT 20μL,孵育4 h,吸去上清液,每孔加入DMSO溶液150μL,振荡10 min,570 nm处测定吸收度(A)。
2.2.2 高糖对αTC1-6细胞胰高血糖素分泌的影响 取对数生长期αTC1-6细胞,以每毫升2.5×105个细胞的密度接种于12孔板中,细胞贴壁后分别给予含有5.5、25、30和33 mmol/L葡萄糖的DMEM培养基,分别培养1、3、5和 7 d,用 ELISA试剂盒测定上清液中的胰高血糖素含量。
2.3 TAE对αTC1-6细胞活力的影响
待αTC1-6细胞生长密度达到85%~90%时,按照每孔7.5×103个细胞的密度接种于96孔板中,细胞贴壁后吸去培养基,加入不完全DMEM培养基(11 mmol/L)和待测药物,药物的质量浓度分别为1、2、5、10、15、20、25和 30μg/mL。加药孵育 24 h后,方法同“2.1.1”,测定MTT,计算细胞活力。
2.4 TAE对αTC1-6细胞胰高血糖素分泌的影响
αTC1-6细胞以每孔5×105个细胞的密度接种于6孔板,分别给予含5.5,25 mmol/L葡萄糖的DMEM培养基培养5 d后,共分为两大组:加胰岛素组(100 nmol/L)和不加胰岛素组。每组再分为6组,分别为正常对照组(5.5 mmol/L葡萄糖)、模型组(25 mmol/L葡萄糖)、青钱柳氯仿部位三萜酸组(TAE,1、5、10μg/mL)和 10μg/mL TAE+PI3K抑制剂渥曼青霉素(10 nmol/L)组。各组用对应葡萄糖的浓度DMEM培养5 d后,将培养基换为不含血清的DMEM培养基,同时加入药物孵育20 h后,加入胰岛素孵育4 h。孵育完成后,吸去上清液,KRBH溶液清洗两遍,然后用KRBH溶液孵育30 min,吸去上清液,再用含1 mmol/L葡萄糖的KRBH缓冲液(0.5%BSA)孵育1.5 h,留取上清液,于-20℃保存,ELISA试剂盒检测胰高血糖素含量。同时抽提各孔细胞总蛋白,采用BCA定量试剂盒测定蛋白浓度,以校正胰高血糖素浓度。
2.5 Real-time PCR实验
αTC1-6细胞按照“2.4”项下方法处理后,PBS液清洗细胞两次,用Trizol试剂提取细胞RNA,酶标仪测定A260/280及其浓度。RNA在65℃条件下预变性5 min后,立即置于冰上,按照反转录试剂盒说明配制体系,将RNA反转录为cDNA,反映参数为:37℃,15 min;50℃,5 min;98℃,5 min。按照PCR试剂盒配置反应体系后进行PCR反应,反应参数为:95℃,15 s;60℃,15 s;72℃,45 s。其中,95℃预变性60 s;共循环40次。测得各基因引物序列见表1。

Table 1 Primer sequence for real-time PCR assay
2.6 Western blot分析
细胞按照“2.4”项处理后,PBS液清洗细胞两次,每孔加蛋白裂解液150μL在冰上裂解5 min,吹打细胞数次,收集细胞,0℃超声波破碎3次,冰上放置30 min后在-20℃和37℃之间反复冻融3次,12 000 r/min离心 10 min,收集上清液,用BCA试剂盒测定蛋白浓度。将蛋白质样品稀释至相同且合适的浓度进行SDS-PAGE电泳(电泳条件:85 V,20 min;120 V,80 min),然后转移至 PVDF膜上在5%脱脂奶粉封闭液中室温封闭1 h,加入一抗(1∶800)4℃过夜,之后加入二抗(1∶2 000)37℃孵育2 h,采用电化学发光检测法(ECL检测法)显色,并对感光胶片条带进行灰度值分析。
2.7 数据分析
3 结 果
3.1 αTC1-6细胞胰岛素抵抗模型的建立
高浓度葡萄糖培养基分别培养αTC1-6细胞1、3、5和7 d后,测定不同糖浓度培养下αTC1-6细胞培养液中胰高血糖素含量。结果显示葡萄糖浓度超过25 mmol/L,培养时间超过5 d时,胰高血糖素分泌明显升高(图1)。其中葡萄糖浓度为25 mmol/L,培养时间为5 d时,不仅可以显著增加胰高血糖素分泌(P<0.05),且数据稳定性较好,故采用葡萄糖含量为25 mmol/L的培养基培养5 d建立αTC1-6细胞胰岛素抵抗模型。

Figure 1 Time-and dose-dependency of glucose-induced glucagon secretion inαTC1-6 cells)*P<0.05,**P<0.01 vs5.5 mmol/L for 1 day
3.2 TAE对αTC1-6细胞活力的影响
如图 2所示,MTT法检测 1、2、5、10、15、20、25和30μg/mL青钱柳三萜酸的细胞毒性实验结果显示,与正常对照组相比,质量浓度为1、2、5、10和15μg/mL的青钱柳三萜酸细胞活力明显大于90%,无细胞毒性,故选择 1、5、10μg/mL 3个质量浓度进行相关实验内容。

Figure 2 Effect of triterpenic acid-enriched fraction from Cyclocarya paliurus(TAE)on cell viability ofαTC1-6 cells.αTC1-6 cells were treated with different concentration of TAE for24 h,and then cell viability wasmeasured by MTT assay(¯x±s,n=6)*P<0.05,**P<0.01 vs control group
3.3 TAE对αTC1-6细胞胰高血糖素分泌的影响
如图3所示,与正常对照组相比,高糖模型组胰高血糖分泌量显著增加(P<0.05)。与模型组相比,青钱柳三萜酸 1、5和 10μg/mL作用于αTC1-6细胞模型24 h后,给药组细胞的胰高血糖素分泌量明显降低,并存在浓度依赖性。胰岛素条件下,正常对照组和模型组的胰高血糖素分泌量均下降,说明胰岛素可以抑制胰高血糖素的分泌。而青钱柳三萜酸各给药组胰高血糖素显著下降,说明其可降低胰高血糖分泌且具有一定的胰岛素依赖性。
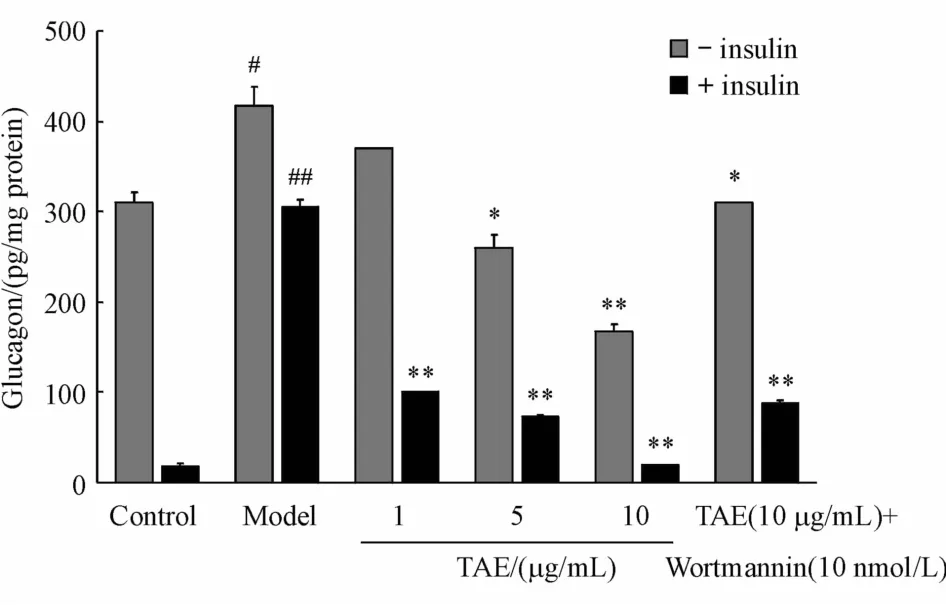
Figure 3 Effect of TAE on glucagon secretion inαTC1-6 cells.αTC1-6 cellswere incubated for5 days in DMEM media containing5.5mmol/L glucose or 25 mmol/L glucose in the presence or absence of different concentration of TAE for24 h with orwithout insulin(100 nmol/L)for 4 h.Wortmannin(10 nmol/L)was added 30 minutes before insulin at the last group#P<0.05,##P<0.01 vs contol group;*P<0.05,**P<0.01 vs model group
3.4 TAE对αTC1-6细胞中IRS-1、PI3K和Akt磷酸化水平的影响
与正常对照组相比,高糖刺激下模型组的IRS-1、PI3K、Akt含量均降低,符合糖尿病症状(图4)。TAE干预后,IRS-1、PI3K和 Akt的磷酸化水平较模型组显著上升,并具有浓度依赖性(P<0.05)。加入PI3K抑制剂渥曼青霉素后,PI3K和Akt的蛋白水平有所降低(图4)。
3.5 TAE对αTC1-6细胞胰高血糖素、IRS-1、PI3K和Akt的mRNA表达的影响
如图5显示,不加胰岛素时,与正常对照组相比,模型组的胰高血糖素mRNA水平明显提高,并具有显著性差异(P<0.05),IRS-1、PI3K和Akt水平均显著性降低。与模型组相比,TAE(10μg/mL)能够轻微降低胰高血糖素的基因表达并增加IRS-1、PI3K和Akt的表达。加入胰岛素后,与正常对照组相比,模型组胰高血糖素的表达轻微增加,IRS-1、PI3K和Akt水平都显著性降低;与模型组相比,TAE能够显著性降低胰高血糖素的表达并显著性增加IRS-1、PI3K和Akt的表达,差异有统计学意义(P<0.05)。而PI3K抑制剂渥曼青霉素的加入能够逆转TAE对PI3K和Akt的作用。

Figure 4 Effects of TAE on protein levels of IRS-1,PI3K and Akt inαTC1-6 cells.αTC1-6 cellswere incubated for5 days in DMEM media containing5.5 mmol/L glucose or25 mmol/L glucose in the presence or absence of different concerntration of TAE for24 h with insulin(100 nmol/L)for 4 h.P-IRS-1(A),p-PI3K(B)and p-Akt(C)wasmeasured by Western blot(¯x±s,n=3)#P<0.05,##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group
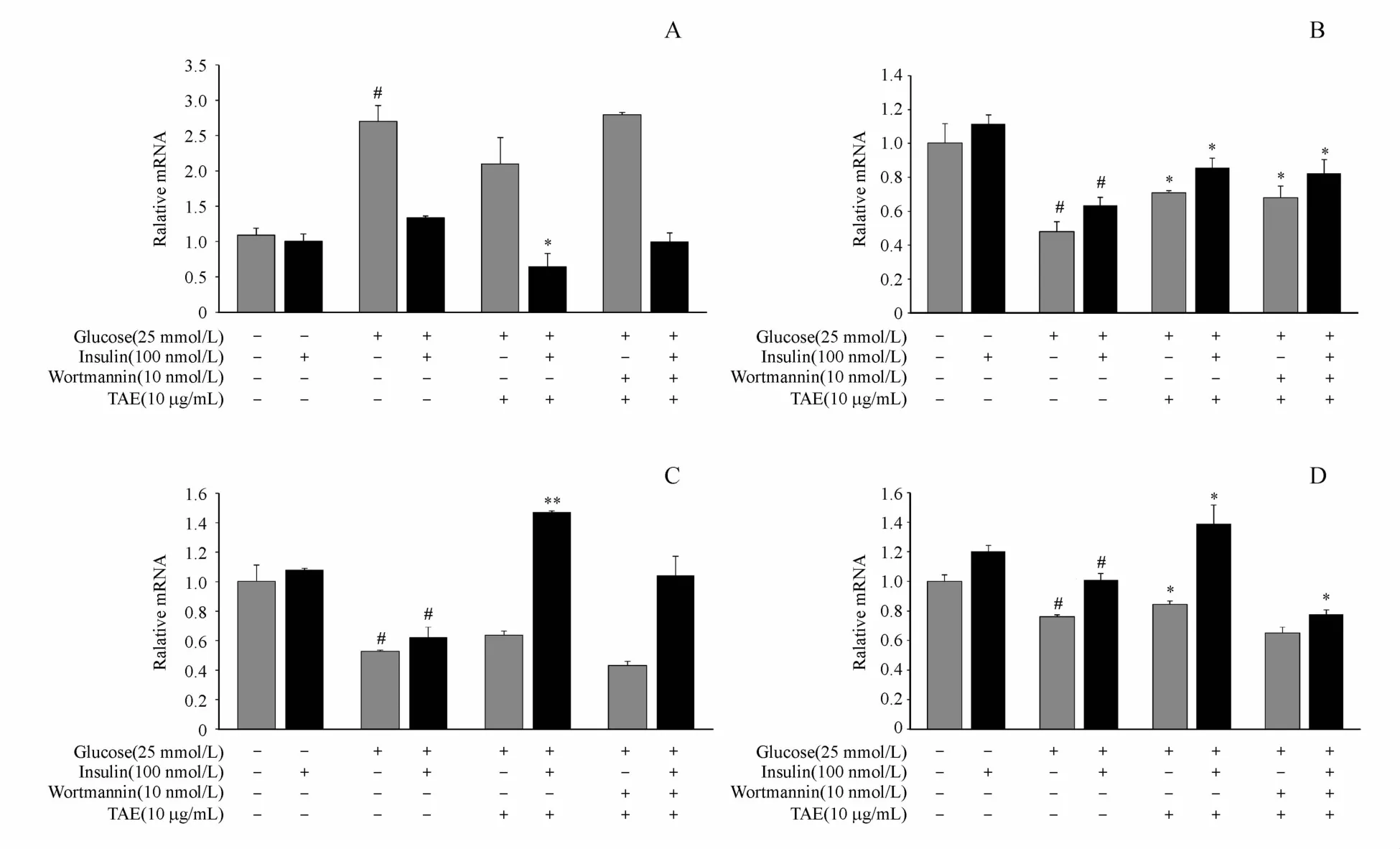
Figure5 Effectsof TAE on geneexpression inαTC1-6 cells.αTC1-6 cellswere incubated for5 days in DMEMmedia containing5.5mmol/L glucose or 25 mmol/L glucose in the presence or absence of10μg/mL TAE for24 h with orwithout insulin(100 nmol/L)for4 h,gene expression levels in αTC1-6 cellswere determined and normalized to GAPDH.Data isexpressed as relative level to5.5 mmol/L glucose group without insulin.A:Glucagon levels;B:IRS-1 levels;C:PI3K levels;D:Akt levels(¯x±s,n=3).#P<0.05,##P<0.01 vs 5.5 mmol/L glucose(control group)with or without insulin*P<0.05,**P<0.01 vs25 mmol/L glucose(model group)in the absence of wortmannin and TAE with or without insulin
4 讨 论
胰岛素抵抗是2型糖尿病产生的主要病因[15]。研究表明,长期高糖环境能诱导胰岛α细胞产生胰岛素抵抗,导致胰高血糖素异常分泌,产生高血糖[16]。本实验采用25 mmol/L高糖连续培养αTC1-6细胞5 d,成功建立胰岛α细胞胰岛素抵抗模型,并考察了TAE的干预效果。实验结果显示:TAE能够显著降低高糖诱导的αTC1-6胰高血糖素分泌,升高IRS-1、PI3K、Akt的mRNA和蛋白水平,提示青钱柳三萜酸对胰岛α细胞胰岛素抵抗的改善作用可能与激活IRS-1/PI3K/Akt胰岛素信号通路有关。
αTC1-6是小鼠胰高糖素瘤细胞株,因其细胞群体均匀单一并易于培养而优选于原代胰岛细胞,是研究胰岛α细胞功能的常用细胞株之一[16-17]。此外,研究表明αTC1-6细胞在长期高糖环境下胰高血糖素分泌和基因表达的变化与原代细胞相比,没有显著性差异,表明αTC1-6细胞系具有代表性[18-19]。本实验用含 25 mmol/L葡萄糖的培养基培养αTC1-6细胞5 d后,细胞胰高血糖素分泌明显增加,胰岛素对胰高血糖素分泌的抑制作用减弱,表明长期高糖环境成功诱导αTC1-6细胞产生胰岛素抵抗,导致细胞胰高血糖素分泌异常,与文献[14,20]报道结果一致,表明 αTC1-6细胞胰岛素抵抗模型建立成功。
“双激素异常”假说认为胰高血糖素分泌过多和胰岛素分泌不足是高血糖的主要原因[2,21]。正常生理状态下,进食后血糖浓度上升,胰岛素分泌增多,胰高血糖素分泌受到抑制而减少[22]。而病理状态下,持续的高血糖会导致胰岛α细胞产生胰岛素抵抗,胰高血糖素分泌增多,加剧高血糖[23]。本实验发现 TAE可显著降低高糖诱导αTC1-6细胞的胰高血糖素分泌水平,提示其具有改善胰岛α细胞胰岛素抵抗功能。
IRS/PI3K/Akt通路是胰岛素信号转导的主要途径[24]。长期高糖刺激时,胰岛α细胞对外源性胰岛素无法产生正常应答,IRS/PI3K/Akt胰岛素信号转导通路受阻,导致胰高血糖素分泌上升[25]。本研究发现TAE能显著降低高糖诱导的αTC1-6细胞的胰高血糖素水平,增加其胞内IRS-1、PI3K和Akt的mRNA和蛋白水平。给予PI3K的抑制剂渥曼青霉素干预后,PI3K和Akt的表达明显降低,胰高血糖素水平显著上升。上述实验结果表明,TAE可以改善胰岛素抵抗,可能是通过上调IRS-1和PI3K的酪氨酸磷酸化及其下游Akt的磷酸化来恢复胰岛素信号转导起作用。
综上所述,青钱柳三萜酸部位可通过干预IRS-1/PI3K/Akt信号通路改善胰岛α细胞胰岛素抵抗,抑制胰高血糖素的分泌,达到治疗糖尿病的效果。但青钱柳三萜酸在动物体内如何调控胰高血糖素分泌及哪种类型三萜发挥药效,仍需进一步深入研究。
[1] Heller A,Feldman B.Electrochemistry in diabetesmanagement[J].Account Chem Res,2010,43(7):963-973.
[2] Organization WH.Global report on diabetes[J].Working Papers,2016.
[3] Unger R,Orci L.The essential role of glucagon in the pathogenesis of diabetesmellitus[J].Lancet,1975,1(7897):14-16.
[4] Gosmain Y,Masson MH,Philippe J.Glucagon:the renewal of an old hormone in the pathophysiology of diabetes[J].J Diabetes,2013,5(2):102-109.
[5] Unger RH,Cherrington AD.Glucagonocentric restructuring of diabetes:a pathophysiologic and therapeuticmakeover[J].JClin Invest,2012,122(1):4-12.
[6] Tsuchiyama N,Takamura T,Ando H,etal.Possible role of alphacell insulin resistance in exaggerated glucagon responses to arginine in type 2 diabetes[J].Diabetes Care,2007,30(30):2583-2587.
[7] Hong J,Jeppesen PB,Hermansen K.Effects of elevated fatty acid and glucose concentrations on pancreatic islet functionin vitro[J].Diabetes ObesMetab,2010,11(4):397-404.
[8] Wang QQ,Jiang CH,Fang SZ,et al.Antihyperglycemic,antihyperlipidemic and antioxidant effects of ethanol and aqueous extracts ofCyclocarya paliurusleaves in type 2 diabetic rats[J].JEthnopharmacol,2013,150(3):1119-1127.
[9] Fan BD,Wei Y,Li CH,et al.Research progress in chemical constituents and hpyerglycemic activity ofCyclocarya paliurus[J].Chin JExp TraditMed Form(中国实验方剂学杂志),2014,20(13):239-242.
[10]Kurihara H,Fukami H,Kusumoto A,et al.Hypoglycemic action ofCyclocarya paliurus(Batal.)Iljinskaja in normal and diabetic mice[J].JAgric Chem Soc Japan,2003,67(4):877-880.
[11]Li TT,Wu CY,Fang SZ,etal.Content stability and hypoglycemic effect ofCyclocarya paliuruscapsule[J].Sci Technol Food Ind(食品工业科技),2013,34(19):337-340.
[12]Xu G,Yoshitomi H,Wen S,et al.Cyclocarya paliurus(Batal.)Ijinskaja aqueous extract(CPAE)ameliorates obesity by improving insulin signaling in the hypothalamus of a metabolic syndrome rat model[J].Evid-Based Compl Alt,2017,2017(2):4602153.
[13]Zhu KN,Jiang CH,Tian YS,et al.Two triterpeniods fromCyclocarya paliurus(Batal)Iljinsk(Juglandaceae)promote glucose uptake in 3T3-L1 adipocytes:the relationship to AMPK activation[J].Phytomedicine,2015,22(9):837-846.
[14]Shen XX,LiHL,Pan L,etal.Glucotoxicity and cell dysfunction:involvement of the PI3K/Akt pathway in glucose-induced insulin resistance in rat islets and clonal TC1-6 cells[J].Endocr Res,2012,37(1):12-24.
[15]Godsland IF,Walton C,Wynn V.Role of glucose and insulin resistance in development of type 2 diabetes mellitus[J].Lancet,1992,340(8831):1347-1348.
[16]Kisanuki K,Kishikawa H,Araki E,et al.Expression of insulin receptor on clonal pancreatic alpha cells and its possible role for insulin-stimulated negative regulation of glucagon secretion[J].Diabetologia,1995,38(4):422-429.
[17]Mizusawa N,Hasegawa T,Ohigashi I,etal.Differentiation phenotypes of pancreatic islet beta-and alpha-cells are closely related with homeotic genesand a group of differentially expressed genes[J].Gene,2004,331(1):53-63.
[18]Piro S,Maniscalchi ET,Monello A,et al.Palmitate affects insulin receptor phosphorylation and intracellular insulin signal in a pancreatic alpha-cell line[J].Endocrinology,2010,151(9):4197-4206.
[19] Chen X,Hermansen K,Xiao J,et al.Isosteviol has beneficial effects on palmitate-inducedα-cell dysfunction and gene expression[J].PLoSOne,2012,7(3):e34361.
[20]Mcgirr R,Ejbick CE,Carter DE,etal.Glucose dependence of the regulated secretory pathway in alphaTC1-6 cells[J].Endocrinology,2005,146(10):4514-4523.
[21]Unger RH.The bantingmemorial lecture 1975.Diabetes and the alpha cell[J].Diabetes,1976,25(2):136-151.
[22]Umpaichitra V,Bastian W,Taha D,et al.C-peptide and glucagon profiles in minority children with type 2 diabetesmellitus[J].J Clin Endocr Metab,2001,86(4):1605-1609.
[23]Ferrannini E,Muscelli E,Natali A,et al.Association of fasting glucagon and proinsulin concentrations with insulin resistance[J].Diabetologia,2007,50(11):2342-2347.
[24]Diao JY,Asghar Z,Chan CB.Glucose-regulated glucagon secretion requires insulin receptor expression in pancreaticα-cells[J].JBiol Chem,2005,280(39):487-496.
[25]Kaneko K,Shirotani T,Araki E,et al.Insulin inhibits glucagon secretion by the activation of PI3-kinase in In-R1-G9 cells[J].Diabetes Res Clin Pr,1999,44(2):83-92.
