小白菊注射液对大鼠的亚慢性毒性试验研究
2018-05-04高晶晶陈成勋郭永军朱国霞董惠峰王立红张凤洪刘鼎阔
高晶晶,陈成勋,郭永军,朱国霞,李 源,董惠峰,王立红,张凤洪,刘鼎阔,4*
(1. 天津国际生物医药联合研究院 天津300450;2. 天津市水产生态及养殖重点实验室,天津农学院水产学院 天津300384;3. 天津市饲用微生物制剂企业重点实验室,鼎正动物药业(天津)有限公司 天津300383;4.中国农业大学动物医学院 北京100094)
小白菊注射液是以中药材小白菊经提取加工制成的注射液,具有清热解毒消炎的作用。主要成分为小白菊内酯,小白菊内酯是小白菊花蕾中的提取物,具有抗炎、抗肿瘤、止痛等功效[1]。目前国内外对于小白菊内酯的研究,主要集中在其对于乳腺癌、胆管癌、胰腺癌、膀胱癌、前列腺癌、白血病、黑色素瘤和神经元等疾病的抗肿瘤作用[2],对于小白菊内酯药物毒性的研究尚未见报道,本试验旨在考察小白菊注射液长期大剂量用药后可能出现的症状和严重程度,毒副反应的靶器官及其恢复和发展情况,以便为临床较长期大剂量应用提供安全性依据。
1 材料与方法
1.1 受试药物
小白菊注射液药物,批号:20170601,由鼎正动物药业(天津)有限公司提供。规格 10,mL/支(每毫升含小白菊提取物以小白菊内酯计为20.0,mg)。
1.2 实验动物
4周龄清洁级SD大鼠80只,雌雄各半,体重在130~150,g之间,由天津市实验动物中心提供,动物合格证号为:SC2017-0325。
1.3 给药剂量的选择及分组
试验设 3个给药剂量组,腹腔注射给药。本试验高剂量组大鼠给药剂量为1.5,mL/100,g体重,腹腔注射。并按等比系数 1:2,依次设定中剂量组0.75,mL/100,g体重,低剂量组按 0.325,mL/100,g体重,并设一个生理盐水对照组,0.75,mL/100,g体重,均腹腔注射。每组动物20只,雌雄各半。试验开始时动物体重的差异应不超过平均体重的±20%,。每天腹腔注射给药一次,连续给药35,d(即共5周)。
1.4 试验期间临床观察
每天观察大鼠的健康状况、采食、饮水、体重等变化。分别于第 1、2、3、4、5周称量体重,给药结束后计算平均摄食量和饲料利用率(动物每食入 100,g饲料所增长的体重克数)。将给药剂量组与对照组进行比较和统计学处理,及时记录和分析大鼠的中毒症状及出现各症状的先后次序、时间。
1.5 血液学和血液生化检测
于第4周周末,称重并采血进行血液学和血液生化指标的检测。
血液学检测包括:血红蛋白(Hg)、红细胞计数(Ec)、白细胞计数(Lc)、嗜中性(NL)、嗜酸性(AL)、嗜碱性(BL)、淋巴(LM)、单核(ML)。
血液生化检测包括:丙氨酸氨基转换酶(ALT)、天门冬氨酸转换酶(AST)、尿素氮(BUN)、肌酐(Cr)、血糖(GLU)、白蛋白(ALB)、总蛋白(TP)、总胆固醇(CHO)、甘油三酯(TG)。
1.6 病理检查
1.6.1 大体剖检
给药结束后,各组取 10只大鼠(雌雄各半)进行剖检(结合采血进行)。做好记录,并将重要器官和组织固定保存。
1.6.2 脏器称重
剖检试验大鼠的同时,称取大鼠体重及各主要脏器(包括心、肝、脾、胃、肠、肺、肾、睾丸及卵巢)重量,做好记录。计算各脏器相对重量(脏器重/体重),即脏器系数。
1.6.3 组织病理学检查
对高剂量组及对照组大鼠的主要脏器进行组织病理学检查,发现病变后再对较低剂量组大鼠的相应器官及组织进行检查。组织病理学检测项目包括:脾、肺、肝、肾、胃、肠、睾丸(♂)及子宫(♀)。
1.7 数据处理
2 结果
2.1 临床表现
各组大鼠腹腔注射给药期间各组均无死亡,临床表现正常。给药期间,各剂量组大鼠体重增重、进食情况及脏器系数与对照组相比均无显著差异(P>0.05)(见表 1、表 2和表 3)。母鼠的体重、耗料及饲料利用率较公鼠少,可解释为性别差异所造成。

表1 小白菊注射液对大鼠体重增重的影响(g)Tab.1 The effects of Parthenolide Injection on weight gain of rats
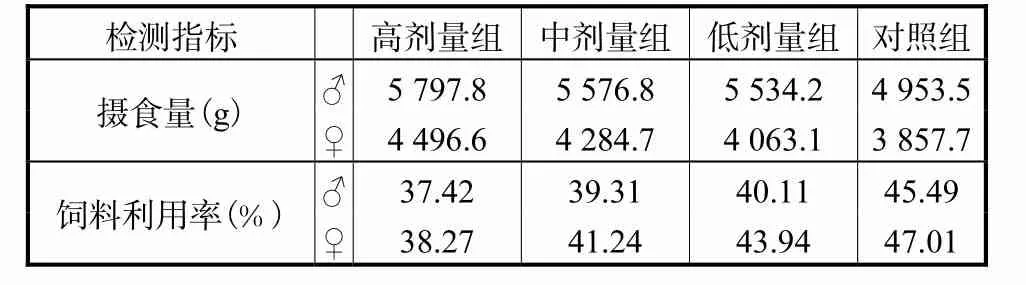
表2 小白菊注射液对大鼠进食情况的影响Tab.2 The effects of Parthenolide Injection on food intake of rats
2.2 血液学及血液生化参数
给药结束后,各组大鼠进行血液学和血液生化参数测定结果分别见表 4和表 5。统计学分析显示,与对照组相比小白菊注射液各剂量组的血液学和血液生化参数之间差异不显著(P>0.05)。

表3 小白菊注射液对大鼠脏器系数的影响(%)Tab.3 The effects of Parthenolide Injection on organ coefficient of rats

表4 小白菊注射液给药结束后大鼠血液学检测指标Tab.4 The effects of Parthenolide Injection on hematology of rats

表5 小白菊注射液给药结束后的大鼠血液生化学检测指标Tab.5 The effects of Parthenolide Injection on blood biochemistry of rats
3 讨 论
本实验室根据《新兽药一般毒性试验技术要求》[3]进行了小白菊注射液 35,d亚慢性毒性试验。本试验中,小白菊注射液连续注射35,d后,各剂量组的大鼠生长发育良好,无一死亡,大鼠增重、摄食、血常规及血液生化指标与对照组相比均未发生显著性变化(P>0.05),且均在正常范围之内。该药物注射35,d亚慢性毒性试验对大鼠各项观察指标未产生明显影响,对大鼠不显示亚慢性毒性,35,d重复给药亦无毒性反应。因此,综上所述小白菊注射液对靶动物的临床安全性在可接受范围内。
小白菊内酯可以通过其生物活性位点 ɑ-甲基-γ-内酯环这一特殊结构,与细胞中的多种功能性蛋白产生特异性结合,从而对信号通路中下游的蛋白表达进行调控[4]。有研究表明,小白菊内酯对细胞生长的抑制作用是由于其对细胞转录因子 NF-κB、STATs、JNK 的表达的抑制,诱发 ROS反应[5]。此外,小白菊内酯还具有潜在的抗炎、抗氧化等生物活性,它可通过影响COX-2、PGE2和iNOS的表达,起到抗炎作用[6]。
[1]韩琨景,丁杨,杨万山. 小白菊提取物的药理作用[J]. 医学综述,2012,18(11):1735-1737.
[2]徐惠君,佟仲生,贾勇圣,等. 小白菊内酯抗肿瘤作用机制研究进展[J]. 中成药,2013,35(9):1985-1988.
[3]中华人民共和国农业部. 新兽药一般毒性试验技术要求[S]. 1991.
[4]Kim I H,Kim S W,Kim S H,et al. Parthenolide induced apoptosis of hepatic stellate cells an anti-fibrotic effects in an in vivo rat model [J]. Experim Molec Med,2012,44(7):448.
[5]刘玉辉,欧瑜. 小白菊内酯结构及药理特性的研究进展[J]. 药物生物技术,2013(6):586-589.
[6]张辉,陶建峰,王爱军,等. 小白菊内酯对帕金森病MPTP模型小鼠抗炎作用的研究[J]. 中风与神经疾病,2015,32(2):158-160.